现场表面增强红外光谱法研究离子液体中锌电沉积过程: 水的影响
于奥秋,周 尉
(上海大学 化学系,上海 200444)
金属锌具有资源丰富、环境友好等优点.作为锌-空气电池的阳极材料,锌电极反应一直是开发高性能、长循环寿命的二次锌-空气电池的研究热点[1-2].然而,由于锌电极容易受到枝晶生成、形状变化、腐蚀以及钝化等影响,导致其寿命周期短,阻碍了可充放锌-空气电池的研究[3].另一方面,电解液的性质会直接影响锌电极反应.采用离子液体做锌-空气电池的电解液,相比传统的碱性电解液有诸多优势,包括: (1) 有效防止电解液(水)的挥发;(2) 避免由于吸收空气中CO2导致碱性电解液中碳酸盐的形成;(3) 解决水溶液中因析氢而导致的氢脆问题,提高锌-空气电池中锌阳极电沉积的可逆性;(4) 有望解决锌电极枝晶的生成问题[4-5].离子液体通常被称为“可设计溶剂”,它们的物理和化学性质(如熔点、黏度、电导率、电化学窗口等)可通过对阴离子或阳离子的结构设计而进行调整.目前,绝大多数离子液体具有较高的离子电导率、可忽略不计的挥发性、高的热稳定性和宽的电化学窗口,使得离子液体在电池、电容器等电化学器件的开发上受到广泛关注[6].
离子液体体系中的锌电极反应研究对于进一步开发可充放锌-空气电池是至关重要的.Zhang等人[7]研究了锌在非质子溶剂离子液体中的电化学行为,循环伏安结果显示,锌在由咪唑和二氰胺组成的离子液体中的氧化还原过电位小于由吡咯和双三氟甲磺酰亚胺组成的离子液体.动电位极化实验结果表明锌电极反应机理强烈依赖于离子液体的结构.在[TFSI]-离子液体中电极反应是一步两电子过程,在[DCA]-离子液体中电极反应是两步一电子过程.
另一方面,锌-空气电池作为一个开放性体系,空气中水的影响不可避免.同时,由于水的加入可以降低离子液体的黏度,提高离子液体的电导率,所以研究离子液体/水混合体系中锌的电沉积很有必要.Cammarata等人[8]的研究表明水作为溶剂会影响溶质在离子液体中的溶解性,而且,离子液体中加入水有利于Zn2+的扩散.Liu等人[9]研究了离子液体1-乙基-3-甲基咪唑三氟甲磺酸和水的相互作用,通过FTIR和拉曼光谱研究锌离子在[Emim][OTf]和[Emim][OTf]-H2O混合体系中的溶剂化作用,发现水分子的引入可改变锌离子在离子液体中的溶剂化结构.通过对3种离子液体和水的混合体系中锌电沉积的研究,发现水合锌离子的形成对锌的电沉积有显著影响[10].
由于水合锌离子的存在以及其形成的电极界面结构会显著影响锌电极反应,有必要对锌电极的界面结构进行分析研究.现场表面增强红外光谱法(Surface Enhanced Infrared Absorption Spectroscopy, SEIRAS)是表面振动光谱法中研究电化学电极界面结构最有效的方法之一[11].该方法可以用于探究电极/离子液体界面结构以及界面上离子吸附的构型.Nanbu等人[12-13]利用SEIRAS研究了不同电位下,Au/[Emim]BF4电极界面上离子吸附所形成的双电层结构.结果表明,在较负的电位下,咪唑环[Emim]+以平行的方式吸附在电极表面,而随着电位变正,咪唑环[Emim]+逐渐脱附并趋向于垂直电极取向.Motobayashi等人[14]同样采用SEIRAS研究了[Bmim][TFSI]离子液体在金电极表面的重排现象.
目前,关于离子液体中锌电极反应的研究已经有所报道,然而对于离子液体体系中影响锌电极反应的因素的探讨很少.本文分析比较了锌盐络合状态对锌电极反应的电化学效率以及可逆性的影响.同时,利用SEIRAS研究了锌电极双电层界面结构,为离子液体体系中电沉积锌的不同行为提供理论依据.
1 实验部分
1.1 试剂与仪器
主要试剂: 离子液体1-乙基-3-甲基咪唑四氟硼酸盐([Emim]BF4)(>99%,兰州化物所).Zn(BF4)2、ZnCl2、ZnSO4、Zn(NO3)2(分析纯AR,上海笛柏化学试剂).硫酸(优级纯GR,国药集团化学试剂有限公司).丙酮和乙醇(分析纯AR,国药集团化学试剂有限公司).
实验所用的主要仪器包括: 上海辰华仪器公司CHI660A型电化学工作站;昆山超声仪器有限公司KQ2200B型超声清洗仪;Etelux Lab2000真空手套箱;Thermo-Fisher公司配备MCT检测器的Nicolet iS 10红外光谱仪.
1.2 离子液体预处理
所用离子液体都在真空状态下110℃干燥12h,以除去痕量水,然后保存在氩气手套箱(φH2O<1μL/L,φO2<1μL/L)中备用.Zn(BF4)2、ZnCl2、ZnSO4、Zn(NO3)2作为锌盐,用于提供体系中的Zn2+,所制备的离子液体电解液也在上述相同实验条件下除水.
1.3 电化学测试
所用电解池为典型三电极设计,工作电极选用金(Au)圆盘电极(直径1mm),对电极采用铂(Pt)片电极,参比电极为Pt丝.实验之前需要对所用电极进行预处理.对Au电极进行“8”字打磨抛光,之后将电极浸入浓硫酸中活化数小时,最后在三电极体系(0.5mol/L的硫酸溶液做电解液,铂片做对电极,饱和甘汞电极做参比电极,清洗的电位区间0~1.6V(扫速50mV/s)中进行循环伏安电化学清洗.Pt片电极与Pt丝电极用同样的电化学方法(清洗的电位区间为-0.25~1.25V)进行清洗.
1.4 现场红外光谱测试
光谱电化学电解池为自制的三电极电解池,工作电极为镀有Au膜的半圆柱形硅柱(2×2.5cm),对电极和参比电极是自制的Pt丝.化学镀金的方法参考文献[11].化学镀金之后在三电极体系(0.5mol/L的硫酸溶液做电解液,铂片做对电极,饱和甘汞电极做参比电极,清洗的电位区间0~1.3V,扫速50mV/s)中电化学清洗金膜表面.Pt丝的清洗与1.3节的Pt电极清洗一样,电化学清洗干净以后,超纯水超声洗涤,最后烘干待用.
测试过程中使用CHI 660A电化学工作站控制电位,同时用Nicolet iS 10红外光谱仪检测光谱.为了给离子在电极表面上的吸附/脱附提供充足的时间,每个电位需要稳定5min后开始采集光谱数据.背景光谱根据每个离子液体体系的窗口定在最正的电位下采集.
2 结果与讨论
2.1 不同锌盐种类中阴离子对锌电极反应的影响

图1 [Emim]BF4体系的CV曲线Fig.1 CV curves of [Emim]BF4 system
图1是[Emim]BF4体系的循环伏安(CV)曲线.如图1(a)所示,纯[Emim]BF4离子液体在Au电极上的电化学窗口较宽,达到4V.在引入锌盐Zn(BF4)2之后可以在-2.3V处观察到一个还原峰(图1(b),并且在-2.3V处长时间保持电位便会在电极表面得到一层灰色沉淀层,表明在Au电极上电位在-2.3V左右可以得到锌沉积层.需要注意的是,电位回扫直到1.5V时也没有出现明显的氧化峰,表明Zn/Zn2+的氧化还原行为的可逆性非常差.为了进一步研究锌在离子液体体系中的电化学行为,将锌盐替换为ZnCl2.从图1(c)中可以看到非常明显的氧化峰,这说明Cl-的引入可以提高[Emim]BF4离子液体体系中锌电极反应的可逆性.同时,锌的沉积电位正移了0.71V,也就是说Cl-对锌还原过程有促进作用,但是其相应的还原电流有所降低.同时还考察了Zn(NO3)2和ZnSO4作为锌盐,对锌电极反应的影响(图1(d)和(e)).其中,Zn(NO3)2的体系中虽然电流密度也较低,但表现出良好的可逆性以及比较正的锌还原电位.引入ZnSO4表现出较差的可逆性以及电流密度,这主要是由于ZnSO4在离子液体中的溶解度低.虽然ZnSO4在高温、搅拌的条件下可以溶解在离子液体中形成乳白色液体,然而在室温下静置一段时间后便会析出沉淀,导致体系中Zn2+浓度降低,进而影响了电流密度.以上不同锌盐的比较说明改变锌盐种类对锌电极反应有明显的影响,ZnCl2体系中锌电极反应的行为较为理想.
2.2 离子液体中引入水对锌电极反应的影响

图2 (a) [Emim]BF4 (虚线)和[Emim]BF4+5%H2O(实线)的电势窗口;(b) [Emim]BF4+0.4mol/L ZnCl2+5% H2O(实线)与[Emim]BF4+0.4mol/L ZnCl2(虚线)的CVFig.2 (a) Potential window of neat [Emim] BF4(dotted line) and [Emim] BF4+5% H2O(solid line); (b) CVs of [Emim] BF4+0.4mol/L ZnCl2+5% H2O(solid line) and [Emim]BF4+0.4mol/L ZnCl2(dotted line)
如表1所示,当ZnCl2作为锌盐溶解在[Emim]BF4离子液体体系中时,不仅表现出较高的电流密度,又具有良好的可逆性,因此选择Au/[Emim]BF4+ZnCl2与Au/[Emim]BF4+ZnCl2+5% H2O两个体系做进一步的现场表面增强红外光谱研究,探讨无水以及有水状态下离子液体体系中锌电极的界面结构,并讨论其对锌电沉积行为的影响.
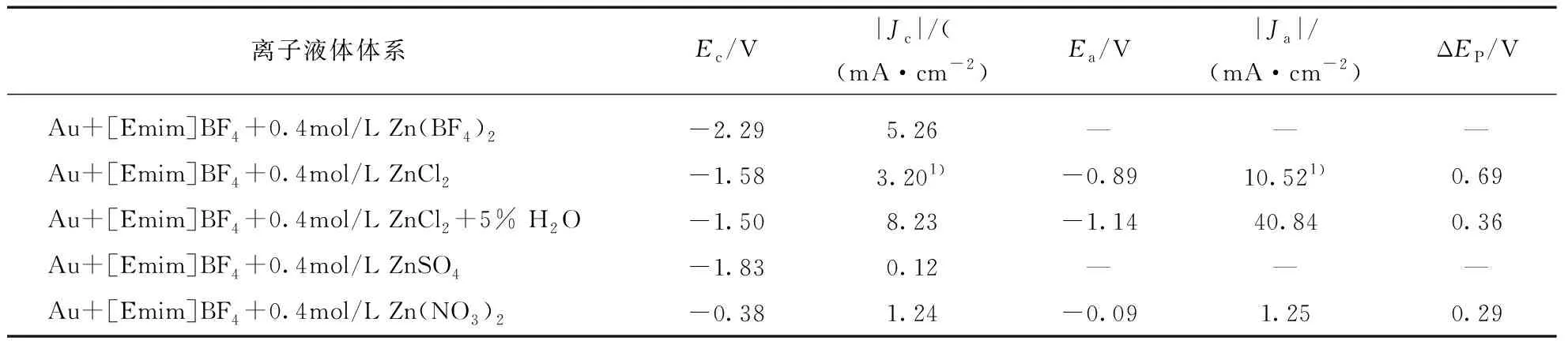
表1 [Emim]BF4离子液体体系中锌电沉积的电化学参数
注: 1)为图1中a2对应数值.
2.3 Au/[Emim]BF4+ZnCl2离子液体体系的电极界面结构研究
如图3(b),(c)所示,1174cm-1峰归属于咪唑环的面内C-H的变形振动β(CH)ring;1050cm-1出现的峰归属于阴离子B-F伸缩振动ν(B-F);3134,3180cm-1的吸收峰归属于咪唑环上的C-H的振动峰;2976,3000cm-1的吸收峰归属于咪唑环烷基侧链上的C-H伸缩振动峰,详细的归属列于表2(见第634页)中[12,18].

图3 Au/[Emim]BF4+0.4mol/L ZnCl2离子液体体系的现场表面增强红外光谱图Fig.3 SEIRAS spectra of [Emim]BF4+0.4mol/L ZnCl2参比光谱电位ER=0.6V


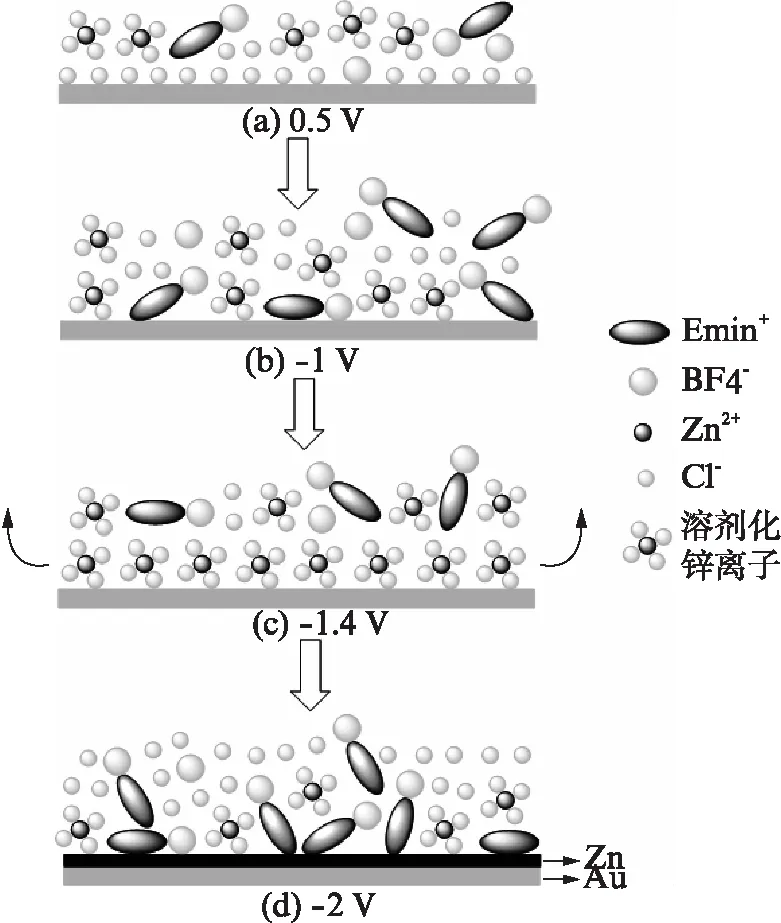
图4 [Emim]BF4+ZnCl2体系的界面结构Fig.4 Interfacial structure of Au/[Emim]BF4+ZnCl2(0.4mol/L)

表2 图3中红外光谱峰的归属
注: (1) IR [Emim]BF4, (2) SEIRAS [Emim]BF4+0.4mol/L ZnCl2, (3) SEIRAS[Emim]BF4+0.4mol/L ZnCl2+5% H2O;νs: 对称伸缩振动;νas: 不对称伸缩振动;δ: 弯曲振动;β: 面内变形振动.
2.4 [Emim]BF4/ZnCl2/H2O离子液体体系的电极界面结构研究
图5为[Emim]BF4+ 0.4mol/L ZnCl2+5% H2O体系的现场红外光谱结果,与[Emim]BF4的红外光谱相比,主要红外峰的位置都相对发生了偏离,这主要是由于离子和电极的相互作用导致.红外测试谱图中在 1626cm-1,3306cm-1,3736cm-1出现的峰可归属为水的吸收.对于水单体而言,3745cm-1的峰归属于ν(OH)的对称伸缩振动.当有氢键形成时,ν(OH)峰会变宽,并且发生红移.作为对比,图3(d)中无水体系的高波数区间并没有明显的峰出现.根据以上分析结果,图5(b)中3306cm-1的峰很宽,表明水分子之间形成了类似于ice-like结构的有序排列的氢键网[20],且同时吸附在Au电极表面;此外,1635cm-1的峰属于水分子的H-O-H的弯曲振动(δ(HOH)).

图5 不同电位下[Emim]BF4/ZnCl2/H2O离子液体的现场表面增强红外光谱Fig.5 In-situ SEIRAS spectra of the [Emim]BF4/ZnCl2/H2O at different potentials参比光谱电位ER=0.3V
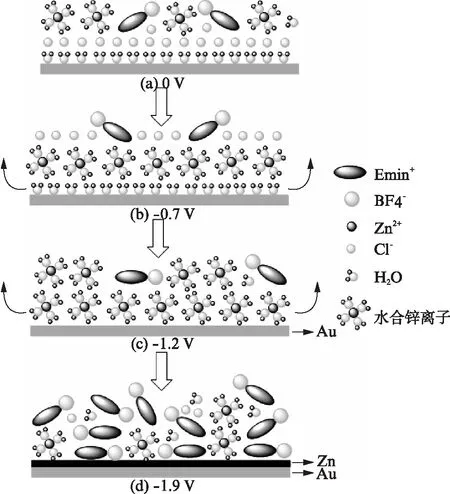
图6 [Emim]BF4/ZnCl2/H2O体系的界面结构Fig.6 Interfacial structure of [Emim]BF4/ZnCl2/H2O

本文首先通过对比不同种类锌盐溶解在离子液体体系中的电化学行为,发现ZnCl2作为锌盐时同时拥有较高的电化学效率以及良好的氧化还原可逆性.同时考察了加入少量水之后锌电极行为的变化,发现引入少量水可以使锌的沉积电流密度更大,可逆性更好.通过现场表面增强红外光谱测试可以观察到溶剂化锌离子以及水合锌离子在电极界面的变化情况,结合CV曲线对离子液体中锌电极的电化学行为的机理进行了模型探讨.

