黄土丘陵区退耕还草植被恢复阶段优势种铁杆蒿的化感效应
王 杰,张 超,刘国彬,王国梁,孙庆花
1 西北农林科技大学水土保持研究所,杨凌 712100 2 中国科学院水利部水土保持研究所,杨凌 712100 3 西北农林科技大学林学院,杨凌 712100
黄土丘陵区因地处干旱半干旱地区,土质疏松,且长期受人为活动的干扰,地表植被遭到破坏,导致生态环境恶化。因此,通过减少人类活动的干扰、采取保护措施使植被自然恢复,才能实现该区域生态系统重建[1- 2]。自1999年退耕还林,经过十多年努力,该区生态环境有了较大的改善。而植被的恢复需要理论的指导,近年来,对于该区域植被恢复的效应研究较多,如植被恢复对土壤理化性质、酶活性、土壤微生物、土壤养分等的影响[3- 7],而对于植被恢复过程中植物之间化感作用的研究相对较少。植物的化感作用指的是一种植物通过向环境分泌自身代谢过程中的代谢产物而对其他植物(包括微生物)所产生的直接或间接的影响[8],这种影响包括对植物生长的抑制或促进作用。化感作用对于农林业生产有重要影响。在农业生产、经营与管理中,轮作、连作障碍、作物和杂草的关系以及作物种植模式的选择等都需要考虑化感作用的影响[9- 10];林业生产中,森林的更新、混交林的培育等都受化感作用的影响[10-11]。因此,重视化感作用的研究,对农林业的生产、生态环境的改善具有重要意义。
铁杆蒿(Artemisiasacrorum)是黄土丘陵区退耕地植被恢复过程中草本阶段中后期的群落优势种,具有根系发达和抗旱能力较强的特点,是该地区良好的水土保持植物,一般在撂荒后8—10年开始出现,并随恢复年限增加而逐渐增多,在20—30年时成为群落优势种并稳定存在[12]。近年来,关于铁杆蒿植被群落的研究,主要集中在对土壤质量的影响、改善土壤侵蚀环境等生态学特性上[13-17],对铁杆蒿群落形成的内在原因以及与其他植物之间的关系研究较少,而这些问题是认识植被恢复过程及内在机理的关键。因此,本文通过室内模拟种子萌发试验,研究优势种铁杆蒿茎叶、根系及根际土的浸提液,对以铁杆蒿为优势种的种群中主要伴生种狗尾草(Setariaviridis)、达乌里胡枝子(Lespedezadavurica)、茵陈蒿(Artemisiacapillaries)和铁杆蒿自身种子萌发与幼苗生长的影响,揭示黄土丘陵区草本群落恢复中后期铁杆蒿群落形成的内在原因,以期从理论上阐明植被恢复过程中植被群落的形成与植物化感作用之间的联系,进而为该区域草地的经营管理与植被恢复策略提供依据。
1 研究方法
1.1 研究区概况
研究区位黄土高原水土保持综合试验站的纸坊沟流域(109°16′E,36°46′N),海拔1010—1431 m,年平均降雨量510 mm左右,且多集中在7—9月,蒸发量1000 mm左右,蒸发量是降雨量的2倍,是典型的干旱半干区。该区年平均气温为8.8℃,最低气温为-6.2℃,最高气温为37.2℃。该区域土壤为黄土高原典型土壤-黄绵土,抗蚀抗冲能力较差,容易产生水土流失。现阶段,该地区常见的植被主要有柠条(CaraganaKorshinskii)、沙棘(Hippophaerrhamnoides)等人工灌丛林,以沙打旺(Astragalusadsurgens)、柳枝稷(Panicumvirgatum)等为主的人工草地,以茵陈蒿、铁杆蒿、白羊草(Bothriochloaischaeumu)等为主的天然草地[18]。
1.2 材料和方法
1.2.1 试验材料
于2014年9月在退耕10年、15年、20年和30年后形成的天然草地上,选择坡度、海拔、坡向相似,土地利用历史一样的样地(表1),分别采集铁杆蒿茎叶分(除根系以外的植株部分)、根系和根际土,作为提取浸提液的材料。根际土采用Riley and Barber抖根法[19]采集。
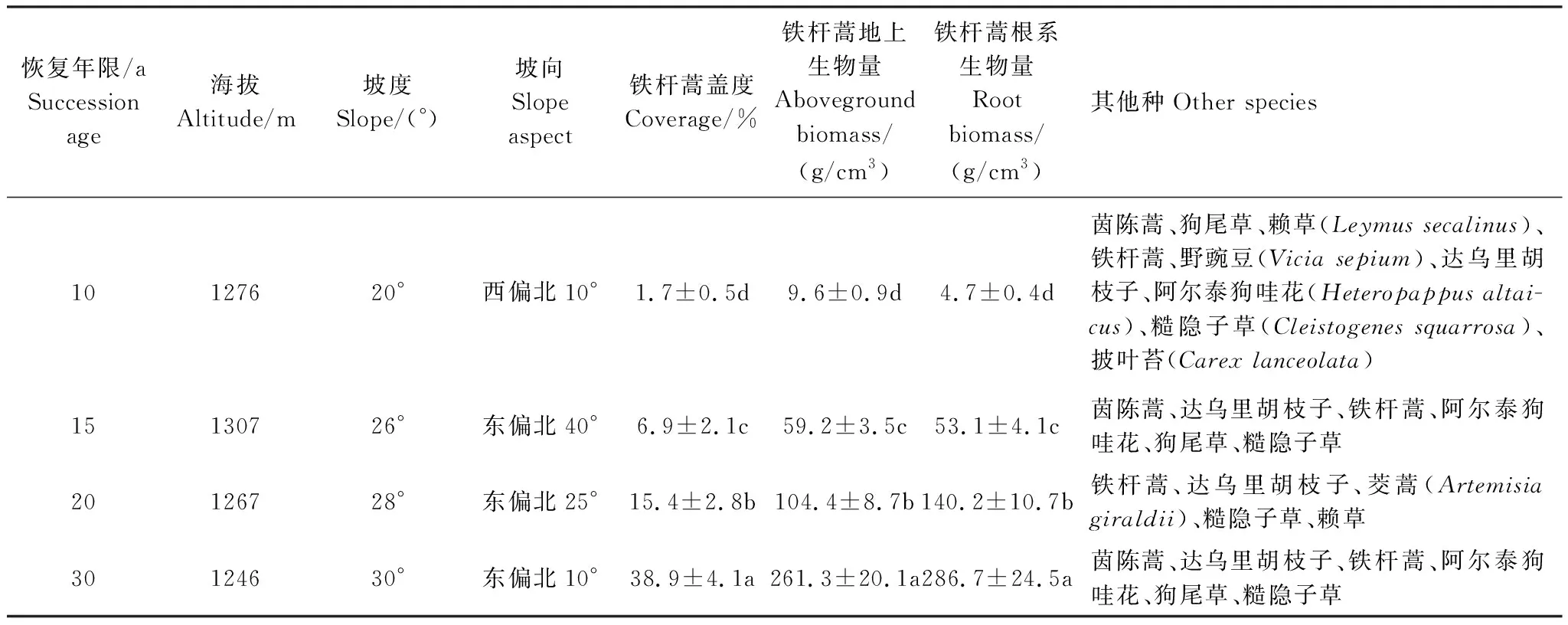
表1 不同恢复年限铁杆蒿群落样地概况
不同字母表示差异显著性(P<0.05)
1.2.2 浸提液的制备与种子萌发试验
(1)水浸提液的制备:浸提材料收集后,当天带回实验室,并洗干净、阴干粉碎,过0.25 mm筛,然后按1∶10的比例分别称取植物样和蒸馏水于三角瓶中,浸泡震荡30 min,震荡时保持20℃室温,随后在4000 r/min的离心机上离心5 min,再吸取上层清液0.1 g/mL作为浸提母液;最后将母液稀释5倍(0.02 g/mL)/10倍(0.01 g/mL)和50倍(0.002 g/mL)。分别往铺有单层滤纸直径为9 cm的培养皿中加入2 mL各稀释倍数的浸提液,其中,蒸馏水处理作为对照[18],共设计4个处理,每个处理重复5次。根际土水浸提液的制备步骤与根系和茎叶相同。
(2)甲醇浸提液的制备:在制备甲醇浸提液时,浸提所用溶液为甲醇,进行种子萌发实验时,另设等量甲醇作为对照组,其余同水浸提液方法。
(3)种子萌发实验:种子萌发实验步骤同张超等[2]的实验方法。
1.3 数据处理与统计分析
达到培养时间后,统计各种子发芽率、测量根长和芽长。
发芽率=(发芽种子数/总种子数)×100%

式中,T为实验处理值,C是对照值。将RI的绝对值作为化感作用强弱的衡量指标,绝对值的大小与作用强度一致。若RI>0,为促进作用;RI<0则为抑制作用。本文中RI=-1.00表示发芽率为0。
采用单因素方差分析( one-way ANOVA)不同浓度处理对受体植物种子萌发及幼苗生长的影响,处理组间的差异比较采用Duncan法,显著性水平为α= 0.05,以上分析在SPSS 20.0(SPSS Inc., Chicago, IL, USA)中完成。文中所有图用Origin Pro 9.0绘制。
2 结果与分析
2.1 铁杆蒿不同部位浸提液对伴生植物及自身种子萌发的影响
2.1.1 根系浸提液
4个恢复年限的铁杆蒿根系甲醇浸提液,在相同浓度下,均不同程度抑制狗尾草、茵陈蒿和自身的种子萌发(图1)。对于不同恢复年限的铁杆蒿根系甲醇浸提液,浓度为0.02、0.01 g/mL时,茵陈蒿受到的抑制作用随恢复年限的增加呈现先减弱后增强的趋势;当浓度为0.002 g/mL时,完全抑制茵陈蒿种子的萌发,对达乌里胡枝子的化感作用随恢复年限增加由完全抑制逐渐减弱,恢复30 a时变为轻微的促进作用。对于不同恢复年限的铁杆蒿根系水浸提,茵陈蒿、达乌里胡枝子和铁杆蒿种子萌发受到的抑制强度不同,而对狗尾草具有明显的促进作用。20 a铁杆蒿根系水浸提液,浓度为0.1、0.02 g/mL和0.01g/mL时,抑制达乌里胡枝子和自身的种子萌发,而0.002 g/mL时,具有较弱的促进作用。
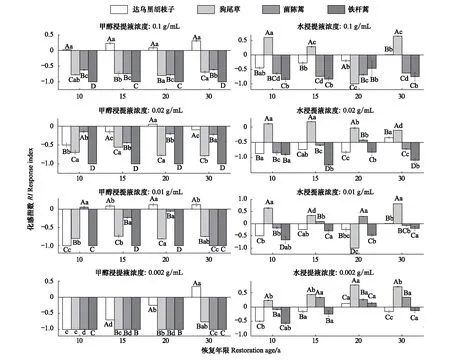
图1 铁杆蒿根系浸提液对受体植物种子萌发的影响Fig.1 Impact of root extraction from A. sacrorum on the seed germination of receptors不同大写字母表示同一恢复年限同一浓度不同受体植物具有显著差异(P<0.05);不同小写字母表示同一恢复年限同一受体植物在不同浓度下具有显著差异(P<0.05)
2.1.2 茎叶浸提液
铁杆蒿茎叶甲醇浸提液除对伴生种狗尾草具有较弱的促进作用外,均抑制其他两种伴生种及自身种子的萌发(图2);恢复15 a、20 a和30 a时,对茵陈蒿抑制作用均随着浓度的减小呈先减小后增加的趋势。与甲醇浸提液不同,水浸提液对狗尾草的种子萌发具有明显的促进作用,尤其在低浓度时,促进作用更加明显;在浓度为0.1 g/mL水浸提液的作用下,茵陈蒿和其自身种子都不能萌发,但随着浓度的减小,种子萌发受到的抑制作用逐渐减弱。
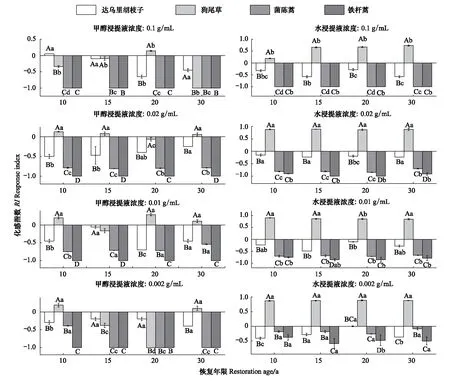
图2 铁杆蒿茎叶浸提液对受体植物种子萌发的影响Fig.2 Impact of stems and leaves extraction from A. sacrorum on the seed germination of receptors
2.1.3 根际土浸提液
当恢复年限为20 a时,各浓度铁杆蒿根际土甲醇浸提液对自身及伴生种的种子萌发的化感作用最弱,其他恢复年限对伴生种的种子萌发或抑制或轻微促进,但随恢复年限增加,变化趋势不明显(图3)。与铁杆蒿根系以及茎叶的水浸提液不同,各恢复年限的铁杆蒿根际土水浸提液,对4种受体植物种子萌发具有明显的促进作用,且在同一浓度条件下,狗尾草的种子萌芽率显著(P<0.05)高于其他3种植物的种子萌芽率。
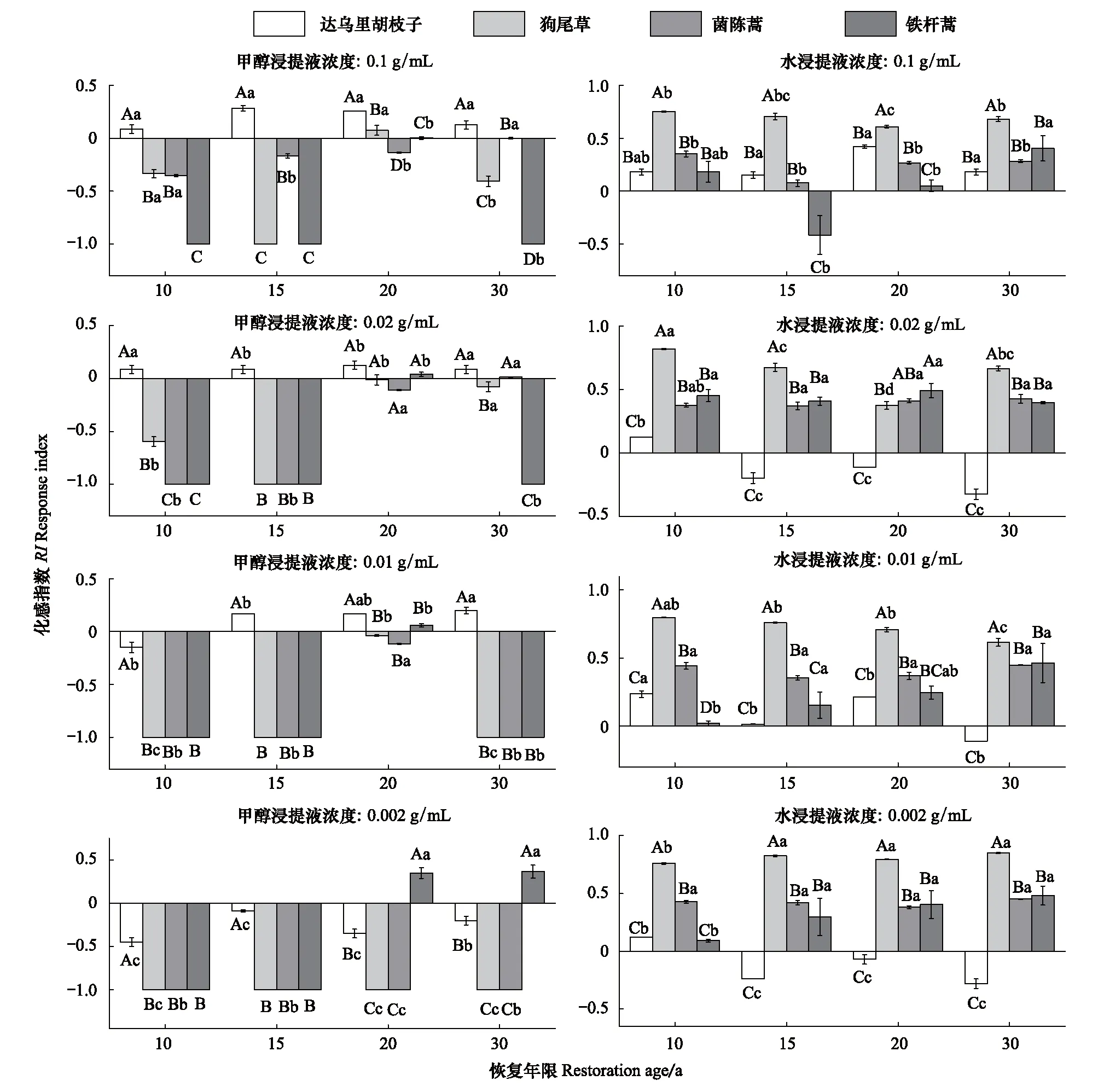
图3 铁杆蒿根际土浸提液对受体植物种子萌发的影响Fig.3 Impact of rhizospheric soil extracttion from A. sacrorum on the seed germination of receptors
2.2 铁杆蒿不同部位浸提液对伴生植物及自身幼根生长的影响
2.2.1 根系浸提液
如图4所示,3种伴生植物幼根的生长对铁杆蒿根系甲醇浸提液浓度变化的敏感性相似:随着浓度的降低,受到的抑制作用先减弱后增强;同一浓度下,受体植物幼根的生长受到的抑制作用随恢复年限的增加变化不明显。与甲醇浸提液不同,根系水浸提液对伴生种及自身幼根生长或抑制或促进,无明显规律。
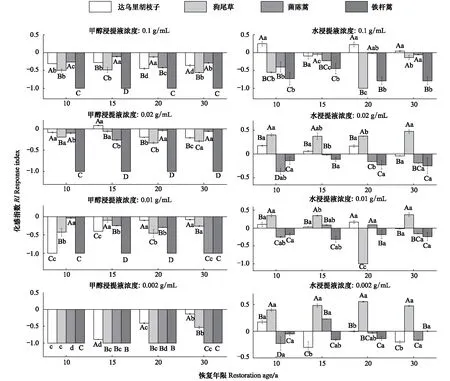
图4 铁杆蒿根系浸提液对受体植物幼根生长的影响Fig.4 Impact of roots extraction from A. sacrorum on the root growth of receptors
2.2.2 茎叶浸提液
在铁杆蒿茎叶甲醇浸提液作用下(图5),浓度为0.1、0.02 g/mL时,达乌里胡枝子、狗尾草、茵陈蒿和自身幼根的生长均受到不同程度的抑制,且0.1 g/mL的抑制作用强于0.02 g/mL。与甲醇浸提液一样,浓度为0.1 g/mL的水浸提液均抑制4种受体植物幼根的生长;浓度为0.02—0.002 g/mL时,水浸提液对狗尾草幼根的生长具有显著(P<0.05)的促进作用,抑制其他伴生种幼根的生长。
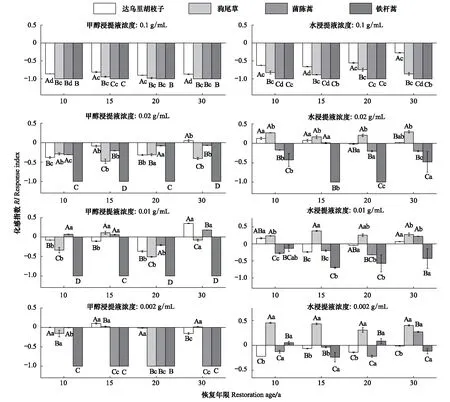
图5 铁杆蒿茎叶浸提液对受体植物幼根生长的影响Fig.5 Impact of stems and leaves extraction from A. sacrorum on the root growth of receptors
2.2.3 根际土浸提液
铁杆蒿根际土甲醇浸提液对受体植物幼根的生长具有显著(P<0.05)的抑制作用(图6);同种子萌发一样,植被恢复20 a时受体植物幼根生长受到的抑制作用最小。4个恢复年限的根际土水浸提液对狗尾草幼根生长具有显著的促进作用,而伴生种达乌里胡枝子及茵陈蒿根的生长受到的抑制程度显著(P<0.05)不同,或抑制或促进。
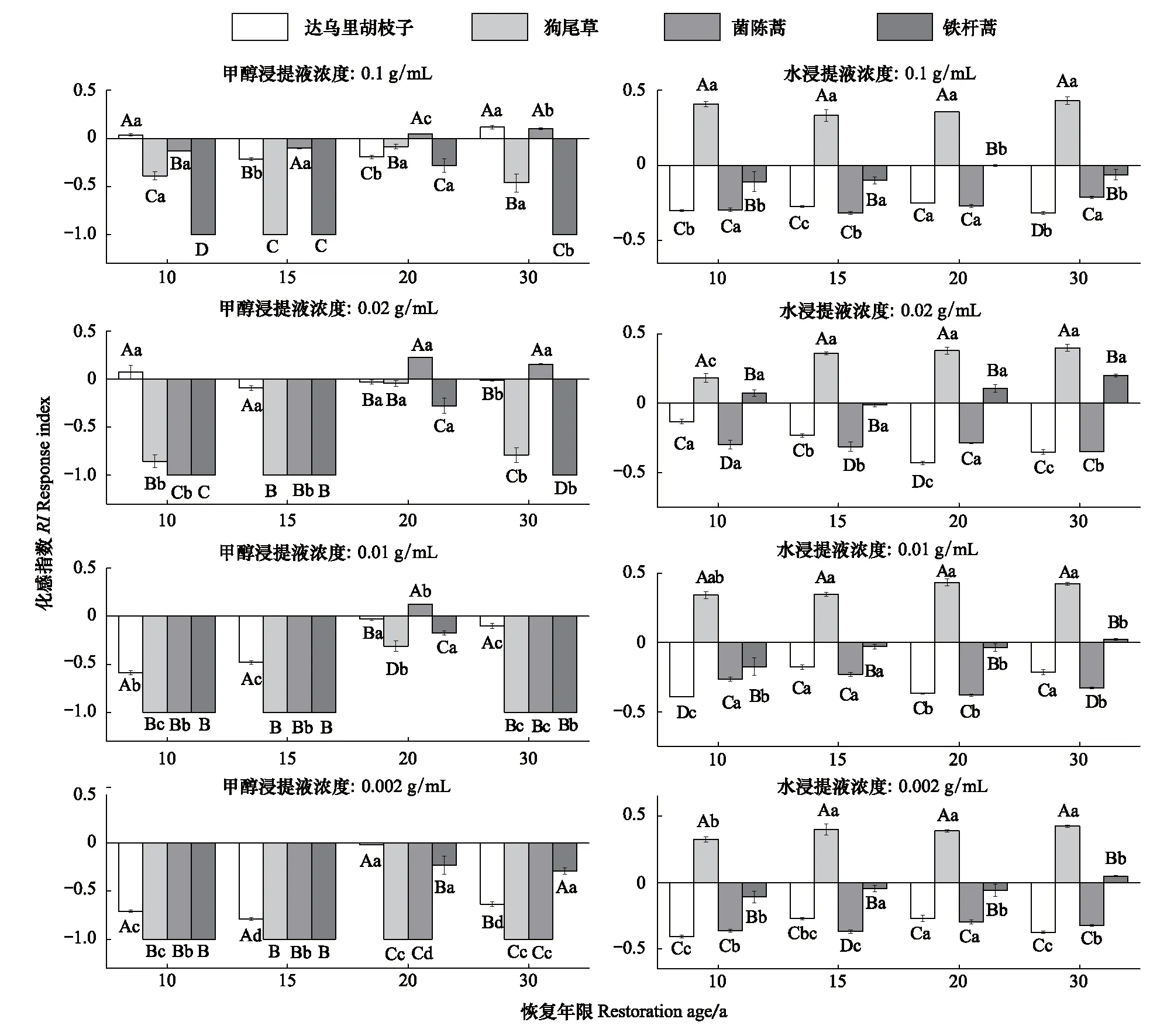
图6 铁杆蒿根际土浸提液对受体植物幼根生长的影响Fig.6 Impact of rhizospheric soil extraction from A. sacrorum on the root growth of receptors
2.3 铁杆蒿不同部位浸提液对伴生植物及自身幼芽生长的影响
2.3.1 根系浸提液
浓度为0.1 g/mL的铁杆蒿根系甲醇浸提液,对其伴生种幼芽的生长化感作用随恢复年限增加或促进或抑制(图7)。浓度为0.02 g/mL时,先促进伴生种幼芽生长,后随恢复年限增加变为抑制。当浓度为0.01、0.002 g/mL时,抑制作用更为明显。铁杆蒿根系水浸提液对受体植物幼芽生长的化感作用强弱显著(P<0.05)不同。铁杆蒿根系水浸提液总体上对狗尾草幼芽的生长是促进的,且较显著(P<0.05)。对其余两种伴生种的幼芽生长或抑制或促进。
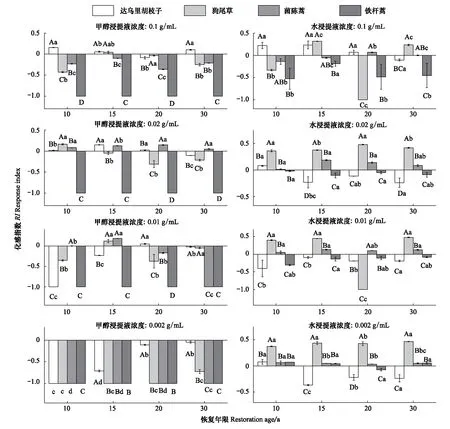
图7 铁杆蒿根系浸提液对受体植物幼芽生长的影响Fig.7 Impact of root extraction from A. sacrorum on the shoot growth of receptors
2.3.2 茎叶浸提液
铁杆蒿茎叶甲醇浸提液,对茵陈蒿、铁杆蒿和狗尾草幼芽的生长有显著(P<0.05)抑制作用,且浓度为0.1 g/mL时抑制作用最强(图8),而达乌里胡枝子有轻微的促进作用;浓度为0.1 g/mL时,茵陈蒿受到的抑制作用随恢复年限的增加逐渐增强。与甲醇浸提液一样,高浓度(0.1 g/mL)的水浸提液均抑制4种受体植物幼芽的生长,且狗尾草受到的抑制作用随恢复年限的增加逐渐增强;但浓度为0.02—0.002 g/mL时,水浸提液显著促进狗尾草幼芽的生长。

图8 铁杆蒿茎叶浸提液对受体植物幼芽生长的影响Fig.8 Impact of stems and leaves extraction from A. sacrorum on the shoot growth of receptors
2.3.3 根际土浸提液
恢复10 a的铁杆蒿根际土甲醇浸提液对伴生种及其自身幼芽生长的抑制作用最弱(图9)。浓度为0.01、0.002 g/mL时,对受体植物幼芽生长的抑制作用最强。狗尾草和达乌里胡枝子对根际土水浸提液较敏感:水浸提液显著(P<0.05)促进狗尾草芽的生长,而不同程度的抑制伴生种达乌里胡枝子芽的生长。根际土水浸提液也抑制茵陈蒿和铁杆蒿幼芽的生长,但总体上并无显著(P<0.05)差异。

图9 铁杆蒿根际土浸提液对受体植物幼芽生长的影响Fig.9 Impact of rhizospheric soil extraction from A. sacrorum on the shoot growth of receptors
3 讨论
3.1 铁杆蒿不同部位对伴生种的化感作用及其化感作用随恢复年限的变化规律
植物群落的演替是指一定区域内一个群落被另一个群落替代,朝着某个方向不断变化,最后发展成为最适应当地环境条件的动态变化过程[8,20]。植被群落的演替受人为干扰、气候、种间竞争等诸多因素影响,总体上可分为内因和外因两个方面[8],近年来,关于导致植被群落发生演替的内在原因研究较多,普遍认为植物的化感作用是一个重要的驱动因素[2,8,21-24],表现为种间的生存竞争。竞争能力强的植物占据更多的生态位,从而逐渐发展成为优势种。由于群落内各种群间生存竞争的存在,再加上外界环境中各种生态因子的综合作用,使群落的优势种发生演替[25],从而推动了植物群落的生态恢复。因此植被群落的演替被认为是重要的恢复方式之一[22]。
本研究发现黄土丘陵区退耕还草植被恢复阶段,优势种铁杆蒿不同器官的浸提液对伴生种的化感作用不尽相同,茎叶及根系浸提液对伴生植物达乌里胡枝子、茵陈蒿以及自身种子的萌发和幼苗生长的抑制作用差异显著,且在同一浓度下抑制作用有呈现随恢复年限的增加逐渐增强的趋势。铁杆蒿根际土浸提液对各伴生植物种子萌发具有促进作用,但对伴生种茵陈蒿及达乌里胡枝子幼根及幼苗的生长却是抑制的。植物种子是野外无人工干扰条件下植物更新的主要方式,植物种子少或萌芽率低,将影响着该植物在群落中的多样性[17],进而导致其在群落竞争中处于劣势地位,最后的结果必然导致该群落在整个恢复过程中逐渐衰落[21]。总体上来看,铁杆蒿茎叶对伴生种的抑制作用要强于其根系及根际土。这可能是茎叶是植物进行光合作用以及呼吸作用的重要器官,光合作用合成的各类有机种物质首先存储于茎叶[26],因此茎叶的化感物质含量较高,从而能浸提出较多的化感物质,表现出的化感作用也更强。自然状态下,植物的化感物质主要是通过雨雾淋溶、根系分泌和残株或凋落物的分解而进入土壤发挥化感作用[27],进入土壤后一部分被空气氧化,再加上土壤中微生物的分解作用,从而导致能发挥化感效应的物质较少,因此化感作用相对较弱[28],但随着恢复的进行,化感物质不断积累,从而导致化感作用更强烈。研究还发现,铁杆蒿水浸提液对于狗尾草种子萌发与幼苗的生长具显著(P<0.05)的促进作用,但对自身是抑制的,这也说明铁杆蒿的化感作用可能会对自身的生长不利,随着植被恢复时间的延长,铁杆蒿的化感作用可能会导致自身在群落中的地位以及竞争能力降低,从而被其他物种所代替。
3.2 铁杆蒿不同部位浸提液对其自身种子萌发与幼苗生长的化感效应
铁杆蒿自身种子萌发和幼苗的生长也受到其不同部位浸提液的抑制作用,表现一定的自毒作用(在高浓度(0.1 g/mL)时最明显),这种自毒作用也验证了群落生态学中的“自疏”法则[2,8]。铁杆蒿对自身种子的萌发的抑制作用在水浸提液的情况下弱于甲醇浸提液,当铁杆蒿种子发芽以后,水浸提液能够促进其幼苗的生长(根际土浸提液表现最为明显),有利于提高自身在整个种群中的竞争力。
3.3 不同浓度及不同提取溶液的化感作用
张玉娟[23]在研究草原星毛委陵菜(Potentillaacaulis)的化感作用时发现,随着浓度的增强,星毛委陵菜叶、根和根系土壤浸提液对羊草(Leymuschinensis)幼苗的生长发育的抑制作用逐渐增强。孙庆花等[22]、王辉等[17]也发现了类似的结果。本研究发现,铁杆蒿不同浓度浸提液对伴生植物和铁杆蒿自身的化感作用有差异,茎叶、根系及根际土浸提液的化感作用,0.1 g/mL时的浸提液对伴生植物种子萌发的抑制作用较强,而低浓度0.002 g/mL时抑制作用较弱,甚至有轻微的促进作用,表现出典型的“浓度效应”,主要体现在铁杆蒿浸提液对伴生植物种子萌发率的影响。根与芽具有类似的现象,但根受到的抑制作用要强于芽,这可能是因为根首先能够从环境中吸收化感物质或者自毒化合物[29]。根是植物吸收营养的主要器官,当根的生长受到抑制的时,就会影响植物的养分、水分等植物生长所必须的因子的吸收,进而植物的生长和发育就会受到限制,最终结果势必会造成植物在群落的竞争中处于劣势地位[2]。优势种铁杆蒿不同提取溶液(水和甲醇)的浸提液对伴生种及自身的化感效应显著不同。相比于水浸提液,甲醇浸提液对受体植物种子萌发与幼苗生长的抑制作用更为显著,研究结果与贾俊英等[30]、孙庆花等[22]、王辉等[17]的研究结果一致。这说明在相同条件下甲醇能更好地浸提提出化感物质中有效成分,而且这化感物质都能够抑制植物的生长[2,17,22],从而表现出甲醇浸提液抑制受体植物要强于水浸提液。
随着恢复时间的推移,初期的优势种群落的盖度逐渐降低,其植株分泌的化感物质也逐渐减少,铁杆蒿受到的抑制作用逐渐减弱,因此铁杆蒿逐渐成为茵陈蒿的伴生种,且与恢复初期茵陈蒿相比,铁杆蒿是多年生植物[18,22,31],结实种子数量很大、种子繁殖力很强、根蘖也很发达[32],还有较强的根系分泌能力,更能适应该区域土壤环境[33],因此铁杆蒿更具环境竞争力。经过多年的生长,铁杆蒿逐渐适应了该区域环境条件强,植被盖度、生物量逐渐增加(表1)并且占据了较大的生存空间,成为黄土丘陵地区稳定的植被,其植株分泌的化感物质在环境中不断地积累,浓度逐渐增加,抑制其伴生植物的生长,因此,铁杆蒿植物的化感效应就可能促使其成为该恢复阶段的优势种。
4 结论
在黄土丘陵区退耕还草植被恢复阶段,优势种铁杆蒿的不同部位浸提液对其伴生种以及自身种子萌发、幼苗生长的化感作用差异显著:
(1)铁杆蒿茎叶、根系及根际土浸提液对伴生植物种子的萌发、幼苗生长的抑制作用总体表现为同一浓度下抑制作用随恢复年限增加而逐渐增强。
(2)铁杆蒿植物不同浓度的浸提液对伴生种和自身种子萌发幼苗生长化感作用不同,表现为低促高抑的“浓度效应”。相比于水浸提液,甲醇浸提液的化感效应更为显著。
(3)综上所述,铁杆蒿种群对其伴生植物的化感作用,可能是导致铁杆蒿在退耕还草植被恢复中后期成为群落优势种的原因之一。

