藜麦组织培养快速繁殖体系建立研究
, , , , , ,
(贵州省农业科学院旱粮研究所, 贵阳 550006)
藜麦(ChenpodiumquinoaWild.)别称藜谷、南藜麦等,是原产于南美洲的1年生藜科双子叶作物,在玻利维亚、秘鲁、智利等地广泛栽培,被印加人称为“粮食之母”[1-2]。藜麦中蛋白质含量较高,可作为主要的蛋白质来源,在稳定的食物供应和营养补充品中起着至关重要的作用。因为藜麦对多种非生物胁迫具有抗性,所以种子具有特殊的营养品质[3-4],对干旱和低温具有较强的抗性,与其它谷物相比,藜麦籽粒缺乏面筋,蛋白质、脂类和碳水化合物的平衡比例较高,富含人体所需的必需氨基酸、矿质营养、多酚、黄酮等生物活性物[4-6],营养潜力巨大。因此,美国航空航天局(NASA)将藜麦列为“登月候选作物”、宇航员理想的“太空粮食”,联合国粮食及农业组织(FAO)列出藜麦作为确保全球粮食安全的重要作物,宣布2013作为国际藜麦年[7-8]。目前,藜麦作为一种“超级食品”的市场需求已扩展到日本、北美洲和欧洲,成为全球炙手可热的商品。藜麦及其衍生品已成为美国天然养生食品商店中主打减肥、养生及保健的高端产品,风靡美国,开发利用前景较高[8]。
南美洲作为藜麦的主产地,占全球藜麦总产的95%左右[9],近年来,我国甘肃、山西、河北、吉林等地,通过田间栽培试验,选育了一批优质稳定且适合当地生态区域的新材料[10-11]。但是,我国对于藜麦基础研究主要集中在藜麦的化学组成、抗逆特性、栽培方法等方面,处于刚刚起步阶段[13]。俞涵译等[14]以9个藜麦品种为材料,对藜麦茎段愈伤组织进行诱导以及增殖体系进行优化,筛选出最适的诱导培养基类型。其他有关藜麦组织培养研究报道罕见,因此,开展藜麦的组织培养研究十分必要。本试验以台湾藜麦的茎段作为外植体,在提高种子发芽率的基础上,对影响藜麦茎段愈伤组织分化和不定芽增殖的关键因素进行研究,进一步为藜麦的遗传转化和分子遗传研究提供技术支持。
1 材料与方法
1.1 试验材料
供试材料为台湾红黎,由贵州省农业科学院旱粮研究所提供。自配MS、1/2 MS,不同浓度的6-BA、NAA、2-IP试剂。
1.2 藜麦组培苗的选育
选取籽粒饱满的藜麦种子,28 ℃条件下水浴2 h后冷却至室温;在超净工作台上,用75%的乙醇溶液消毒30 s,无菌水冲洗1次,转入20%次氯酸钠溶液中消毒20 min,无菌水冲洗4次,晾干后接种到未处理的MS培养基上,37 ℃暗培养2 d,随后转入16 h/8 h(光照/黑暗)条件下培养7 d,获得无菌苗备用。
1.3 藜麦愈伤组织的诱导培养
在超净工作台上,将1.2中培养获得的无菌苗从培养皿中取出,茎段剪成1.0 cm左右小段后平放、子叶侧插,置于不同处理条件的培养基中(表1)培养,每个处理接种40个茎段,3次重复。接种1周后统计藜麦茎段愈伤组织的诱导率及愈伤组织生长状况。
诱导率(%)=(产生愈伤组织的个数/接种的个数)×100%。
表1 藜麦愈伤组织诱导培养基配方设计
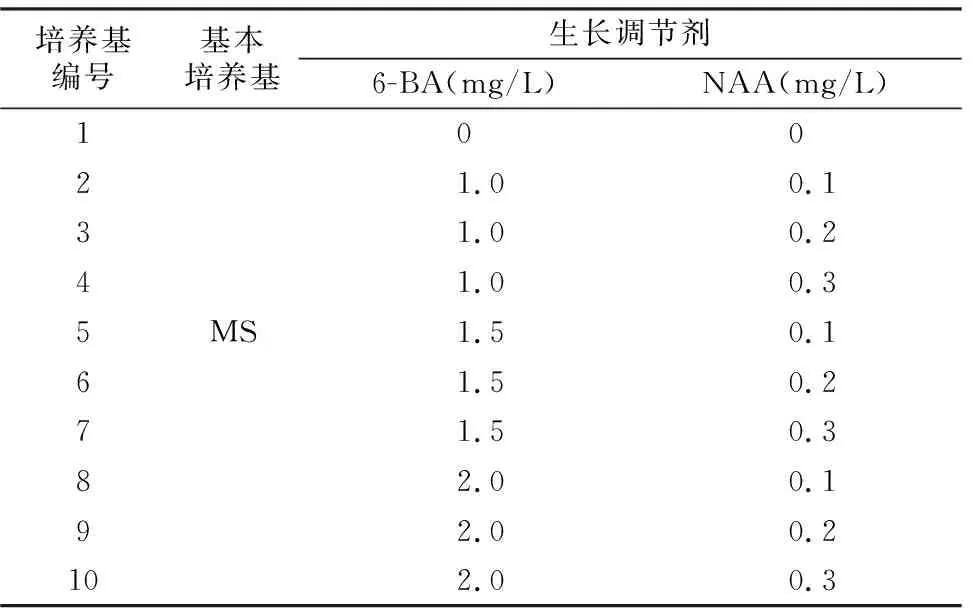
培养基编号基本培养基生长调节剂6-BA(mg/L)NAA(mg/L)10021.00.131.00.241.00.35MS1.50.161.50.271.50.382.00.192.00.2102.00.3
1.4 藜麦愈伤组织的诱导分化培养
挑选生长良好均匀的藜麦茎段愈伤组织,转接到表2的激素培养基中,每个处理转接10块茎段愈伤组织,3次重复,培养35 d后统计不定芽的分化率与不定芽生长情况,筛选出最佳培养基。
分化率(%)=(分化不定芽愈伤组织块数/转移的愈伤组织块数)×100%。
1.5 生根培养
待藜麦不定芽长至3~5 cm 后在超净工作台上将其切下,将其转移到1/2 MS培养基上进行生根培养。
1.6 移 栽
生根培养结束后,挑选单苗长出正常的洁白色短根、苗高7 cm左右的的藜麦组培生根苗,移栽至温室大棚,进行炼苗;将营养土、草炭土按不同比例充分混匀并消毒,随后将藜麦生根苗移栽至上述基质中。移栽定植后的小苗,时刻监测记录周围环境中温度、湿度、光照,及时喷水、调温、防病虫害,创造适宜藜麦幼苗生存的外界环境,提高藜麦再生苗的成活率。
2 结果与分析
2.1 藜麦外植体的获得
将消毒灭菌后的藜麦茎段及子叶分别接种到愈伤组织诱导培养基上进行培养,3 d时茎段切口处变淡黄色且明显的愈伤组织产生,继续培养14 d,茎段愈伤组织质地均匀且体积增大,形成蓬松的球状(见图1-A、C),30 d后统计茎段及子叶愈伤组织的生长状况,停止生长或者未被诱导的则不再形成愈伤组织。由图1-A、1-B看出,藜麦的茎段、子叶经诱导都能形成愈伤组织,但是茎段的诱导成功率可达75%,因此后续试验选择藜麦茎段作为外植体。
表2 藜麦继代增殖培养基配方设计

培养基编号基本培养基生长调节剂6-BA(mg/L)NAA(mg/L)2-IP(mg/L)11.00.41.021.00.61.031.00.81.041.50.41.55MS1.50.61.561.50.81.572.00.42.082.00.62.092.00.82.0
2.2 藜麦愈伤组织的继代增殖
选取生长均匀且良好的藜麦茎段愈伤组织,培养后观察其生长状况。由表3可知,6-BA是诱导愈伤组织必不可少的,其与NAA配合使用对茎段的愈伤组织诱导效果不同,6-BA 为1.5 mg/L、NAA为0.2 mg/L时茎段愈伤组织诱导率最高,处于高度分裂状态,体积增大,结构致密,适合藜麦不定芽的诱导(见图1-C)。根据愈伤组织的诱导情况和诱导率,选择MS+6-BA 1.5 mg/L+NAA 0.2 mg/L为最适的继代培养基。
表3 不同激素组合下藜麦的出愈率

培养基编号转外植体个数愈伤数(%)愈伤诱导率(%)11200021209579.1731208974.1741208873.3351209377.50612010184.3371209982.5081208671.6791208772.50101209680.00
2.3 藜麦不定芽的诱导
将继代培养后的藜麦愈伤组织接种到分化培养基上进行不定芽诱导培养,愈伤组织在接种7 d后,开始呈现绿点,继续分化培养20~25 d可清楚观察到部分愈伤组织上明显生长出不定芽(见图1-D),并且形成不定芽的愈伤组织明显增多,且不定芽长势良好。 统计分化率(见表4)发现,在6-BA 2.0 mg/L、NAA 0.6 mg/L和2-IP 2.0 mg/L条件下茎段愈伤组织形成不定芽的分化率最大,图1-D中可以看到,愈伤组织质地坚硬,淡黄色,发生褐化死亡的较少,容易分化成不定芽。通过分析藜麦愈伤组织分化形成不定芽的情况发现,不定芽的分化率不单与培养基中添加的各激素浓度有关,还与诱导愈伤组织的生长状况相关。
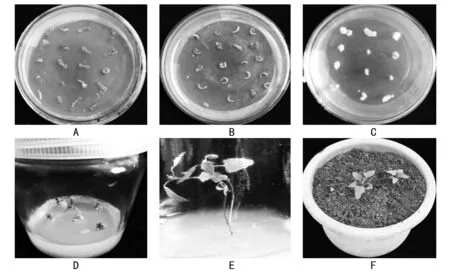
注:A为茎段诱导培养;B为子叶诱导培养;C为愈伤组织诱导优化培养;D为愈伤组织分化培养;E为生根苗;F为移栽成活的组培苗。图1 藜麦种子组织培养
2.4 藜麦幼苗生根及移栽
将分化出的不定芽转移到生根培养基中,30 d后藜麦组培苗生根形成完整的藜麦再生植株(见图1-E),可移栽至温室大棚或室外。依据移栽季节及当地的气候特点进行栽培管理,使组培苗逐渐适应培养瓶外的环境。
取出藜麦组培苗,在大棚内闭瓶炼苗10~15 d,逐步开盖,适应外界环境,幼苗嫩叶逐渐形成蜡质层、生成表皮毛,气孔功能完善,逐步适应环境1周后移栽至大棚。
藜麦幼苗移栽选择低温气候或阴天。小心取出组培苗,洗净根部,对根系进行消毒后用清水冲洗,移栽至营养土、草炭土一定比例混合的基质中。对移栽后的组培苗随时监测,保持周围空气的湿度。1周后藜麦幼苗叶片逐渐由浅绿色变为深绿色(见图1-F),主茎健壮具韧性,21 d后统计藜麦幼苗成活率达 95%左右。
表4 不同激素组合下藜麦不定芽的分化率

培养基编号接种数(块)分化不定芽的愈伤块数(块)不定芽分化率(%)1301756.672301963.343302170.004302273.345302376.676302376.677302480.008302686.679302273.34
3 讨 论
植物组织培养常选择叶片、茎等作为外植体, 对于藜麦而言,子叶和茎段均可作为外植体成功的诱导出愈伤组织并形成再生植株,但茎段的诱导率明显优于其他组织[14]。藜麦组培时,实验室培养、取材、接种操作便捷,不受外界环境条件的影响,同时,藜麦茎段的诱导率较高,脱分化形成再生植株所需时间较短,考虑到实验结果的准确性和普遍性,本研究选用了藜麦的茎段作为外植体来诱导形成再生植株。同时,藜麦籽粒较小,在普通的MS培养基上即可以萌发生根成长,不需要添加激素,萌发率可达75%[15]。本次研究还发——藜麦种子的萌发率和储存时间成反比。所以,通过组织培养促进藜麦种子萌发,而分化增殖使植株脱分化形成新的植株,缩短实验进程,提高效益。
在组织培养过程中,适量的植物生长调节物质可以促进愈伤组织分化、生长和形成再生植株[16]。不同植物生长调节物诱导能力不同,不同激素浓度及组合等对植物愈伤组织的诱导及再生苗的形成产生相互影响[17]。本实验以台湾红藜的茎段为外植体,选用6-BA、NAA和2-IP 3种激素配制不同激素组合对其不同阶段的愈伤组织进行诱导,发现6-BA 1.5 mg/L+NAA 0.2 mg/L产生的愈伤组织质地致密,诱导率较高;当激素浓度配比为6-BA 2.0 mg/L+NAA 0.6 mg/L+2-IP 2.0 mg/L时,能够促进茎段愈伤组织分化形成不定芽,且分化率最高,藜麦不定芽形成的数量多,长势良好。由此看出,选择合适的激素类型及浓度对藜麦愈伤组织的诱导和分化起关键性作用,不同浓度的6-BA和NAA激素组合决定藜麦愈伤组织的形成和分化状态[18],在合适的组合协同下,成功获得藜麦愈伤组织并分化形成再生苗。因此,在藜麦组织培养的不同阶段,选择适当的诱导培养基及激素浓度,是藜麦组织培养成功的关键因素。
藜麦愈伤组织培养研究取得进展的同时也存在一些问题,如试验主要重视组培环节中最适培养基的筛选,而忽视对组培过程中周围环境对试验结果的影响。目前,藜麦组培育苗通常选择茎段、不定芽等作为外植体,进行诱导形成再生苗,由于试验过程中污染率高、整齐度低、成苗稳定性差等问题,在后续的研究中如何提高藜麦种苗的质量、获得优质的无性种苗等,将是未来藜麦研究亟待解决的问题。同时,不同地域环境和气候条件对藜麦的栽培产生很大的影响,因此,培育抗病抗逆性且适合贵州地域的优良品种对拓展藜麦种植区域,培育贵州优良藜麦新品种具有重大意义。

