不同消毒剂对毛红椿种子的消毒效果及成苗的影响
, ,, , , ,
(1.江西农业大学生物科学与工程学院, 南昌 330045;2.江西农业大学,江西特色林木资源培育与利用2011协同创新中心, 南昌 330045)
毛红椿(Toonaciliatesvar.pubescens)别名毛红楝,属于楝科香椿属,为国家二级保护濒危物种,其木材具有“桃花新木”之美誉[1]。目前,由于开发过度、自然环境的变化以及天然更新缓慢等原因,导致毛红椿分布区域总面积大幅度减少[2]。在天然林实地调查中发现,毛红椿在很短的时间内会比较集中落下大量饱满种子,土壤种子库充足。但实际上,毛红椿萌发的实生幼苗很少,且幼苗比较纤弱、抵抗力差。毛红椿种子质量较小,易霉变,不耐贮藏,常温下种子活力不足1年,且萌发幼苗容易染病死亡,病害是导致毛红椿土壤种子库活力丧失的主要原因[3-4]。种子带菌为病害的初侵染源,这是病害综合治理中必须解决的问题,但我国毛红椿种子带菌问题研究尚未见报道。在探究种子致病微生物的危害时,需要先对种子进行消毒处理。目前对毛红椿种子灭菌主要采用高锰酸钾溶液浸泡[5]或0.3%多菌灵拌种[6],消毒效果不明显,并且缺少消毒剂对毛红椿种苗生长影响的研究。消毒剂在一定剂量范围内对植物体有一定的生长抑制或毒性,必须对其安全性进行评价。因此,借鉴其他植物种子的消毒方法,选择高锰酸钾、多菌灵、次氯酸钠[7]、硫酸铜[8]、酒精[9]等5种消毒剂对毛红椿种子进行消毒处理,研究不同消毒处理对毛红椿种子萌发和幼苗生长的影响,寻求最佳的种子消毒处理方案,以获得生长良好的无菌苗,为后续的研究及人工林培育提供参考。
1 材料与方法
1.1 材 料
1.1.1 种 子
2015年11月采集毛红椿蒴果,采集地点位于江西省龙南县九连山国家级自然保护区虾公塘保护站(海拔760 m,114°27′E,24°36′N),母树胸径为62.4 cm,将蒴果置于室内使其自然开裂,去除果壳,收集种子,于-18 ℃低温保藏备用,种子千粒质量为 9.164 g。
1.1.2 消毒剂
0.3%、0.5%、1.2%高锰酸钾溶液,3%次氯酸钠溶液,1.5%硫酸铜溶液,75%乙醇溶液,0.13%多菌灵溶液(80%多菌灵水分散粉剂用无菌水配成600倍稀释液)。
1.2 方 法
1.2.1 种子消毒处理
用不同消毒剂对毛红椿种子进行不同时间的消毒,以清水浸种24 h为对照组(ck),共计16个处理,每个处理5次重复,每个重复20粒种子。选取颗粒饱满、健康的毛红椿种子先用清水浸种24 h,再分别用0.3%高锰酸钾溶液(10,30 min)、0.5%高锰酸钾溶液(120 min)、1.2%高锰酸钾溶液(10 min)、0.3%次氯酸钠溶液(10,20,30 min)、1.5%硫酸铜溶液(20,30,40 min)、75%乙醇溶液(20,30,40 s)、0.13%多菌灵溶液(12,24 h)浸泡种子进行消毒,消毒处理后的种子最后用无菌水冲洗4~5次。
表2 KMnO4溶液对毛红椿种子发芽和幼苗生长的影响

浓度(%)时间(min)发芽指数(%)发芽势(%)发芽率(%)根长(cm)茎长(cm)干重(mg)0(ck)0(ck)54.13±4.12a38.33±7.64a78.33±7.64b3.83±0.72a4.79±1.21a4.10±0.90a0.31058.72±8.16a41.67±12.58a90.00±5.00ab3.66±1.32a4.95±0.77a4.90±0.62a0.33056.61±2.92a38.33±5.77a93.33±2.88a3.34±1.15a4.53±0.76a4.40±0.00a0.512052.17±12.35a40.00±5.00a88.33±5.77ab3.25±1.12a5.38±0.75a5.00±0.52a1.21058.75±1.29a45.00±5.00a83.33±2.89ab3.73±0.51a4.52±1.03a4.17±0.29a
发芽盒中垫2 cm厚棉花,上铺2张滤纸,注入蒸馏水充分湿润,发芽盒121 ℃灭菌30 min。消毒处理后的种子在无菌操作条件下放入发芽盒,每盒20粒种子,置于25 ℃光照培养箱中培养,每天记录发芽数,观察种子及幼苗病害发生情况,20 d后结束实验。
1.3 数据处理分析
以胚根长出约2 mm为种子发芽标准,从开始发芽至种子连续5 d内不再发芽为止,统计种子霉变率和发芽指标,20 d后统计幼苗发病率。
采用SPSS 17.0软件对数据进行单因素方差分析和多重比较(SNK法)。
发芽率(%)=(种子发芽数/供试种子总数)×100%;
发芽势(%)=(日最高发芽种子数/供试种子总数)×100%;
发芽指数(GI)=∑(Gt/Dt)(式中:Dt为发芽日数,Gt为与Dt相对应的每天发芽种子数);
种子霉变率(%)=(发霉种子数/供试种子总数)×100%;
由于本文篇幅所限,本文从107个实验样本中随机挑选10位驾驶员进行实例分析,其他样本的处理方式与此次相同. 选择这10位驾驶员同一天相似时间段内的50 km行程,按照前述评价因素集的计算方式,计算各项评价因素值如表3所示.
幼苗发病率(%)=(发病幼苗数/幼苗总数)×100%。
表1 KMnO4溶液对毛红椿种子的消毒效果
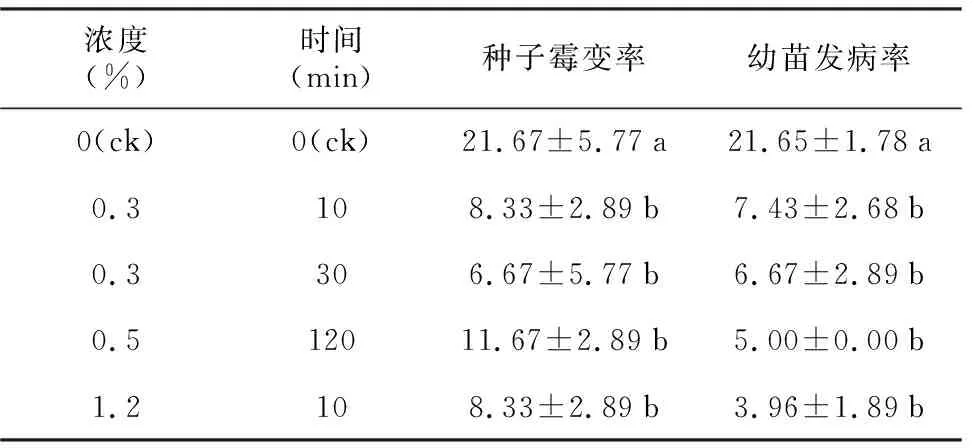
浓度(%)时间(min)种子霉变率幼苗发病率0(ck)0(ck)21.67±5.77a21.65±1.78a0.3108.33±2.89b7.43±2.68b0.3306.67±5.77b6.67±2.89b0.512011.67±2.89b5.00±0.00b1.2108.33±2.89b3.96±1.89b
注:表中同列不同小写字母表示差异显著(p<0.05)。下同。
2 结果与分析
2.1 KMnO4溶液对毛红椿种子消毒效果及对种子活力的影响
KMnO4溶液对毛红椿种子的消毒效果及毛红椿种子发芽和幼苗生长情况如表1和表2所示。用KMnO4溶液消毒处理的毛红椿种子霉变率和幼苗发病率均显著低于对照,而不同浓度KMnO4溶液消毒处理之间无显著差异(表1)。因此,0.3% KMnO4溶液消毒10 min即可以降低种子和幼苗的发病率,增加KMnO4溶液浓度或延长消毒时间,并不能显著提高消毒效果。
经KMnO4溶液消毒处理的种子发芽指数、发芽势及幼苗的根长、茎长、干重与对照无显著差异, 0.3% KMnO4消毒处理30 min的种子发芽率显著高于对照(p<0.05),其它处理与对照无显著差异。以上结果表明,KMnO4溶液处理对种子发芽和幼苗生长无抑制作用。故从消毒效果和种子活力两方面来看,0.3% KMnO4溶液消毒30 min对毛红椿种子有消毒效果,且能够提高种子的发芽率,优于KMnO4溶液的其它处理。
2.2 NaClO溶液对毛红椿种子消毒效果及对种子活力的影响
3%NaClO溶液对毛红椿种子的消毒效果及毛红椿种子发芽和幼苗生长情况如表3和表4所示。3% NaClO溶液处理10 min种子霉变率与对照无显著差异,但幼苗发病率显著降低,增加处理时间(20,30 min),种子霉变率和幼苗发病率显著降低(表3)。
表3 NaClO溶液对毛红椿种子的消毒效果
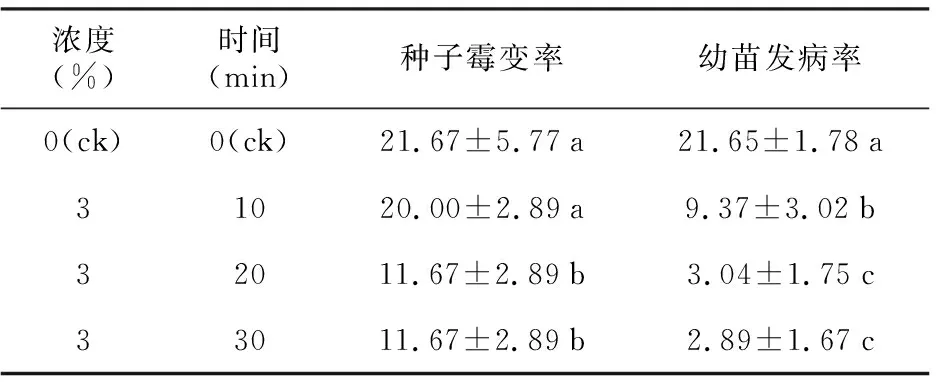
浓度(%)时间(min)种子霉变率幼苗发病率0(ck)0(ck)21.67±5.77a21.65±1.78a31020.00±2.89a9.37±3.02b32011.67±2.89b3.04±1.75c33011.67±2.89b2.89±1.67c
表4 NaClO溶液对毛红椿种子发芽及幼苗生长的影响
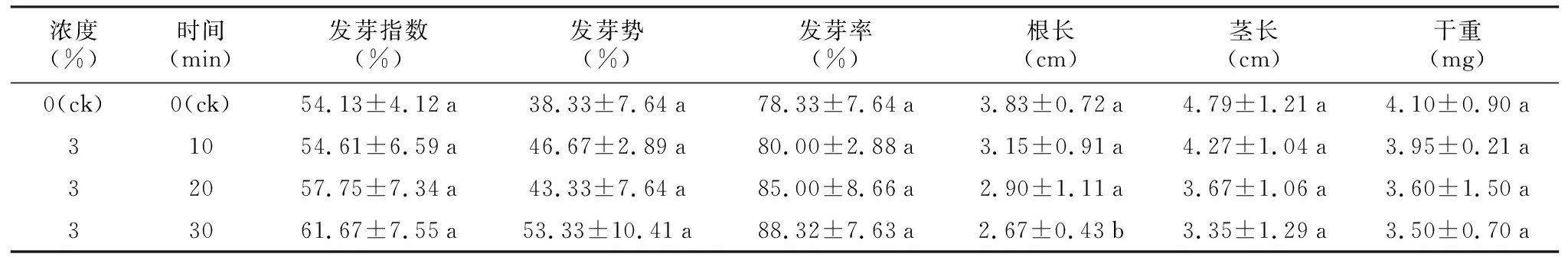
浓度(%)时间(min)发芽指数(%)发芽势(%)发芽率(%)根长(cm)茎长(cm)干重(mg)0(ck)0(ck)54.13±4.12a38.33±7.64a78.33±7.64a3.83±0.72a4.79±1.21a4.10±0.90a31054.61±6.59a46.67±2.89a80.00±2.88a3.15±0.91a4.27±1.04a3.95±0.21a32057.75±7.34a43.33±7.64a85.00±8.66a2.90±1.11a3.67±1.06a3.60±1.50a33061.67±7.55a53.33±10.41a88.32±7.63a2.67±0.43b3.35±1.29a3.50±0.70a
表6 CuSO4溶液对毛红椿种子发芽及幼苗生长的影响
种子发芽指数、发芽势、发芽率、幼苗茎长、干重各处理间无显著差异,随着处理时间的增加发芽率呈增加趋势,而根长、茎长和干重呈降低趋势,3%NaClO溶液浸泡30 min根长显著低于对照(表4)。以上结果表明,NaClO溶液处理对种子发芽无抑制作用,但对幼苗生长有一定的抑制作用。故从消毒效果和种子活力两方面来看,3%NaClO溶液浸泡20 min优于浸泡10 min和30 min的处理。
2.3 CuSO4溶液对毛红椿种子消毒效果的影响
1.5%CuSO4溶液对毛红椿种子的消毒效果及毛红椿种子发芽和幼苗生长情况如表5和表6所示。1.5%CuSO4溶液处理种子,霉变率和幼苗发病率随处理时间的增加而下降;处理40 min,种子霉变率和幼苗发病率均显著低于对照。
表5 CuSO4溶液对毛红椿的种子的消毒效果
种子发芽指数、发芽势、发芽率均随处理时间增加而呈上升趋势,且40 min处理的种子发芽指数、发芽势显著高于对照(p<0.05);萌发幼苗的根长、茎长和干重随处理时间增加而下降。以上结果表明,1.5%CuSO4溶液浸泡种子能提高种子的发芽活力,但对幼苗根和茎的生长有轻微抑制作用。从消毒效果和种子活力两方面来看,1.5%CuSO4溶液浸泡40 min优于浸泡20 min和30 min的处理。
2.4 C2H5OH溶液对毛红椿种子消毒效果的影响
75%C2H5OH溶液对毛红椿种子的消毒效果及毛红椿种子发芽和幼苗生长情况如表7和表8所示。75%C2H5OH溶液40 s处理,种子霉变率和幼苗发病率显著低于对照(表7)。
表7 C2H5OH溶液对毛红椿种子的消毒效果

浓度(%)时间(s)种子霉变率幼苗发病率0(ck)0(ck)21.67±5.77a21.65±1.78a752018.33±5.77a24.06±8.78a753020.67±2.89a26.65±4.94a75406.67±2.89b6.67±2.89b
75%C2H5OH溶液处理种子发芽势、发芽率及幼苗根长、茎长、干重均与对照无显著差异,但发芽势、发芽率随着处理时间增加而降低,75%C2H5OH溶液40 s处理种子发芽指数显著低于对照(表8)。以上结果表明,75%C2H5OH溶液对毛红椿种子的发芽活力有一定的抑制作用,延长消毒时间(40 s以上)对种子活力不利。故从消毒效果和种子活力两方面来看,75%C2H5OH溶液浸泡40 s优于浸泡20 s和30 s的处理。
2.5 多菌灵对毛红椿种子活力的影响
0.13%多菌灵溶液对毛红椿种子的消毒效果及毛红椿种子发芽和幼苗生长情况如表9和表10所示。0.13%多菌灵处理种子发霉率和幼苗染病率显著低于对照,处理12 h和24 h之间无显著差异(表9)。
0.13%多菌灵溶液浸泡12 h处理的种子发芽指数、发芽势和发芽率最高,发芽势与对照存在显著差异,发芽指数、发芽率与其它处理不存在显著差异;各处理间幼苗根长、茎长、干重不存在显著差异,茎长随处理时间增加呈增长趋势(表10)。综上所述,0.13%多菌灵溶液浸泡对毛红椿种子活力有促进作用,对幼苗生长无抑制作用。故从消毒效果和种子活力两方面来看,0.13%多菌灵溶液浸泡12 h优于浸泡24 h。
表10 多菌灵溶液对毛红椿种子发芽及幼苗生长的影响
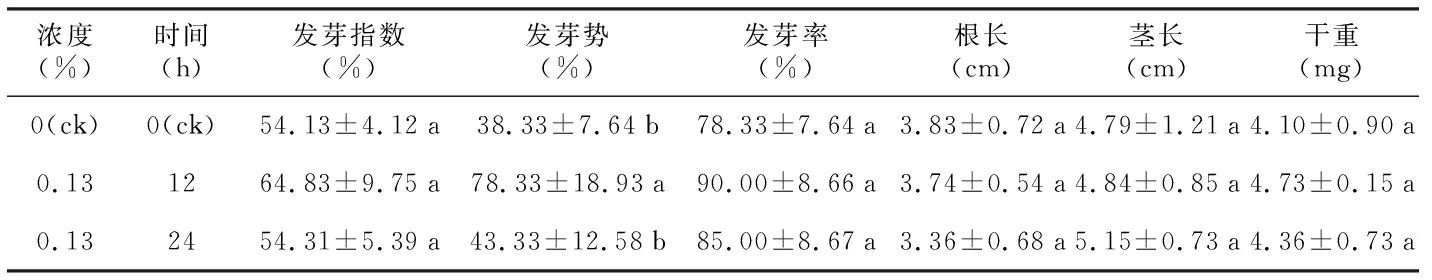
浓度(%)时间(h)发芽指数(%)发芽势(%)发芽率(%)根长(cm)茎长(cm)干重(mg)0(ck)0(ck)54.13±4.12a38.33±7.64b78.33±7.64a3.83±0.72a4.79±1.21a4.10±0.90a0.131264.83±9.75a78.33±18.93a90.00±8.66a3.74±0.54a4.84±0.85a4.73±0.15a0.132454.31±5.39a43.33±12.58b85.00±8.67a3.36±0.68a5.15±0.73a4.36±0.73a
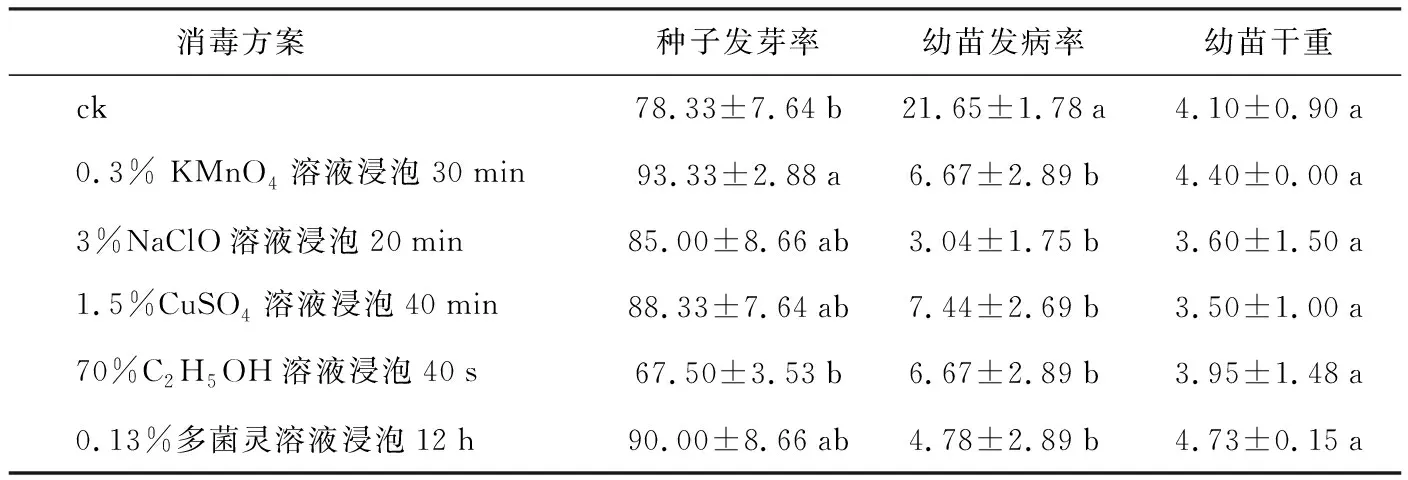
表11 5种消毒方案对毛红椿种子的消毒效果及种苗生长的影响
消毒方案种子发芽率幼苗发病率幼苗干重ck78.33±7.64b21.65±1.78a4.10±0.90a0.3% KMnO4溶液浸泡30min93.33±2.88a6.67±2.89b4.40±0.00a3%NaClO溶液浸泡20min85.00±8.66ab3.04±1.75b3.60±1.50a1.5%CuSO4溶液浸泡40min88.33±7.64ab7.44±2.69b3.50±1.00a70%C2H5OH溶液浸泡40s67.50±3.53b6.67±2.89b3.95±1.48a0.13%多菌灵溶液浸泡12h90.00±8.66ab4.78±2.89b4.73±0.15a
表8 C2H5OH对毛红椿种子发芽及幼苗生长的影响

浓度(%)时间(s)发芽指数(%)发芽势(%)发芽率(%)根长(cm)茎长(cm)干重(mg)0(ck)0(ck)54.13±4.12a38.33±7.64a78.33±7.64a3.83±0.72a4.79±1.21a4.10±0.90a752048.72±8.19ab35.00±10.20a70.50±3.53a3.75±1.38a4.27±1.20a4.15±0.12a753044.80±8.87ab33.66±8.40a68.00±7.07a3.49±1.43a4.67±1.48a3.96±1.27a754043.50±5.50b28.33±6.30a67.50±3.53a3.36±1.66a4.42±0.93a3.95±1.48a
表9 多菌灵溶液对毛红椿种子的消毒效果

浓度(%)时间(h)种子霉变率幼苗发病率0(ck)0(ck)21.67±5.77a21.65±1.78a0.13123.33±2.89b4.78±2.89b0.13241.67±2.89b4.30±2.89b
2.6 5种相对较优消毒方案的比较
以种子发芽率、幼苗染病率和幼苗干重对以上5种消毒剂的相对较优方案(0.3%KMnO4浸泡30 min;3%NaClO浸泡20 min;1.5%CuSO4溶液浸泡40 min;70%C2H5OH溶液浸泡40 s ;0.13%多菌灵溶液浸泡12 h)进行多重比较,结果表明5种消毒方案之间幼苗染病率和幼苗干重无显著性差异,0.3%KMnO4溶液浸泡30 min和0.13%多菌灵溶液浸泡12 h种子发芽率和幼苗干重均高于对照,处理方案相对较优。
3 结论与讨论
高锰酸钾为强氧化剂,其溶液具有很强的杀菌消毒及防腐作用,并且安全、无毒,是很好的蔬菜类种子的消毒剂[10],本试验也同样证明了高锰酸钾对毛红椿种子具杀菌消毒效果,且对毛红椿幼苗生长无抑制作用。0.3%高锰酸钾溶液消毒处理能显著促进毛红椿种子萌发,与张丽等[4]研究结果一致。
次氯酸钠溶液具有强氧化性和腐蚀性,在烟草[11]、大豆[12]、黄连木[13]等种子消毒过程中的效果较好,采用的浓度范围在2%~30%之间,不同植物种子对其耐受能力存在差异。例如:30%NaClO处理烟草种子30 min,消毒效果较好,发芽率最高[14]; 10%NaClO溶液对头花蓼种子消毒可以获得无菌苗,但发芽率显著降低[15]。 本试验结果表明,3%NaClO浸泡毛红椿种子30 min对种子发芽无显著影响,幼苗发病率降低86.7%,但消毒后种皮有破损现象,对幼苗的生长有一定的抑制作用。
硫酸铜主要毒性机理是铜离子与蛋白质结合后生成络合物,使蛋白质变性、沉淀,从而改变酶活性乃至失活。彭健等研究表明,1.5%CuSO4溶液浸种10 min,种子霉变率降低84%,且能显著提高种子活力[16]。徐亚莉等研究表明,0.05~1.50 mmol/L硫酸铜处理对苋菜种子发芽率无显著影响,但其胚根和下胚轴的伸长受到了抑制,种子活力指数急剧下降[17]。本研究表明,1.5%CuSO4溶液浸种40 min,毛红椿种子霉变率和幼苗发病率均降低,显著提高了种子活力,但对幼苗生长有一定的抑制作用。
研究表明,用75%乙醇预处理,可降低种子带菌率[9,11]。本试验表明,75%乙醇处理种子40 s对毛红椿种子具有消毒效果,但种子活力有所下降,幼苗生长也受到抑制。
多菌灵为苯并咪唑类杀菌剂,是低毒性的内吸式农用真菌抑菌剂,其作用机理主要是干扰真菌的有丝分裂中纺锤体的形成,影响细胞分裂,孢子萌发长出畸形的芽管,起到杀菌作用[19]。赵双双等研究表明,添加0.05%浓度的多菌灵可使白及种子母瓶污染率从30%降低至2%,但多菌灵0.05%以上浓度对白及小苗生长抑制较为明显[19]。本研究表明,0.13%多菌灵溶液浸泡12 h,毛红椿种子霉变率和幼苗发病率显著降低,提高了种子发芽率,对幼苗生长没有影响。
毛红椿种子种源不同或因保藏温度和时间的不同,种子带菌数量和种类会发生变化,消毒剂的消毒效果也会改变。本试验中选择的是健康、颗粒饱满的毛红椿种子,所以发芽率较高,病害率较低。结果表明,不同的消毒处理方案并不能杀死所有的有害菌,消毒后种子及幼苗仍有病害发生,主要是长霉,即真菌感染。幼苗的发病特征主要为尖腐和根腐2种。由于提高以上消毒剂浓度和作用时间对种子萌发及幼苗生长的抑制作用或消毒效果的有限性,要得到无菌苗或进一步提高消毒效果,有必要分离鉴定病害真菌,有针对性地进行研究。
通过比较得出以下结论:5种消毒剂对毛红椿种子都有消毒效果,综合考虑对毛红椿种子萌发和幼苗生长的影响认为,0.3%KMnO4溶液浸泡30 min或0.13%多菌灵溶液浸泡12 h为毛红椿种子比较好的消毒方案。

