我国医院医疗器械不良事件报告现状及对快捷上报的需求调研
张静,赵玉娟,黄琳,玄怡,牛惠芳
1. 山东大学 公共卫生学院流行病学系,山东 济南 250012;2. 山东省药品不良反应监测中心 器械监测评价科,山东 济南 250012
引言
医疗器械不良事件指获准注册或已备案、质量合格的医疗器械,在正常使用情况下发生的,导致或可能导致人体伤害的各种有害事件。医疗器械上市后的不良事件监测,是控制风险的一个重要手段[1]。医疗器械不良事件监测是指对医疗器械不良事件的发现、报告、调查、评价和控制的过程。不良事件监测可以为医院采购器械提供依据、使器械的使用培训更具针对性、促进厂家提高产品质量[2],在一定程度上控制了上市医疗器械的潜在风险,保证了医疗器械的安全使用。
我国医疗器械不良事件监测报告中仍存在诸多问题,报告数与实际发生数相差悬殊,应作为报告主体的企业主动调查不良事件比较缺位、报告率过低[3],反映创新性、高风险因素的报告比例低。医疗器械不良事件报告表是医疗器械安全性评价的基础。医疗机构作为医疗器械的重要使用机构,承担着医疗器械上市后监测的重任,而医院、医务工作者对医疗器械不良事件监测工作的认识水平较低,对报表内容填写不重视,空缺率高[4-5]。本文调查我国医疗机构器械故障类不良事件上报现状及对不良事件快捷上报和信息反馈的需求,为加强医疗器械不良事件监测,探索基于医疗器械管理系统的故障类不良事件自动报告路径提供信息。
1 材料与方法
1.1 资料来源
调查对象包括山东省二级医疗机构、全国的三级医疗机构以及省级药品不良反应监测中心。采用方便抽样的方式,山东省17市监测中心抽取辖区内全部三级医疗机构、各市2家二级医疗机构。其他省级药品不良反应监测中心,在各自辖区内抽取6家三级医疗机构,发放医疗机构版问卷,由医学工程部或医疗设备工程师填写问卷。监测中心填写监测中心版问卷。
调查内容:监测中心:本省医疗机构对快捷上报和信息反馈的需求和建议;医疗机构:① 医疗机构对快捷上报和信息反馈的需求情况;② 对建立不良事件自动报告系统的意见和建议;③ 本院医疗器械不良事件报告情况。
1.2 分析方法
采用EpiData 3.1双录入数据,建立质量控制文件并进行逻辑一致性核查,修正录入中的错误,录入结束后进行交叉校对。Microsoft Office 2007进行数据整理,SPSS 21进行统计分析。
2 结果
2.1 样本基本信息
根据经济区域将各省划分为四大块,收到监测中心问卷情况如下:东部地区7份,中部3份,西部12份,东北部2份,共计24份。收到山东省17个市的110家三级医疗机构、49家二级医疗机构的问卷。其他省三级医疗机构收到161份问卷,问卷结构和数量见表1。
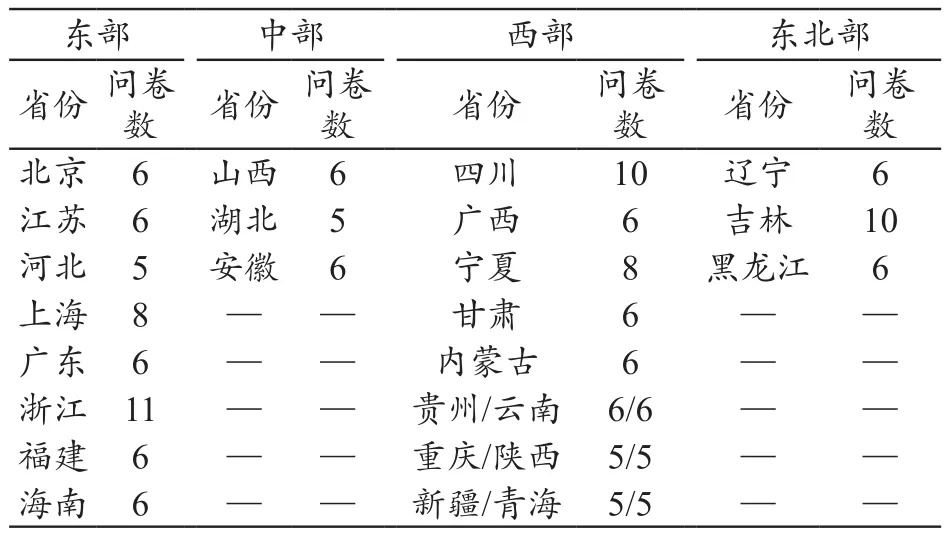
表1 各地区医疗机构问卷数量(份)
2.2 设备故障类不良事件报告现状
2.2.1 报告管理
山东省 78.0%的医院将故障类不良事件报告管理纳入了质量管理体系。其他省将不良事件报告纳入质量管理体系的机构占86.2%,其中东部地区为96.2%,高于西部地区的74.6%(表2)。

表2 不同地区医疗机构故障报告纳入质量管理体系情况 [家 (%)]
2.2.2 报告方式
75.0%的监测中心希望不良事件的报告方式是“方式4”,此外41.7%的中心选择“方式3”。山东省62.8%的机构采用“方式1”,36.5%的机构采用“方式2”。15.86%的人员不满意当前的报告方式,24.5%认为不良事件报告表不方便填写。其他省故障类不良事件报告方式(表3)主要是“方式1”和“方式2”,分别有37.8%和52.8%的医疗机构采用。13.0%认为报告方式不合适,66.5%认为不良事件报告表不方便填写。

表3 不同地区设备故障类不良事件报告方式(家)
2.2.3 内外网联通
山东省 16.78%的医院医疗器械管理信息化系统内外网没有联通,7.38%的机构可选择,75.84%是不联通的。其他省三级机构内外网联通的有13.6%,5.8%的机构是可选的,80.6%的内外网不联通。
2.3 对快捷上报和信息反馈的需求和建议
2.3.1 自动生成报告的必要性
监测中心都认为有必要增加自动提取设备维修记录并生成不良事件报告的功能,山东省88.5%的医疗机构认为有必要,6.3%反对,其他省三级医疗机构83.5%的认为有必要,8.2%持中立态度。
2.3.2 基础信息
监测中心和医疗机构认为该项功能需要的基础信息主要是“企业资料、产品信息、设备状态、维修保修计量信息”,而“产品附件信息、购买情况和患者信息”可以不获取。
2.3.3 负责部门
山东省50.63%的医疗机构认为应该由医学工程部负责,37.97%认为该交由质量管理部门负责,84.1%的机构认为筛选可疑医疗器械不良事件的维修信息上报。其他省三级医疗机构分别有61%和23%选择医学工程、质量管理部负责,77.6%的机构认为上报可疑不良事件的维修信息,22.4%支持上报全部维修信息。
2.3.4 上报国家系统的方式。
山东省50.0%的机构选择:利用“一键上报”软件自动上报,29.8%选择内网生成跨网自动上报。表4显示其他省41.8%的三级机构选择“一键上报”软件。

表4 上报国家不良事件系统的方式
2.3.5 面临的难点
调查显示无法获得准确的器械信息、没有故障类不良事件判断标准是影响上报的主要因素。69.4%的医疗机构认为收集全面的设备故障信息、75.7%的机构认为建立统一的故障类不良事件的判断标准(图1)是建立自动报告系统面临的难点。
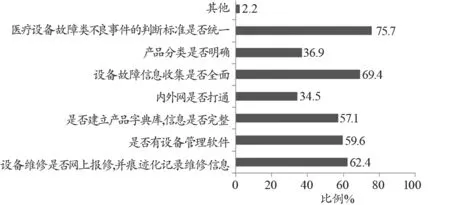
图1 建立不良事件自动报告系统的难点分析
3 讨论
3.1 设备故障类不良事件报告存在的问题
质量管理应贯彻设备管理的整个过程,保障器械使用安全[6]。建立与实施医疗器械不良事件管理体系能降低不良事件的发生率[7],提高报告数据的真实性、完整性和及时性[8]。本次调查显示超过四分之三的医疗机构将设备故障类不良事件报告管理纳入质量管理体系。研究表示医院也在积极开展医疗器械不良事件监测管理工作,以提高上报的质量,控制医疗器械使用风险[9]。说明医疗机构对故障类不良事件监测和报告的积极性和主动性在不断提高,报告质量在不断完善。
为保证数据安全[10],大多数医疗机构的内外网不连通,因此不良事件报告的主要方式是人工局域网填表或填纸质报告表,监测人员审核、外网填报,集中录入国家系统。调查显示,医疗机构人员认为当前在用的报告表填写内容复杂、填报麻烦,上报费时费力,难以获得器械信息、故障是否属于不良事件难以判断是影响上报的主要原因。认识不到位,上报不积极,填报的数据存在漏填、信息不准确等问题,使得上报的效率和准确率不高。完善相关的管理规范和技术指南、加大监测人员的专业培训、提高医务人员对医疗器械不良事件监测的认知度有助于改善医疗器械不良事件监测现状[11-12]。
监测中心人员表示,一键生成不良事件报告,监测人员审核后利用一键上报模块上报国家系统,是比较合适的有源故障类不良事件上报方式,鉴于当前的报告方式和质量存在诸多问题,当前在用的不良事件监测系统的缺点和不足也逐渐显现[13-14]。创新报告和监测模式可以从源头提高报告质量[15],因此有必要探索一种医疗器械不良事件快速上报和主动监测模式,以提高报告质量、减少漏报[16]。
3.2 对快捷上报和信息反馈的需求和建议
调查表明监测中心和医疗机构比较赞同在设备管理系统中增加自动提取设备维修记录并生成不良事件报告的功能,说明不良事件自动报告模式是有需求有认可,有研究空间的。系统中增加该项功能时企业资料和产品信息必不可少,设备状态维修计量和附件信息需要考虑,购买情况和患者信息尽量实现。大部分中心和机构认为筛选可疑不良事件维修信息上报即可。在研究该功能时可作为建立基础信息的参考。
调查显示,相比质量管理部和医务管理部,医疗机构认为医学工程部更能负责该项功能。医学工程人员在监测、上报器械不良事件,设备维修保养、质量控制以及与临床沟通反馈工作中优势明显[17],因此负责管理该项功能的部门可以优先考虑医学工程部,自动生成不良事件报告后上报国家不良事件系统的方式,调查显示“内网生成,导出并拷贝到外网电脑,利用‘一键上报’软件自动上报”需求最多。而也有部分医疗机构对自动生成报告后一键上报的方式不认可,主要是顾虑报告的数据量大、信息不准确;故障原因不明确,增加许多没有价值的报告;医用耗材无法实现自动提取;数据不安全等。如何收集全面的设备故障信息、建立统一的故障类不良事件判断标准是建立不良事件自动报告系统面临的主要难点。
4 结论
我国医疗机构对设备故障类不良事件主动监测的意识和水平在不断提高,当前不良事件报告方式在发挥其作用的同时,也存在一些不足之处,基于设备管理系统的不良事件自动报告模式应运而生。该自动报告模式在医疗机构中有广阔的应用前景,可以最大限度的改善目前不良事件报告中存在的问题,提高报告质量和效率,但也面临一些待攻克的难点,需多部门多学科人才协作研究。

