非血液接触式心室辅助装置的现状及展望
廖晓倩,周晓辉
中国药科大学 基础医学与临床药学学院,江苏 南京 211198
引言
心力衰竭是由于任何心脏结构或功能异常导致心室充盈或射血能力受损的一组复杂临床综合征。我国2000年全国心衰患病率调查,纳入10个省市、20个城乡调查点,35~74岁城乡居民15518例,调查显示,我国心衰患病率为0.9%,预估我国心衰患者逾千万。我国人口基数庞大,人口老龄化日趋严重,综合我国心血管危险因素(高血压、慢性肾病、肥胖和糖尿病等)和心血管疾病发病、患病不断增加的现状,可以预见我国心衰疾病负担将不断增重[1]。据美国的统计资料显示,美国每年有40~70万的心衰患者产生,人群中心衰患病率达1.5%~2%,在过去40年中,由心衰导致的死亡增加了6倍,心衰是主要心血管病中发病率显著增加的唯一病症[2]。在美国大约有570万心衰患者,其中5%(大约142500人)处于心功能IV级,而每年只有大约2100例患者能进行心脏移植[3]。虽然心脏移植是治疗心力衰竭唯一有效的办法,但由于供体来源、手术风险、经济费用的限制,仍有绝大部分的心衰患者未能接受移植治疗。因此许多替代治疗方法应运而生。
心室辅助装置在20世纪60年代开始研发并成功用于临床,为心脏移植的过渡期提供了有效的治疗方法。临床常用的主要是左心室辅助装置,是通过连接心尖和主动脉,通过机械泵直接参与血液输送及回流,但由于其直接接触血液,必须长期服用抗凝药物,且不可避免出现败血症、气栓、加重心衰等问题,手术创伤大,对心肌的取孔无法修复,不利于心肌功能恢复。目前国内外也有许多研究人员开始研发非血液接触式的心室辅助装置,直接包裹心脏,通过给予一个被动或主动的压力来提升心脏输出量,改善心脏纤维化,减少心室重构,非血液接触式心室辅助装置能够降低栓塞、出凝血问题引起的并发症的风险,简化治疗方案,并且降低治疗费用。
1 研究进展
1.1 国外研究进展
非血液接触式直接心室辅助装置主要以压力辅助型为主,另外还有监测辅助型及药物治疗型。最早的压力辅助型非血液接触式直接心室辅助装置——Anstadt cup在1965年由Anstadt等[4]研发成功,并在1989年被批准用于临床,临床试验的结果也证实了Anstadt cup能够有效地改善心衰患者的心功能,是心脏移植的一种有效的过渡性替代治疗手段。
2017年,Roche等[5]根据心脏的肌肉走向设计了一款非血液接触式心室辅助装置——Soft robotic sleeve,是由多条人工定制的软体充气肌肉通过硅胶塑形构成,可以通过充气控制其收缩舒张,可分开控制左右两边充气,还可调整左右两边心室不同的压力。Soft robotic sleeve最大的优点是可以定时地对心脏给予压力,能够同步于正常心脏周期,顺应心脏自身跳动及节律,并能同时监测心率、肺动脉压、升动脉压和血流流速等参数。Soft robotic sleeve选用了软体充气肌肉作为制动部分,其独特的地方在于靠近心脏一侧的管壁有许多褶子,在充气时,这些褶子撑开使管腔能容纳更多气体,产生更大的压力。Soft robotic sleeve根据肌肉走向设计了3种类型(图1[5]):环绕型(C型)、斜型(T型)、混合型(C+T型),Roche等[5]分别使用这3款装置在体外进行了压力试验,发现混合型产生的压力最大,输出量最大,其次是环绕型,斜型的输出量最小。通过在急性心衰的猪模型体内植入Soft robotic sleeve,发现该装置能够使心输出量恢复至正常基线水平的大约97%,改善心脏舒张功能。
定量心室约束装置(Quantitative Ventricular Restraint,QVR)是一款类似Anstadt cup的杯状的压力辅助型非血液接触式直接心室辅助装置(图2[6]),其最大的不同是底部连接植入式皮下静脉输液港,实现完全植入,另外,QVR是通过两层间通入液体使内层的聚氨酯膨胀挤压心脏,液体作用于心脏相对于气体来说,更加柔和、作用力更广。QVR植入体内后,医生可依据实时的超声心动图来评估心脏状态,可根据需要随时对患者给予定量的液体来调控压力。Ghanta等[6]将QVR植入慢性心力衰竭模型的绵羊心脏上,通过植入式皮下输液港定量地给心脏给予不同体积的液体,经过21天的治疗后,发现随着注射的体积增大,心衰绵羊的LVEDV会降低的更多。相较于Soft robotic sleeve来说,QVR的优势在于能够完全植入体内,无过多的外界连接装置,更加轻松便捷,长期植入对改善心功能也有不错的效果。
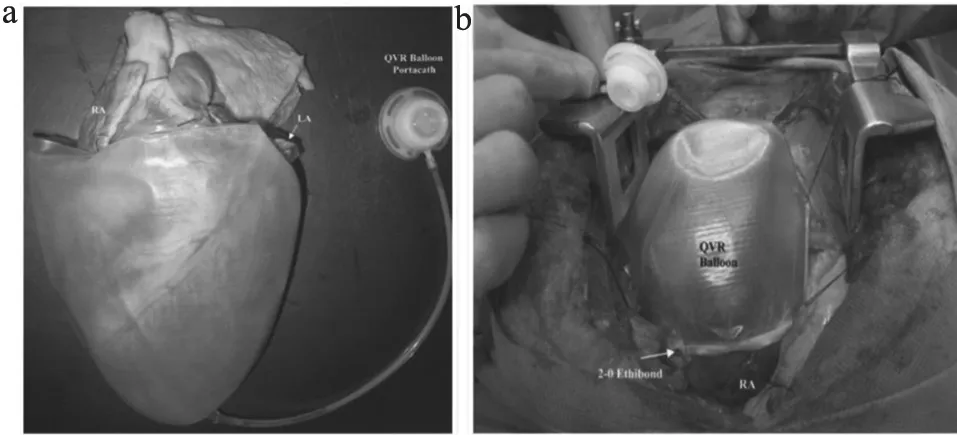
图2 QVR装置
最近,德克萨斯A&M大学生物医学工程系教授John[7]实验团队研制的EpicHeart更为先进,它是通过输送鞘管从肋骨间隙进入胸腔并将薄膜支架释放,并类似吸盘样完全包裹吸附在心室壁上无需缝合,EpicHeart与心脏之间填充生理盐水,通过气泵使EpicHeart膨胀使其产生同步于心脏的平缓、均匀的压力,促进心脏修复(图3[7])。
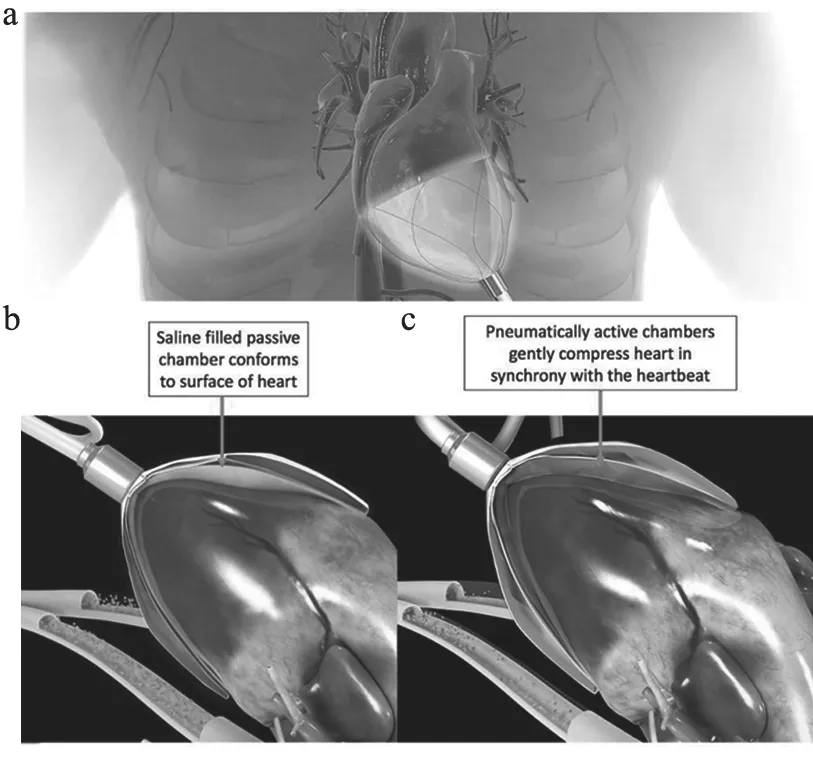
图3 EpicHeart装置
目前研究的压力辅助型非血液接触式心室辅助装置大都附带有气泵或液泵动力系统,早前也有直接约束心脏的被动约束型心室辅助装置(图4a~d),如心脏支持装置[8](Cardiac Support Device,CSD)、心脏网[9](Heart net),它们由于植入后无法调节,作用十分局限,使得心衰患者的长期生活质量及生存率上并未得到有效地改善[10-11]。
监测辅助型非血液接触式心室辅助装置(图4e)如Xu及Gutbrod通过3D打印创建的具有三维弹性的多功能传感器平台(3D multifunctional integumentary membranes,3D-MIMs),可以提供心外膜心电图、心肌温度、pH值及心肌机械应变力等参数[12],对于评估患者的病情发挥着重要作用。药物支架[13]、细胞薄片(cell sheet)[14]等通过将药物、细胞(如心肌干细胞、骨髓间充质干细胞、胚胎干细胞等[15-16])、基因[17]与纤维、胶原蛋白制成的水凝胶薄片、或者明胶支架,贴附于心外膜,起着修复缺血性心肌细胞的作用[18],这类装置我们将其归为药物治疗型的非血液接触式心室辅助装置(图4f[9,11-12,14])。

图4 其他类型非血液接触式心室辅助装置
1.2 国内研究进展
国内对于非血液接触式心室辅助装置的研究较少。2003年,Zhou[19]开始研究主动性液压心室贴附支持给药系统(Active Hydraulic Ventricular Attaching Support System,ASD),它是由许多横纵相通的管道构成的类似CSD结构的套管装置(图5[20]),将其包裹在心室周围,缝合固定于房室沟,并将ASD的外接管道引出固定于体外,通过向外接管道输注液体使ASD膨胀挤压心脏,增加心输出量。另外,ASD靠近心室壁的管道内膜上有许多小孔,可以通过外接管道直接心外膜给药治疗,对于一些全身给药毒性较大的药物可以通过ASD局部心外膜给药,降低全身不良反应。ASD是一款多功能型的心室辅助装置,可通过物理性约束联合药物治疗,有效地缩小心肌梗死面积,提高左室射血分数,改善心功能[21]。

图5 ASD装置
2011年,邬顺捷等[22]设计了一款双腔气动心脏辅助杯,直接连接心脏辅助控制器、真空泵、空压机等,通过电脑控制对左右心室的压力,体外模拟循环实验数据显示,应用该装置后主动脉压为94~120 mmHg,主动脉流达5.9 L/min,满足人体循环需求[23]。
2 展望
根据我国部分地区42家医院,对10714例心衰患者回顾性调查发现,各年龄阶段心衰病死率均高于同期其他血管病,其主要死亡原因依次为左心功能衰竭(59%)、心律失常(13%)和猝死(13%)[24]。目前指南[25]中推荐使用的器械如左心室辅助装置、主动脉球囊反搏、心脏同步化治疗、植入式除颤器等都只是主要针对泵衰竭或者心律失常单方面进行改善,而心衰致死的原因较为复杂,泵衰竭及心律失常之间可相互影响,临床也有同时置入左心室辅助装置及起搏器的例子。目前非血液性接触心室辅助装置各有千秋(表1),将它们的特点融合形成多功能型的心室辅助装置才能应对心衰患者复杂的临床情况,对非血液性接触心室辅助装置来说,压力调控是基础,将其构建成一个个体化多功能综合治疗平台是未来的发展方向。
2.1 材料、结构及工艺
非血液接触心室辅助装置直接植入心脏表面,对材料及工艺要求都非常高。首先,所选材料必须具有良好的生物相容性,才能避免或减少植入后所造成的粘连排斥及炎症反应等,保证装置的安全性;其次,需要柔韧且轻薄的材料作为贴近心外膜的一面,而外层则需刚性材料,在进行压力调控时,内层可承受一定压力范围的收缩、膨胀,以达到挤压心脏的功能,并且能较好地贴合心脏,外层则可维持装置的基本构造,整个装置应选用轻质量材料,避免装置成为心脏搏动的负荷,减轻心脏负担;材料还应选择能耐受电流、各种药物、磁场,且不影响电路、药物作用,不干扰电流传递,信号传递的;心室辅助装置形状结构各不相同,但基本都与心脏形态一致,杯状设计占大多数,能够提供整体的作用力,使作用于心脏的力更加均匀,但若为单个空腔,则无法依据实际情况细调左右心室的作用压力。若将心室辅助装置构建为一个精准化综合治疗平台,还需进行分区构造,需考虑每个区域负责的生化、药物、心电等不同功能所需的特殊构造,而区域之间又不会相互影响。
2.2 动力系统
心室辅助装置的动力系统是核心,无论是气泵式还是液泵式,都必须携带一定气体或液体并通过压缩泵将其泵入心室辅助装置的腔内,产生膨胀及收缩。目前实验室阶段的非血液接触性心室辅助装置的制动系统体积较大,属于体外测试型或急性实验型,直接置于体外,若要进一步应用于临床,动力系统不仅要小巧便携可操控,还要具有生物相容性。此外,心室辅助装置的动力能源系统的来源及维护也是需要关注及研究的方面。
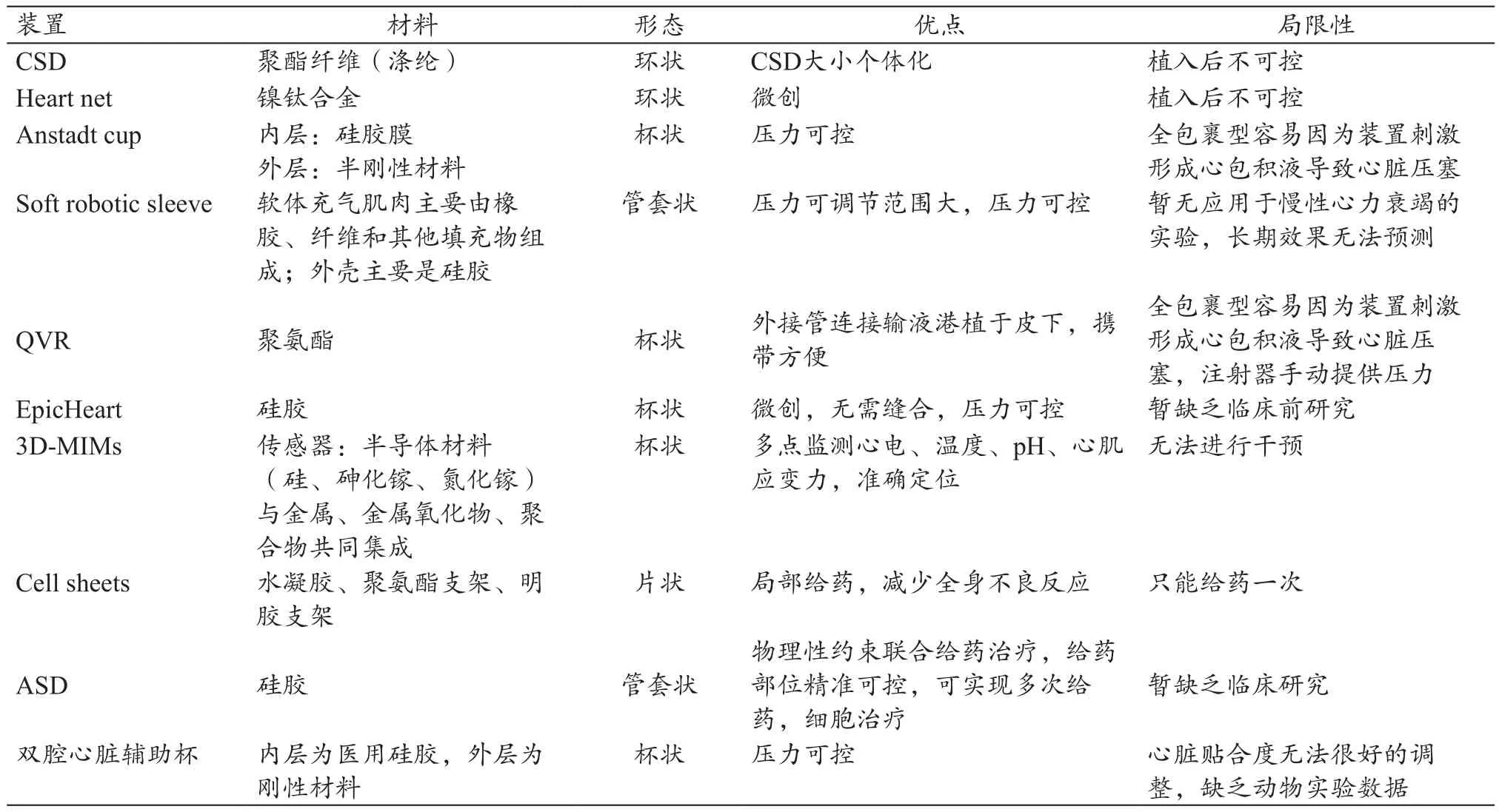
表1 各类非血液接触式心室辅助装置之间比较
2.3 监测干预系统
目前数据采集的传感器芯片研究越来越成熟,越来越微型化,未来非血液接触式心室辅助装置不仅能监测心脏各类参数,还应将参数实时反馈至外界设备,实现远程管理操控,方便医务人员术后监护干预,同时实现患者的自我管理。
3 结论
非血液接触性心室辅助装置不仅能够辅助心脏泵血,减少心肌耗氧量,为心脏移植提供了有效的过渡,还可避免血栓、血液感染等风险。随着患者需求增加,医学、新材料、电子信息工程和力学等的发展,未来非血液性心室辅助装置将不仅局限于压力性辅助,而趋向于多功能个体化综合治疗监护平台的发展,前景更加广阔。

