两种术式治疗肝巨大血管瘤临床疗效比较*
郑学华,张阳光,曾禹,李洪永
肝血管瘤是一种常见的肝脏良性肿瘤,临床上以海绵状血管瘤最为常见,自然人群尸检发现率为0.35%~7.3%,占肝良性肿瘤的5%~20%[1]。研究显示,小的肝血管瘤一般无明显症状,在体检时经B超或CT等检查时偶然被发现。随着肿瘤直径的增大,少数患者会因胃肠道不适、恶心、腹胀或腰背部疼痛等就诊[2]。本研究通过回顾性分析我科收治的82例肝巨大血管瘤患者的临床资料,比较了肝切除术与血管瘤剥脱术的治疗效果,现将结果报道如下。
1 资料与方法
1.1 一般资料 2014年5月~2016年4月我院肝胆外科收治的肝巨大血管瘤患者82例,经B超、CT或MRI等影像学检查明确诊断,且经术后组织病理学检查诊断。肿瘤直径≥10 cm,肝功能Child-Pugh分级为A级,患者无手术禁忌证。根据手术方式的不同,将患者分为肝叶切除术组和肝血管瘤包膜外剥脱术组,每组41例。两组一般资料比较,差异不具有统计学意义(P>0.05)。患者签署知情同意书,本研究经我院医学伦理学委员会审核通过。
1.2 统计学分析 对于符合正态分布且方差齐性的计量资料以±s表示,组间比较采用独立样本的t检验,计数资料的比较采用卡方检验,检验水准为α=0.05,应用SPSS 19.0版软件进行分析。
2 结果
2.1 两组一般资料比较 两组患者在性别、年龄、肿瘤发生部位、肿瘤类型、肿瘤直径、血清ALT、AST、AKP、血Hb和PLT等一般资料比较,差异不具有统计学意义(P<0.05,表 1)。
表1 两组一般资料(%,±s)比较

表1 两组一般资料(%,±s)比较
肝叶切除(n=41)肿瘤剥脱(n=41) t/x2 P性别(男 /女) 19(46.3) 17(41.5) 0.2 >0.05年龄(岁) 52.3±6.6 51.5±7.1 0.6 >0.05肿瘤部位 0.8 >0.05左叶 25(61.0) 21(51.2)右叶 16(39.0) 20(48.8)肿瘤类型 0.7 >0.05单发 32(78.0) 35(85.4)多发 9(22.0) 6(14.6)肿瘤直径(cm) 11.4±3.1 10.9±3.6 0.6 >0.05 ALT(U/L) 18.2±10.2 20.4±11.2 0.9 >0.05 AST(U/L) 21.3±5.2 22.5±6.3 0.9 >0.05 AKP(U/L) 63.2±20.1 65.5±21.2 0.5 >0.05 Hb(g/L) 130.7±30.5 140.4±30.7 0.8 >0.05 PLT(×109/L) 178.7±45.3 187.4±46.2 0.9 >0.05
2.2 两组手术指标和住院日比较 肿瘤剥脱患者手术时间、术中出血量、术中输血量、肝血流阻断时间和住院日均显著短于或少于肝叶切除组,差异具有统计学意义(P<0.05,表2)。
2.3 两组术后并发症发生情况 肝叶切除患者术后并发症发生率显著高于肿瘤剥脱组(P<0.05,表3)。
2.4 典型病例CT表现及手术情况 见图1~6。
2.5 随访情况 经术后随访1年,肝叶切除患者术后血管瘤复发1例,失访11例,其余29例患者血管瘤消失;肿瘤剥脱患者无死亡病例,复发1例,失访8例,其余32例患者血管瘤消失。
表2 两组手术指标和住院日(±s)比较
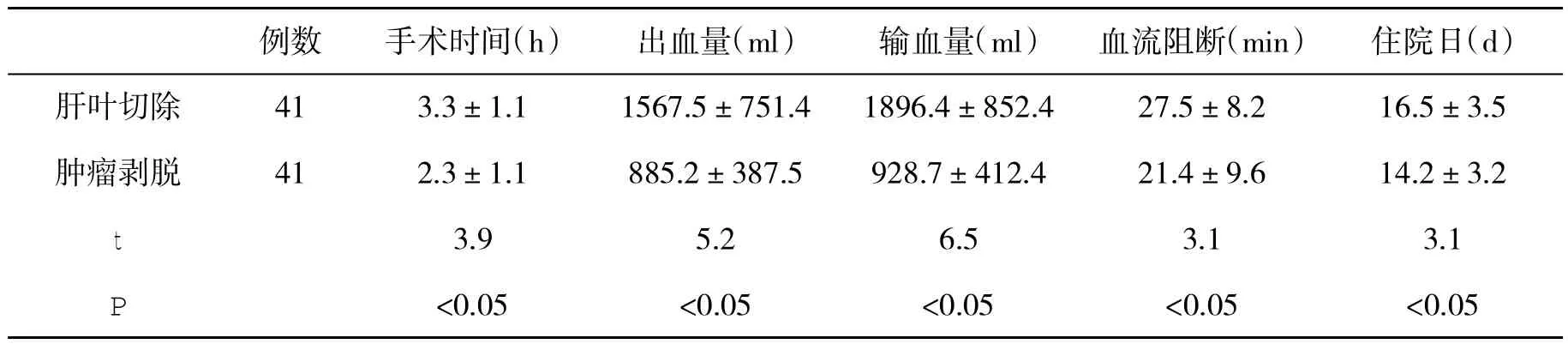
表2 两组手术指标和住院日(±s)比较
例数 手术时间(h) 出血量(ml) 输血量(ml) 血流阻断(min) 住院日(d)肝叶切除 41 3.3±1.1 1567.5±751.4 1896.4±852.4 27.5±8.2 16.5±3.5肿瘤剥脱 41 2.3±1.1 885.2±387.5 928.7±412.4 21.4±9.6 14.2±3.2 t 3.9 5.2 6.5 3.1 3.1 P<0.05 <0.05 <0.05 <0.05 <0.05

表3 两组术后并发症发生率(%)比较

图1 肝血管瘤患者腹部CT表现患者男,60岁。增强CT动脉期显示肝右叶巨大血管瘤

图2 术野 行肝叶切除术时,用阻断带阻断右半肝入肝血流
图3 肝血管瘤切除术标本

图4 肝血管瘤患者腹部CT表现患者男性,58岁。增强CT显示肝右叶巨大血管瘤
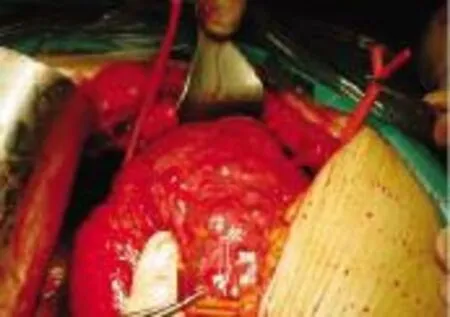
图5 术野 行肝血管瘤剥脱术,在第一肝门、肝下和肝上下腔静脉预置阻断带

图6 肝血管瘤剥脱术切除标本
3 讨论
治疗肝血管瘤的方法选择取决于血管瘤的大小、生长位置和增长速度等因素,而临床关于肝血管瘤手术适应证的问题仍然存在许多争议[3-6]。符开伙等[7]研究认为,肝血管瘤的外科手术适应证为:①肿瘤直径≥10 cm的肝巨大血管瘤,短期内增长较快;②肿瘤直径在5~10 cm之间的肝大血管瘤,位于肝脏边缘或突出肝脏表面生长,有发生破裂的风险;③肿瘤直径在3~5 cm之间,但无法通过其他治疗方法使症状得到缓解;④B超、腹部CT或磁共振等显示为肝血管瘤,但与其他肝占位性病变难以鉴别;⑤肝血管瘤紧贴肝门及腹部大血管,瘤体容易出现破裂或侵袭肝门周围血管和胆管。同时也有学者认为,为避免因肿瘤增长与周围组织形成广泛的交通血管,增加手术难度和出血风险,应该对患者采取积极的干预措施,及早进行处理[8]。
目前,手术切除被认为是临床上治疗肝血管瘤最有效、最安全的方法之一,而肝血管瘤切除术中主要包括肝切除术和肝血管瘤包膜外剥脱术[9]。对于巨大血管瘤或位于特殊部位的血管瘤,手术切除也存在一定的难度,其原因是肝巨大血管瘤占肝脏体积较大,常紧贴肝动脉、门静脉、肝静脉、下腔静脉、腹主动脉及胆道系统,并可侵袭至第一、第二及第三肝门。由于血管瘤血供丰富,瘤体本身容易出血,术中操作不当可能会出现难以控制的大出血。因此,在肝血管瘤切除术中控制出血是手术成功的关键[10,11],而肝血管瘤切除术中主要通过控制入肝和出肝血流来达到控制出血的目的,目前主要有以下几种方式:Pringle阻断法[12]、选择性半肝血流阻断法[13]和全肝血流阻断法[14]。本研究采用序贯血流阻断法(又称为“改良的Pringle法”)来达到减少出血的目的,手术过程中先阻断第一肝门,能够使肝血管瘤缩小、变软,便于手术顺利进行。然后,进行第一、第二肝门分离,对切除半肝患者,分离并结扎患侧肝蒂,减少出血量,同时在阻断第一肝门和肝下下腔静脉、肝上下腔静脉或肝静脉下行切断肝叶或进行肝血管瘤剥脱时,应在血管瘤包膜外剥除,避免损伤瘤体,引起大出血[15]。血管瘤剥除术相对于规则性肝叶切除术,在术中出血量及输血量方面具有明显优势[16]。本研究采用的肝切除术是一种可行术式,可用于单发、局限于肝段或半肝肿瘤,切除范围应根据肝血管瘤的大小及位置而定。肝切除术创面较大,术中出血量多,可能出现腹腔积液或胆漏等并发症,需要术后留置引流管[17]。而肝血管瘤包膜外剥脱术是通过对肝血管瘤与正常肝组织间疏松间隙进行剥离,达到将血管瘤摘除的目的,对患者创伤小,患者术后恢复快,同时能够显著减少出血量及术后并发症,最大程度保留正常肝组织[18]。本研究结果显示,肿瘤剥脱患者手术时间、术中出血量、术中输血量、肝血流阻断时间及住院天数均显著短于或少于肝叶切除,说明肝血管瘤包膜外剥脱术较肝切除术操作更加简便,手术时间短,同时由于肝血管瘤血供丰富,肝血管瘤包膜外剥脱术能够最大程度地避免损伤肝脏血管,减少术中出血和术中输血量,降低术后腹腔出血风险,且剥脱术能够最大程度地保留正常肝组织,保全肝脏功能,患者术后恢复快,从而缩短了住院时间。通过比较两组患者术后并发症发生情况,可以看出肝叶切除患者术后并发症发生率为34.15%,显著高于肿瘤剥脱组的14.63%,其可能是剥脱术在分离正常肝组织和肿瘤组织时,沿着瘤体自然包膜进行肿瘤剥脱操作,减少了对胆管的破坏,且术中出血量减少,从而降低了术后并发症的发生。
综上所述,肝切除术和肝血管瘤包膜外剥脱术均是治疗肝巨大血管瘤的有效方法,肝血管瘤包膜外剥脱术较肝叶切除术具有操作简便、手术创伤小、出血量少、术后恢复快和术后并发症少等优势。考虑到本研究为回顾性研究,还需要进一步进行随机对照的前瞻性研究,同时本研究样本数量较少,还需要积累更多的病例进行深入的探讨。

