肝脏CT三维重建评估肝门部胆管癌根治术临床应用研究*
李连海,许惠玲,王金榜
肝门部胆管癌(hilar cholangiocarcinoma,HCCA)是胆道系统最常见的恶性肿瘤,约占胆道系统肿瘤的50%~70%。HCCA早期发现率极低,患者因黄疸就诊时已多伴有血管或肝叶侵犯,要完成肿瘤R0切除常需要大范围肝切除及门静脉切除重建。该手术复杂且并发症多,术前常需CT三维重建评估肝切除量及手术风险。本研究采用CT三维重建检查评估肝切除联合门静脉重建治疗的HCCA患者,取得良好的治疗效果,现分析总结报道如下。
1 资料与方法
1.1 一般资料 2013年1月~2017年1月我科收治的HCCA患者33例,经术后组织病理学检查诊断为胆管癌,Bismuth-Corlette分型为Ⅱ、Ⅲ、Ⅳ型,肝功能Child-Pugh评分均为A级,或B级经治疗后转为A级,无肿瘤远处转移。19例观察组术前采用肝脏CT三维重建评估,14例对照组术前采用CT检查资料评估(表1)。
表1 两组术前一般临床资料(n,±s)比较
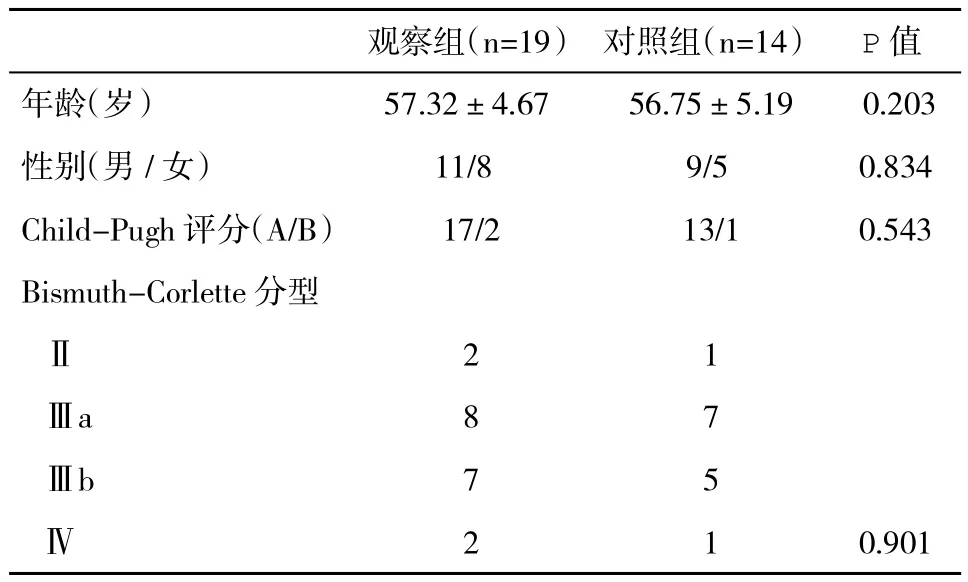
表1 两组术前一般临床资料(n,±s)比较
观察组(n=19) 对照组(n=14) P值年龄(岁) 57.32±4.67 56.75±5.19 0.203性别(男/女) 11/8 9/5 0.834 Child-Pugh评分(A/B) 17/2 13/1 0.543 Bismuth-Corlette分型Ⅱ2 1Ⅲa 8 7Ⅲb 7 5Ⅳ2 1 0.901
1.2 CT检查方法 检查前20 min口服清水800~1000 ml,给予碘普罗胺(优维显,Iopromide,广州先灵药业有限公司,300 mg/ml)80~120 ml(1.5~2 ml·kg-1)经前臂肘正中静脉注射,注射速度为3 ml/min,启动自动追踪扫描(bolus tracking)程序行肝动脉期扫描,注射开始后26~32秒为肝动脉期,45~53秒为门静脉期,60~68秒为肝静脉期。然后,将CT数据(包括平扫期、动脉期、门脉期、静脉期,格式为Dicom 3.0)导入三维重建软件(3D-liver,专利号:ZL 2016 2 0872989.X),建立肝脏三维模型。应用三维重建模型评估肿瘤R0切除的可能性:①纵向评估肿瘤沿胆管侵犯的范围,初步判断Bismuth-Corlette分型;②横向评估肝血管受侵犯的程度,评估是否需联合肝血管切除重建及重建的可能性;③评估是否合并肝叶萎缩,是否需联合肝叶切除术及评估肝脏的储备功能;④评估淋巴结转移情况;⑤评估是否有远处转移。依据三维重建模型,行虚拟手术,并制定手术方案。
1.3 肝门部胆管癌根治术 所有病例术前均行血清肿瘤标记物检测、上腹部增强CT、MRI和MRCP等检查。依据影像学检查结果评估行肝切除联合门静脉重建术。包括根治性胆管肿瘤切除和十二指肠韧带骨骼化清扫、肝叶切除术、肝动脉和/或门静脉部分切除重建、区域淋巴结清扫和胆道重建及胆肠吻合。
1.4 统计学处理 应用SPSS 19.0统计软件分析,计量资料以(±s)表示,采用t检验,计数资料的比较采用x2检验,P<0.05为差异有统计学意义。
2 结果
2.1 典型病例介绍 患者男,53岁。因发现无疼性眼黄皮肤黄1周入院。查体:皮肤巩膜重度黄染,心、肺、腹未见明显异常。肝功能示血清TBIL为434.2 μmol/L,DBIL 为 293.8 μmol/L,ALB 为 42.3 g/L,ALT为168 U/L,AST为109 U/L,凝血功能指标正常。血清肝炎病毒标记物阴性,AFP正常,CEA 101μg/ml,CA-199 237U/m l,增强 CT 和 MRI/MRCP提示胆总管上段占位,向上侵及右肝管(图1、图2)。初步诊断:肝门部高位胆管癌,Bismuth-Corlette分型Ⅲa型。将增强CT数据导入三维重建软件3d-liver,进行三维重建,建立肝脏三维可视化模型(图3~图8)。从肝脏CT三维重建影像模型评估可见:①从纵向评估,肿瘤灶位于胆总管上段,侵及右肝管,初步考虑为Bismuth-Corlette分型Ⅲa型,肿瘤向肝内侵蚀右肝内胆管,需联合肝切除以达到R0切除,术前需评估肝脏储备功能;②从横向评估,肿瘤侵犯门静脉起始处,门静脉右支远端分支细小,门静脉左支较粗大。术中可于门静脉右支起始部横断,必要时可行门静脉左支与门静脉主干吻合。肝动脉未受肿瘤侵犯,存在解剖变异,副肝右动脉起自肠系膜上动脉,副肝左动脉起自胃左动脉。肝中静脉与肝左静脉共干,在行扩大右半肝切除时,需保护肝左静脉;③发现右肝明显萎缩,肝脏左外叶明显增大,整个肝脏呈顺钟向转位。测量全肝体积为1913.5 cm3,肝左外叶体积为1179.6 cm3,余肝体积为733.9 cm3。肝左外叶占全肝体积的61.6%,余肝体积占全肝体积的38.4%。拟行右三肝叶切除术,患者残肝分数>50%,可以耐受手术,初步评估在肝切除术后发生肝衰竭的机率不高;④腹部增强CT示,肝门部和腹腔未见明显肿大淋巴结,未见明显远处器官转移。综上分析,该患者为胆管癌,Bismuth-CorletteⅢa型,MSKCC T2期。依据上述CT三维重建模型评估及虚拟手术结果,拟行肝门部胆管癌根治联合右三肝切除、门静脉部分切除重建和胆管空肠Roux-en-Y吻合术。实际手术中探查发现,术前评估结果与实际病情相同(图9、图10),遂行肿瘤R0切除,手术顺利,术中出血约400 ml,手术时间为2.7 h,术后2 w出院,术后未发生肝衰竭、胆瘘、出血等严重并发症。术后组织病理学检查示,中、高分化胆管腺癌,上、下切缘阴性,送检淋巴结4/12(+)。术后随访2年,未见肿瘤复发。
2.2 本组手术情况 本组33例HCCA患者均顺利完成手术,术后组织病理学检查证实为胆管癌,其中19例观察组患者行R0切除12例(63.2%),14例对照组R0切除6例(42.9%,P<0.05);术中出血量分别为(425.3±124.5)ml和(539.4±234.7)ml(P<0.05);手术时间分别为(3.2±1.3)h和(4.1±2.5)h(P<0.05);术后住院时间分别为(11.7±4.8)d 和[(13.9±5.4)d,P<0.05];术后并发症发生率分别为10%和 12%(P>0.05)。
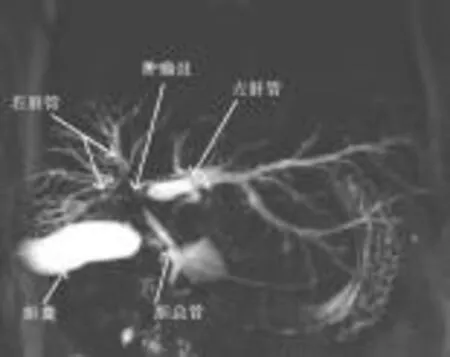
图1 腹部MRCP表现 肿瘤病灶位于胆总管上段,侵及右肝管,左肝管明显扩张
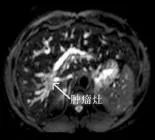
图2 腹部MRI表现 T1WI示肿瘤灶向肝内侵蚀右肝管
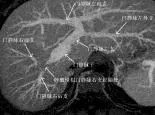
图3 腹部CT表现 门静脉MIP重建示门静脉右支起始处受肿瘤侵犯
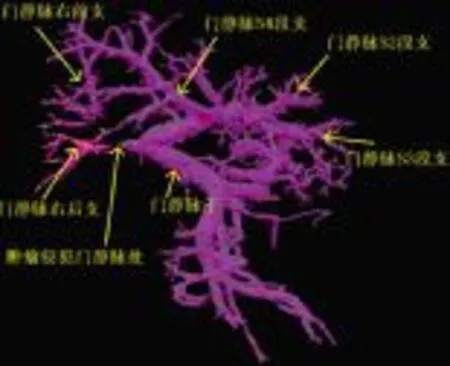
图4 肝脏CT三维重建模型 肿瘤灶侵蚀门静脉右支起始处

图5 肝脏CT三维重建影像模型 肝动脉存在变异,其中副肝右动脉起自肠系膜上动脉,副肝左动脉起自胃左动脉
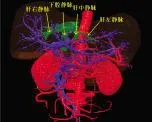
图6 肝脏CT三维重建影像模型 肝中静脉与肝左静脉共干后汇入下腔静脉
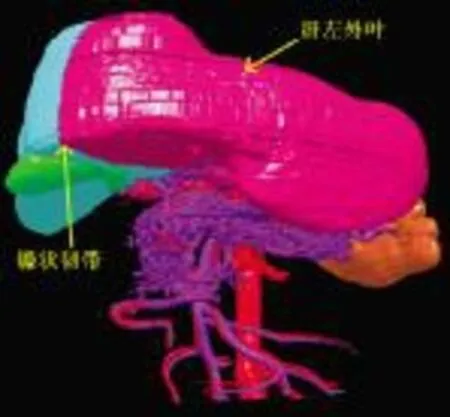
图7 肝脏CT三维重建影像模型 右肝明显萎缩,左肝代偿性增大
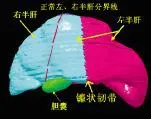
图8 肝脏CT三维重建影像模型 右肝明显萎缩,左肝代偿性增大
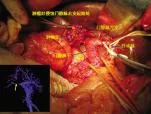
图9 手术术野 术中探查见,肿瘤灶侵蚀门静脉右支起始处
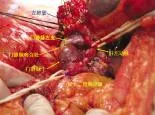
图10 手术术野 术中肝切除完毕,行门静脉右支切除并重建,将S2段与S3段胆管拼合成左肝管
3 讨论
影像学评估在HCCA术前评估中占有非常重要的地位[1-3],但CT和MRI评估方法常因为缺乏整体感和立体感,需要外科医生在大脑中进行“空间重建”,该过程常因不同医生的经验差异而产生不同程度的偏差[4-5]。同时,当前的“精准胆道外科”理念也需要通过三维重建技术将癌灶浸润范围和肝门部解剖精确标定在个体化肝脏三维构象中[6,7]。在HCCA诊断和治疗指南(2013版)推荐术前对肝脏、肝内脉管结构、病灶进行三维重建,以客观、全面、立体地再现肝脏脉管解剖结构、癌肿浸润范围、肿瘤与重要脉管结构的几何关系,以利于医生术前准确评估、制定恰当的手术预案。本组报道的典型患者,术前MRCP示肝门部胆管癌侵蚀右肝管及门静脉右支,初步评估无法达到RO手术切除。但通过CT三维重建后发现,肝脏左外叶明显增大,整个肝脏呈顺钟向转位。左外叶占全肝体积的61.6%,行右三肝切除术,患者残肝分数>50%,患者可以耐受手术。同时发现术中可于门静脉右支起始部横断切除受侵的门静脉,必要时可行门静脉左支与门静脉主干吻合。副肝右动脉起自肠系膜上动脉,副肝左动脉起自胃左动脉。肝中静脉与肝左静脉共干,在行扩大右半肝切除时,需保护肝左静脉及变异的肝动脉,避免损伤。因此,准确的术前可切除性评估既能保证有根治机会的患者不错失手术良机,又可以使无法根治性切除的患者避免不必要的手术探查,在一定程度上提高了HCCA的R0切除成功率。
大多HCCA患者需要合并肝切除术才能获得根治性切除[8],但因术前存在梗阻性黄疸和肝内转移灶导致肝功能较差。因此,术前需聚焦两个方面的问题:①联合肝切除术是否增加术后并发症发生率和手术风险,患者是否因此获益;②患者能否耐受肝切除手术,即术前需规划肝切除的范围及评估肝脏储备功能。第一,2015年胆管癌NCCN指南[9]指出,大范围肝切除有助于获得更高的R 0切除率,提高生存率。Nagino et al[10]检测HCCA组织发现门静脉和肝中动脉受侵犯的几率分别为88%和54%,故认为联合肝切除很有必要性。Vander Gaag et al[11]回顾性研究发现,联合肝切除能明显提高HCCA手术的R 0切除率和5 a生存率;第二,研究发现残肝体积不足和术前胆管炎是联合大范围肝切除治疗HCCA术后出现肝功能不全与肝功能衰竭的主要危险因素[12]。将残肝分数控制在50%,并有“计划性肝切除的治疗理念”。有人认为术前行门静脉栓塞术可以增加预保留肝叶的体积和肝脏储备功能。
国外多项研究提示联合受累门静脉切除重建可显著提高局部晚期HCCA根治性切除率和长期生存率。国内对受累门静脉切除重建的观点基本已达成共识,但对肝动脉切除重建仍存在争议。联合门静脉切除重建并未增加HCCA术后并发症发生率和病死率。

