电极材料制备及储能性能综合实验
田 文, 吉俊懿, 蒋 炜, 李 季
(四川大学 化学工程学院, 四川 成都 610065)
随着新型能源的快速发展,特别是风能、太阳能等分散型新型能源的开发利用,高性能能量存储设备的有效开发是实现新型能源有效利用的关键[1]。随着小型、可移动电子设备的高速发展,对容量高、体积小、性能稳定的新型储能电源的需求日益强烈。因此开发具有高储能密度、高稳定性的新型储能器件尤为重要[2]。小型化储能设备的发展方向以锂离子电池和超级电容器为主。其中电极材料作为设备储能容量和稳定性的决定性材料,其有效的开发利用是新型储能器件发展的关键,也受到了国内外研究人员的广泛关注[3-6]。作为一个具有长期发展前景和发展需求的重点领域,电极材料的开发与应用的是关乎国家经济发展和民生问题的关键领域[7-9]。
随着学生培养知识体系改革的开展,实验教学作为一种集知识体系与操作应用的综合性教学手段,已成为高校教学环节不可或缺的部分[10-12]。专业实验课的设计应向综合性创新实验和针对国家重大需求的研究领域倾斜,从本科生阶段开始在创新思维、设计能力等方面全方位提升学习思维能力[8]。为此,依托四川大学化学工程学院本科生专业实验平台,我们面向全体化学工程与工艺专业本科生开设了电极材料制备及储能性能综合性专业实验,使学生了解超级电容器储能设备的材料制备工艺和性能测试原理,引导学生加强对材料设计及性能强化的理解,锻炼学生对机理理解能力和对具体实验的操作能力。实验设计学时数为12学时。
1 实验仪器及药品
仪器:电子天平(德国赛多利斯),数显式恒温磁力搅拌器(IKA C-MAG HS4),水热反应釜(安徽科幂),鼓风式烘箱(上海一恒),三电极电解池(天津艾达恒晟),微量移液枪(北京大龙)及玛瑙研钵、烧杯、量筒等。
实验分析仪器:电化学工作站(上海辰华CHI 660E),扫描电子显微镜(SEM, JEOL JSM-7610F)。
药品:氢氧化钾(分析纯),六水合氯化镍(分析纯),尿素(分析纯),PTFE乳液浆料(60%固含量),导电炭黑(Sigma),无水乙醇(分析纯),去离子水(自制)。
2 实验基本流程
本实验基本实验流程见图1,包括电极纳米材料制备、浆料配制及电极制备和超级电容器性能测试。
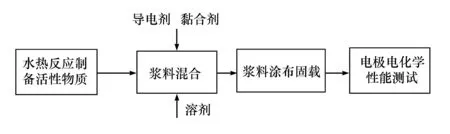
图1 实验基本实验流程
2.1 Ni(OH)2纳米花的制备
将六水氯化镍0.530 g和尿素 0.826 g分别加入200 mL去离子水中混合均匀,将混合溶液搅拌均匀后加入100 mL水热反应釜内,再将水热反应釜放入烘箱中180 ℃反应4 h。反应完成后在冷风条件下冷却2 h至常温后,用溶剂过滤器过滤,滤饼用大量去离子水洗涤,所得产品在60 ℃干燥过夜得到Ni(OH)2纳米花。用扫描电子显微镜观察Ni(OH)2纳米花形貌结构。
2.2 浆料配制及电极制备
用Ni(OH)2纳米花作为活性物质配置电极浆料,浆料配制按照活性物质、导电剂和黏合剂的质量比为75∶10∶15的比例配制。固体物料量取结束后转移至玛瑙研钵中,加入黏合剂后进一步加入一定量无水乙醇,进行研磨混合(本步骤需要尽量混合均匀,浆料配制优劣直接影响电极性能),混合过程中可根据浆料黏度进行无水乙醇的添加,保持浆料具有一定的黏度。持续研磨混合1 h后得到配制完成的浆料。
采用金属泡沫镍作为集流体,预先裁剪泡沫镍5片(尺寸1 cm×2 cm),精确称量每片泡沫镍的质量(用于计算活性物质负载量)。用刮刀将浆料均匀刮至泡沫镍表面,控制每片电极固体负载密度为1~2 mg/cm2,转移至真空干燥箱真空干燥2 h得到电极。
2.3 电极材料的电化学性能测试
称取上述电极片质量并计算活性物质负载质量。将电极片组装到三电极测试装置中,采用6 mol/L KOH为电解液。首先进行电极的活化,之后选取适宜的电压窗口测试电极循环伏安曲线(CV,10 mV/s,50 mV/s,100 mV/s),并测试不同电流密度条件下恒流充放电曲线(CC,电流密度3 A/g,5 A/g,10 A/g,30 A/g)。实验完成之后,拆除电极测试装置,倒掉电解液并清洗电解池及电极夹,将参比电极放入保护溶液中浸泡。
3 实验结果及分析
3.1 Ni(OH)2纳米花活性物质制备
Ni(OH)2具有良好的超级电容器储能容量,是一种典型的电极活性物质。与此同时,将Ni(OH)2进行纳米花设计,有利于电解液的浸润及导电性能的提升,从而提升活性物质利用效率。水热反应是一种良好的晶体结晶生长方式,具有较好的形貌可控性和结构稳定性,是当前常用的晶体可控生长方式。因此,本实验选用水热反应制备Ni(OH)2纳米花活性物质。如图2所示,水热合成的方法所制备的Ni(OH)2纳米花呈绿色粉末状,粉末经过研磨后具有良好的均匀性,是作为活性物质进行固定负载的良好材料。

图2 Ni(OH)2纳米花光学照片
Ni(OH)2纳米花的微观纳米结构通过扫描电子显微镜观察,如图3所示(上下图的放大倍数不同),A、B、C、 3组学生所制备的Ni(OH)2纳米花均为球形结构,纳米球内部则由无数细小的纳米片以交叉形式构成。该交叉片纳米花结构有利于电解液浸润进入Ni(OH)2纳米花内部,从而降低离子在活性物质内部迁移距离,提升活性物质在储能过程中的利用效率。球形Ni(OH)2纳米花结构有利于导电添加剂在制备电极过程中形成有效的导电网络,从而有效提高电子迁移至活性物质的效率,实现活性物质倍率性能的提升。扫描电镜操作由指导教师完成,教师在测试过程中深入分析活性物质纳米结构对储能性能的影响机制,使学生对电极活性物质的结构需求有了更加清楚的认识,对电极材料结构设计有了进一步的了解,并对所制备活性物质的储能性能有了初始的判断。
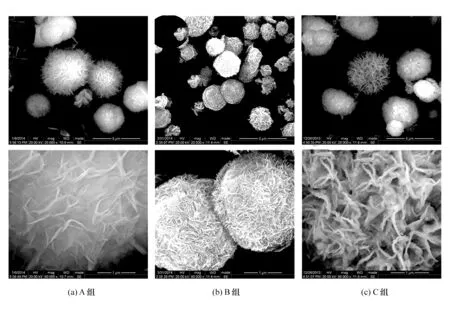
图3 Ni(OH)2纳米花扫描电子显微镜图
3.2 电极制备及电化学性能测试
Ni(OH)2纳米花活性物质与导电剂炭黑和黏合剂PTFE乳液混合均匀得到电极浆料后,用刮刀均匀涂覆于导电泡沫镍表面得到储能电极片。如图4所示,泡沫镍集流体呈多孔状结构,内部骨架相互交联形成交叉导电网络(左图),有利于表面负载活性物质的电子迁移。经过电极浆料涂覆干燥后,负载活性物质的电极从银色变为黑褐色(黑色为导电炭黑的颜色),证明了活性物质的成功负载。与此同时,可观察到大部分学生的电极片负载较为均匀,仅少数学生的电极片有大量活性物质团聚。均匀负载的活性物质有助于电子的快速迁移及电解液离子的浸润,对电极储能性能有积极的影响。

图4 Ni(OH)2纳米花活性物质涂布电极片光学照片
由于每组学生制备的Ni(OH)2纳米花微纳结构具有差异,同时浆料制备和电极涂覆手法均有区别,这些因素均会对电极储能性能产生影响,因此本部分选取两组样品电极测试结果进行分析。Ni(OH)2纳米花电极储能性能如图5(a)和(c)所示,Ni(OH)2纳米花电极在循环伏安测试中表现出了明显的氧化还原峰,这是由于在恒电压扫描的过程中,电极材料中的镍元素发生了氧化还原反应,即Ni3+和Ni2+相互转化,从而实现电子的储存及释放。由于活性物质根据物质不同,发生氧化还原反应的具体电压值不同,因此出现响应电流较强的氧化还原特征峰。与此同时,随着扫描速率的增大,电极相应电流增强,氧化还原特征峰也相应发生偏移。通过循环伏安曲线的测试,能够理解电极的储能机理,活性物质储能特征电压,从而为以下的恒流充放电曲线奠定基础。
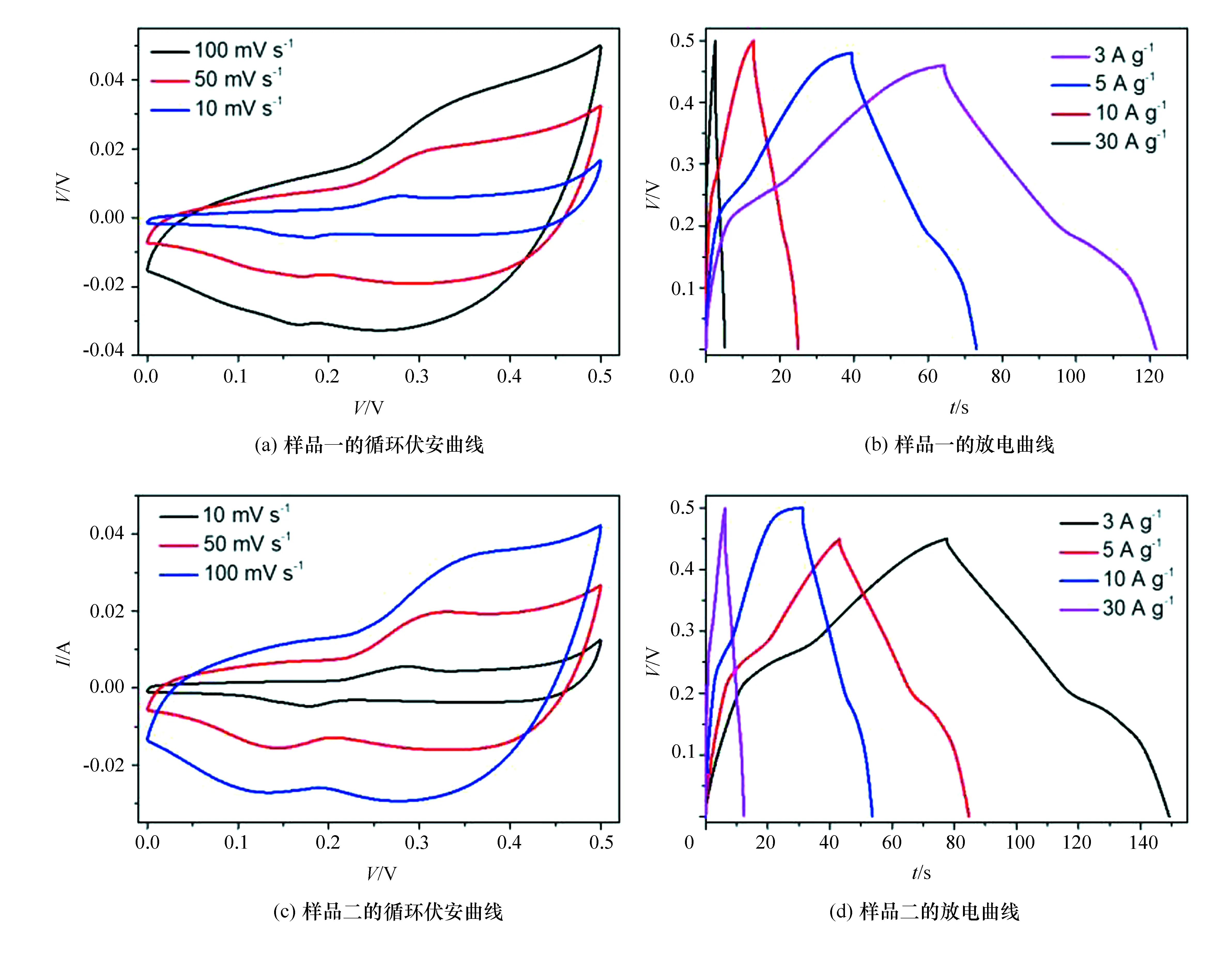
图5 Ni(OH)2电极电化学储能性能曲线
恒流充放电采用恒定电流对电极进行充电和放电,与储能设备的实际能量储存-释放方式更加接近,是常用来评估电极储能性能的方法。恒流充放电曲线如图5(b)和(d)所示,电极材料具有类三角形的充放电曲线,同时充电和放电过程各有一个平台,该平台对应于氧化还原特征峰。通过电极材料放电曲线,可以计算出电极材料在此电流密度下的储能容量。此外,超级电容器电极与锂离子电池电极的一个典型区别在于更高的倍率性能,即高电流密度条件下的快速充放电能力。因此,本实验设计了4个不同的充放电电流密度σ,重点使学生了解电极的倍率性能的机理及数据分析方式。
储能性能分析是本实验的关键,该分析过程有助于学生了解储能电极评价机制,掌握简单的电极储能性能计算方法,并通过与各组的性能横向对比实现对活性物质形貌结构-电极涂布均匀性-电极储能性能的系列评估。通过恒流充放电曲线计算超级电容器电极的储能容量C公式如下:
C/(F·g-1)=I·Δt/(m·V)
其中:m代表工作电极中活性物质的质量,g;I代表恒电流的大小,A;Δt为放电时间,s;V为放电电压,V。
如图6所示,在电流密度相同时,样品二具有更高的储能容量,该结果与图5中的放电曲线放电时间相符。2个电极的储能容量随电流密度的增加呈递减趋势,其中样品二在电流密度为30 A/g时的储能容量达到365 F/g,相对于3 A/g(747 F/g)时的储能容量留存率达到76.5%,体现出良好的倍率性能。样品一的倍率性能相对较差,这体现出样品制备和电极制备过程不同对储能容量的影响。
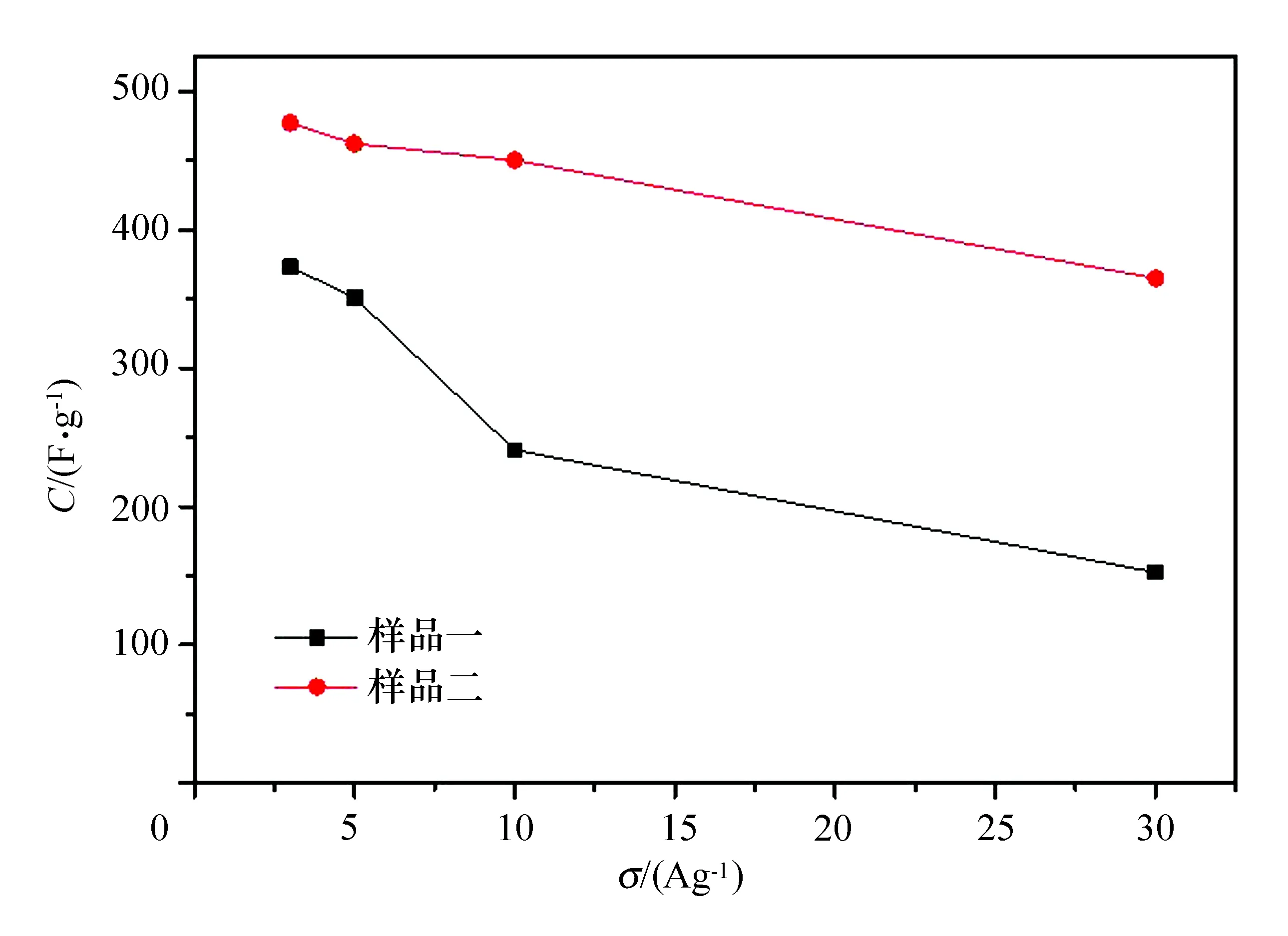
图6 两组学生的超级电容器电极倍率性能对比图
4 总结与展望
电极材料制备及储能性能综合实验结合了反应工程和化工原理基本理论知识,在实验过程中设置了反应、结晶、过滤等化工单元操作,形成了一个完整的材料制备与性能分析工艺流程,实验内容丰富,强化了学生的实际动手能力。其次,本实验通过纳米材料结构分析、材料制备形貌分析及储能性能分析,引导学生加强对材料设计与性能强化之间构效关系的理解,同时锻炼学生对机理理解能力和数据分析能力。本实验课程针对当前化学工程学科较为薄弱的电化学领域设计实验,在实验预习及实验过程中学生学习电化学相关知识,从而弥补专业设置方面的不足。通过扫描电子显微镜和电化学工作站的应用,使学生对大型仪器和电化学分析设备有了较深入的了解。

