蓝杆藻ATCC 51142中α-酮戊二酸脱羧酶的克隆与表达
谢琮琮, 许文武, 李至敏, 王小琴, 雷国风, 张 伟, 黄 婷, 李志敏
(1.江西农业大学生物科学与工程学院,江西南昌 330045; 2.江西农业大学理学院,江西南昌 330045)
蓝藻,别称蓝绿藻或蓝细菌,在藻类中是最简单、最原始的单细胞原核生物,也是目前发现的最早的光合释氧生物。蓝杆藻ATCC 51142是一种白天进行光合作用,夜间通过固氮作用产氢的固氮型蓝细菌[1]。由于在蓝藻基因组中没有检测到α-酮戊二酸脱氢酶基因[2-3],长期以来学术界一直认为蓝藻没有经典的三羧酸循环途径。2011年Zhang等研究发现,在聚球藻PCC7002中a2770和a2771基因分别编码α-酮戊二酸脱羧酶和琥珀酸半醛脱氢酶,这2个酶的存在使得蓝藻的三羧酸循环变得完整[4]。实际上,编码α-酮戊二酸脱羧酶和琥珀酸半醛脱氢酶的基因存在于除少数海洋蓝藻外的大多数蓝藻中[4]。
笔者所在研究组通过Blast序列分析,发现蓝杆藻ATCC 51142中cce4227基因与聚球藻PCC7002中a2770基因的同源性达到81.8%,与集胞藻PCC6803中sll1981基因的同源性为76%。同样,集胞藻PCC6803中sll1981基因编码蛋白已被证明具有α-酮戊二酸脱羧酶功能[5-6]。因此本研究推测cce4227蛋白也具有α-酮戊二酸脱羧酶的功能。
近年来生物合成可再生燃料的研究吸引了越来越多研究者的关注[7]。其中,引人注目的是Genomatica公司的研究人员报道了基因工程大肠杆菌利用琥珀酸半醛生物合成1,4-丁二醇[8]。然而通过基因工程蓝藻生物合成1,4-丁二醇的研究还未见报道。琥珀酸半醛正是α-酮戊二酸脱羧酶催化α-酮戊二酸非氧化脱羧生成的产物。因此对α-酮戊二酸脱羧酶开展研究将为未来利用蓝藻生物合成1,4-丁二醇提供理论基础。
本研究从蓝杆藻ATCC 51142基因组中扩增得到cce4227基因,将其连接到pET28a载体上构建得到pET28a-cce4227质粒。将该质粒与pTf16分子伴侣质粒共转化大肠杆菌BL21(DE3)感受态细胞后得到表达菌株。摇瓶培养表达菌株经阿拉伯糖和异丙基硫代半乳糖苷(IPTG)诱导后纯化得到cce4227重组蛋白。本研究为进一步阐明cce4227蛋白的催化功能及机制奠定了重要基础。
1 材料与方法
1.1 材料
1.1.1 菌株和载体 试验于2017年11月至2018年1月在江西农业大学生物科学与工程学院分子生物学实验室完成。
pTf16分子伴侣质粒、大肠杆菌BL21(DE3)感受态细胞、表达载体pET28a为笔者所在实验室保存;蓝杆藻ATCC 51142基因组购于美国模式菌种保藏中心。
1.1.2 工具酶和主要试剂 限制性内切酶NdeⅠ、XhoⅠ、T4DNA连接酶、5K DNA Marker购于北京全式金生物技术有限公司;Protein Marker购于Thermo Scientific公司;2×Taq(Pfu)、2×TaqMix、普通DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒均购于天根生化科技(北京)有限公司;镍离子亲和层析树脂(Ni-NTA)购于QIAGEN(凯杰)公司;所用引物由南京金斯瑞生物科技有限公司合成;质粒测序由上海祥音生物科技有限公司完成;其他主要试剂均购于北京索莱宝科技有限公司。
1.2 方法
1.2.1 目的基因的PCR扩增 以蓝杆藻ATCC 51142基因组为模板(1 μL,约30 ng),加入上下游引物各1 μL(表1),引物终浓度为0.2 μmol/L。加入2×Taq(Pfu)25 μL后加入灭菌水22 μL至总体积为50 μL。扩增反应条件:95 ℃预变性 3 min;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃延伸10 min。反应结束后于4 ℃保温。

表1 PCR引物序列
注:下划线部分为酶切位点。
1.2.2 pET28a-cce4227重组质粒的构建与鉴定 将PCR产物经1.5%琼脂糖凝胶电泳后回收,利用NdeⅠ和XhoⅠ双酶切回收片段。用同样的酶双酶切pET28a载体。将双酶切的基因片段cce4227和载体线性片段pET28a(基因片段与载体片段的物质的量之比为6 ∶1)在16 ℃金属浴恒温下用T4 DNA连接酶过夜连接。取连接产物10 μL转化大肠杆菌BL21(DE3)感受态(80 μL)后,用含有50 μg/mL卡那霉素的LB固体平板培养基筛选阳性克隆。将经菌落PCR验证正确的阳性克隆单菌落摇菌提取质粒后送检测序。
1.2.3 cce4227重组蛋白的诱导表达 将重组质粒pET28a-cce4227和pTf16分子伴侣质粒共转化BL21(DE3)感受态细胞(100 μL),涂布于含卡那霉素(50 μg/mL)和氯霉素(25 μg/mL)的双抗性LB固体平板培养基上,于37 ℃恒温箱内倒置过夜培养,将其克隆单菌落PCR验证为正确的阳性克隆菌进行诱导表达。将单克隆菌落加入10 mL含有卡那霉素(50 μg/mL)和氯霉素(25 μg/mL)的LB液体培养基中,于 37 ℃、180 r/min过夜培养。然后按0.5%接种量将过夜培养液加入1.2 L LB液体培养基(含有50 μg/mL卡那霉素、25 μg/mL 氯霉素和1 mg/mL阿拉伯糖)中进行菌体扩大培养。待培养液D600 nm为0.6时冰浴后加入IPTG(终浓度为 0.2 mmol/L)于16 ℃、180 r/min继续培养24 h。
1.2.4 cce4227重组蛋白的分离纯化 将离心所得菌体用20倍体积的平衡缓冲液(20 mmol/L Tris-HCl,pH值为8.0)重悬,于冰水浴中超声破碎32 min(超声工作2 s,间歇8 s,有效功率为10%)。菌体裂解液于4 ℃、12 000 r/min离心1 h得到菌体上清液,经0.22 μm滤膜过滤后,将上清过Ni-NTA树脂(事先用平衡缓冲液进行平衡处理),然后用含咪唑的平衡缓冲液进行浓度梯度洗脱,分别收集每个浓度的流出液,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测目的蛋白。合并含有目的蛋白的洗脱液后,于4 ℃采用透析袋进行浓缩透析。
2 结果与分析
2.1 pET28a-cce4227表达载体的构建与鉴定
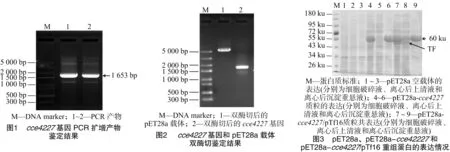
以蓝杆藻ATCC 51142基因组为模板,经PCR扩增、琼脂糖凝胶电泳后获得约1.7 kb大小的DNA条带,该基因片段与cce4227基因理论碱基数(1 653 bp)相吻合(图1)。将双酶切后的cce4227基因片段和pET28a载体线性片段(图2)经T4 DNA连接酶过夜连接后转化大肠杆菌BL21(DE3)感受态细胞,挑取阳性克隆摇菌后提取质粒。将该质粒进行DNA测序,测序结果表明,该基因序列与National Center for Biotechnology Information(美国国立生物技术信息中心)数据库中的cce4227基因序列完全一致。因此可见,本试验成功构建了pET28a-cce4227表达载体。
2.2 cce4227重组蛋白的诱导表达
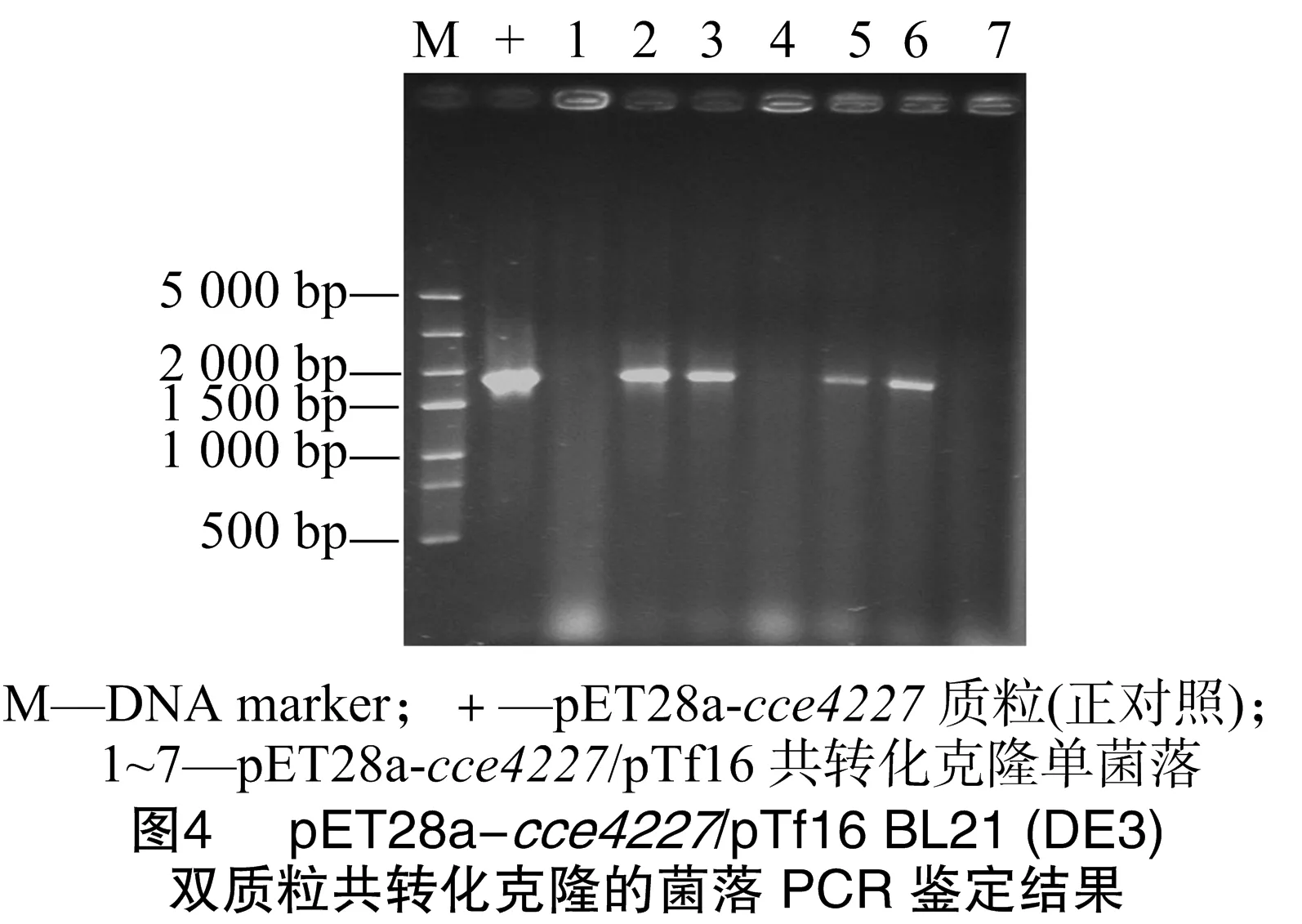
将pET28a-cce4227表达质粒转化大肠杆菌BL21(DE3)感受态细胞,摇瓶培养菌液后经IPTG(0.2 mmol/L)诱导发现cce4227重组蛋白为包涵体,在上清液中没有可见的cce4227重组蛋白(图3)。因此本试验将pET28a-cce4227质粒和pTf16分子伴侣质粒共转化大肠杆菌BL21(DE3)感受态细胞。菌落PCR研究发现,pET28a-cce4227质粒成功转化至大肠杆菌BL21(DE3)感受态细胞,即构建成功pET28a-cce4227/pTf16 BL21(DE3)(图4中2、3、5、6条带片段大小与cce4227基因片段大小相符合)。挑取图4中2号单克隆菌落摇菌培养。结果发现,pTf16分子伴侣质粒的共表达明显增加了cce4227蛋白的可溶性(图3)。cce4227基因的碱基数为1 653 bp,编码1个含有550个氨基酸残基的蛋白质,其分子量为59.91 ku,与图3中大小约为60 ku的条带一致。
2.3 pET28a-cce4227/pTf16重组蛋白的分离纯化
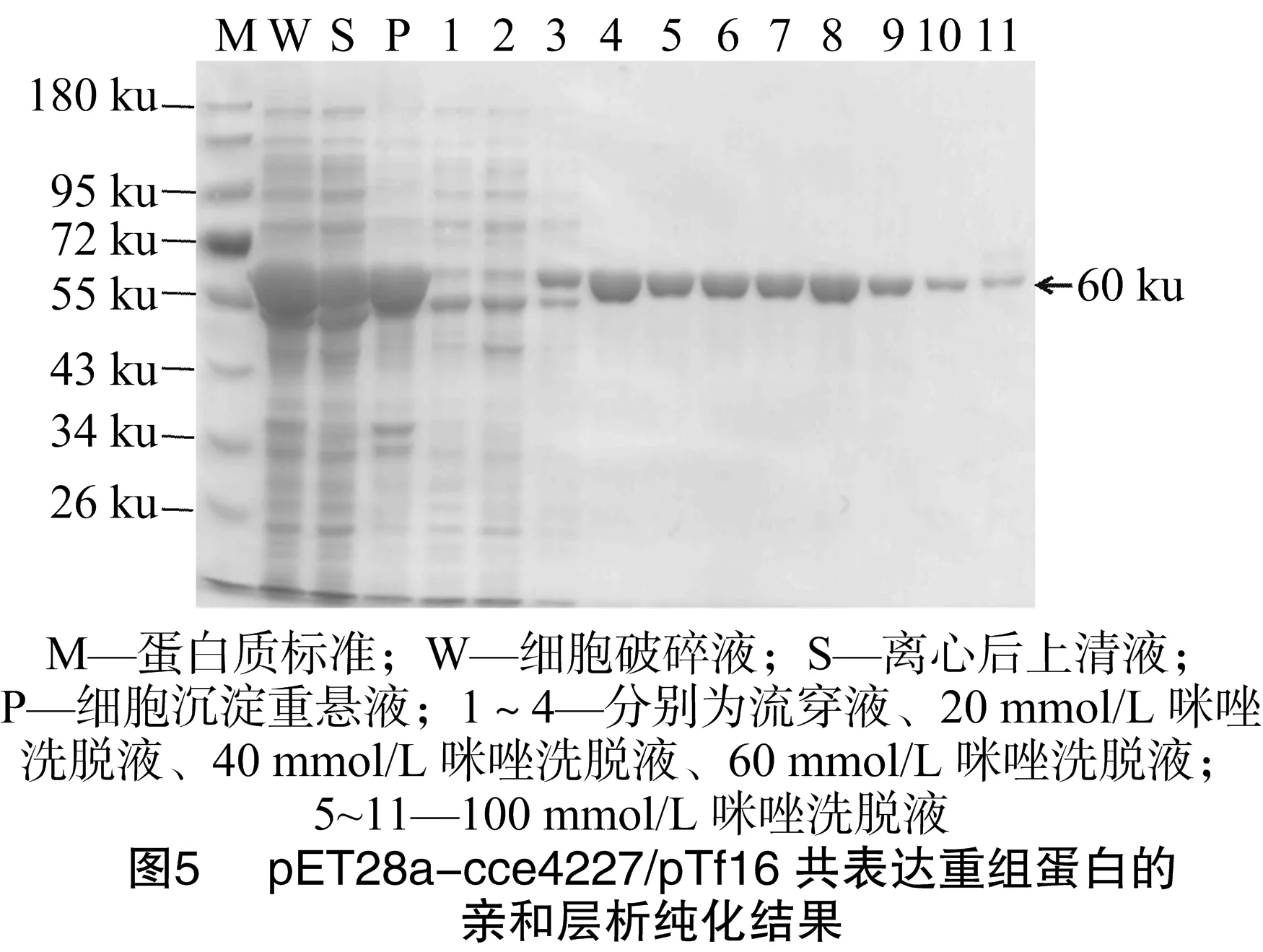
将含有目的蛋白的上清液用Ni-NTA亲和层析柱纯化。用含有20~200 mmol/L咪唑的缓冲液(20 mmol/L Tris-HCl,pH值为8.0)进行洗脱(图5)。由于pTf16分子伴侣质粒表达的促发因子(trigger factor,简称TF)蛋白没有组氨酸标签,不能被Ni-NTA吸附。当咪唑浓度增加到40 mmol/L时,TF蛋白基本被洗脱,此时有少量cce4227重组蛋白被洗脱。当咪唑浓度提高到60 mmol/L时,大量cce4227重组蛋白被洗脱。然后用含有100 mmol/L咪唑的缓冲液将cce4227重组蛋白全部洗脱。合并图5中含有cce4227重组蛋白的洗脱液后浓缩脱盐,得到纯度>95%的cce4227重组蛋白。菌体蛋白收率约为 12 mg/g 。
3 讨论
本研究通过Blast序列分析发现,蓝杆藻ATCC 51142中cce4227基因与集胞藻PCC6803中sll1981基因的同源性为76%[6],与鱼腥藻PCC7120中all3555基因的同源性为74%;蓝杆藻ATCC 51142中cce4228基因与聚球藻PCC7002中a2771基因的同源性为68%,与鱼腥藻PCC7120中all3556基因的同源性为71%[9-10]。重要的是蓝杆藻ATCC 51142中cce4227蛋白与集胞藻PCC6803中sll1981蛋白的氨基酸序列同源性达86%,且sll1981蛋白已经被证实具有α-酮戊二酸脱羧酶的功能[5],因此推测cce4227蛋白也具有α-酮戊二酸脱羧酶的功能。
本研究通过常规PCR技术从蓝杆藻ATCC 51142基因组中成功克隆到cce4227基因,然后将其连接到pET-28a载体后转化大肠杆菌BL21(DE3)感受态细胞,阳性单克隆菌落经测序正确后得到蛋白表达质粒pET28a-cce4227。虽然该表达菌株中cce4227重组蛋白的表达效果较好,但是其在上清液中的含量较低,大部分为包涵体蛋白。因此,将pET28a-cce4227质粒与pTf16分子伴侣质粒共转化大肠杆菌BL21(DE3)感受态细胞。研究发现,与分子伴侣蛋白(TF蛋白)共表达时,cce4227重组蛋白的可溶性得到提高,在上清液中有明显可见的cce4227蛋白。经摇瓶培养后通过Ni-NTA亲和层析方法获得纯度较高的cce4227蛋白,菌体蛋白收率达到12 mg/g。SDS-PAGE测得的cce4227蛋白分子量约为 60 ku,与cce4227蛋白的理论分子量(59.91 ku)比较接近。
笔者所在实验室已有的试验数据表明,在焦磷酸硫胺素作辅因子时,cce4227蛋白可以催化α-酮戊二酸转化为琥珀酸半醛。当用pH值为7.5、浓度为100 mmol/L的HEPES(4-羟乙基哌嗪乙磺酸)缓冲液时,cce4227蛋白对α-酮戊二酸的Km(米氏常数)为1.21 mmol/L,kcat(催化常数)为1.16 s。后续研究将对cce4227蛋白的详细酶动力学参数及结构功能关系作进一步测定。

