辛伐他汀抑制脓毒症小鼠肠损伤和细胞间粘附分子-1与髓过氧化物酶上调
张荣,孔冰冰,杨文萍,赵欣,王煜*
(1中国医科大学附属盛京医院急诊科,沈阳 110004;2北京清华长庚医院急诊科,北京102200;3沈阳医学院附属中心医院重症医学科,沈阳110075;4赤峰市医院急诊科,赤峰024000)
脓毒症是机体对于感染的反应失控所致的威胁生命的器官衰竭,每年有数十万人因脓毒症死亡。经过数十年的深入研究,脓毒症的基本机制仍未完全阐明[1-2]。在脓毒症的发生和进展过程中,肠损伤发挥重要作用。肠屏障在健康的维持和危重症时病理生理方面具有极其重要的作用[3]。脓毒症时,在TNF-α等炎症因子作用下,肠黏膜上皮紧密连接完整性改变,肠黏膜屏障受损,通透性增加,导致肠道菌群移位。同时,肠道菌群的移位可进一步加重脓毒症,二者呈恶性循环,相互促进,放大炎症损伤。因此,研究探讨减轻脓毒症肠损伤对治疗脓毒症有重要意义。肠黏膜屏障损伤的时候,细菌及细菌的代谢产物得以穿透屏障进入机体,进而活化免疫细胞,产生促炎因子和趋化蛋白,升高细胞间粘附分子 -1(intercellular adhesion molecule, ICAM-1)水平。在炎性反应初期,ICAM-1是白细胞募集的要素,可增强白细胞与内皮细胞粘附,使白细胞更易于穿透内皮屏障,加重组织炎症损伤。组织髓过氧化物酶(myeloperoxidase, MPO)活性可以反映组织中中性粒细胞水平[4]。有研究表明,他汀类药物可改善脓毒症30d存活率[5]。他汀类药物除降脂外,还能起到抗炎、调节免疫、稳定内皮等作用,抑制炎症反应,降低脓毒症时肠粘膜通透性,改善脓毒症预后,对脓毒症肠道损伤起保护作用[6]。因此,本研究拟通过盲肠结扎穿孔(CLP)法建立脓毒症小鼠模型,通过腹腔注射辛伐他汀进行干预,研究辛伐他汀对脓毒症导致的肠损伤的保护作用及可能的机制。
材料与方法
1 实验动物与分组
选用成年雄性小鼠(健康SPF级C57BL/6)72只,体重约为25~35g。研究动物来源于中国医科大学附属盛京医院本溪基地动物实验中心[SCXK(京)2014-0004]。饲养在温度为20℃-25℃、湿度为20%~30% 、光暗各12h 的屏障系统内。将小鼠随机分为3组(24只/组):SEP组(脓毒症组)、SIM组(脓毒症辛伐他汀治疗组)、Sham组(假手术组)。分别于造模前一周开始进行预处理:给予SIM组小鼠辛伐他汀0.2µg/ g(由辛伐他汀5mg+0.5ml无水乙醇+生理盐水500ml配成), 间隔12h,腹腔注射1周;SEP组及Sham组给予安慰剂0.02ml/g(无水乙醇:生理盐水=1∶1000配制),每12h腹腔注射,共处理1周。
2 脓毒症小鼠模型制作
采用盲肠结扎穿孔(CLP)法进行造模[7]:5%水合氯醛行腹腔注射来麻醉小鼠,按照0.6ml/100g体重的剂量实施麻醉,对麻醉深度进行测试,钳夹小鼠指尖时小鼠四肢无屈曲等反应为满意。将麻醉满意的小鼠于鼠板上固定,剃毛并消毒。在下腹部正中沿腹白线做1cm纵行切口,显露盲肠,取盲肠中点处用5-0缝线结扎,小心避开肠系膜血管及回盲瓣。用18号针头取盲端和结扎处的中点贯穿盲肠,贯穿方向为自肠系膜侧无血管处向非肠系膜侧,小心避开肠系膜血管。拔出针头,自穿刺点挤出少量肠内容物,还纳肠管。5-0的缝线做缝合关腹。Sham组实验小鼠跳过盲肠结扎穿孔步骤,余操作和SEP组相同。手术后小鼠需补充术中失液,于背侧颈部皮下注入37℃生理盐水(0.05-0.1ml/g)。为避免术后体温过低,予手术小鼠烤灯照射。小鼠苏醒后,继续在温度为20℃~25℃,光暗各12h环境饲养,自由饮水,提供标准啮齿类动物饲料。
3 腹腔感染程度评估及样品采集
分别于造模后的12h和24h,用5%水合氯醛麻醉小鼠,按0.6ml/100g体重行腹腔注射,仰卧位固定麻醉后小鼠。此时腹部消毒,暴露盲肠,评估小鼠腹腔感染程度,距盲肠5cm处无菌切除小肠组织,用冰盐水冲洗切除的小肠组织,一半固定于4%多聚甲醛溶液中,另一半保存在-80℃超低温冰箱中。小鼠腹腔感染的评估参考Simon 腹腔感染分级标准(表1)[8]。
4 HE 染色及小肠组织病理学变化观察
取4%多聚甲醛中固定的小肠组织,用刀片切取组织,流水冲洗干净后放入包埋盒中,分别标记,依次进行脱水、透明、石蜡包埋、切片(厚度3μm)和HE染色,中性树脂封片,显微镜观察。 病理评分参考Chiu 评分标准[9]。
5 ICAM-1和MPO浓度ELISA测定
取肠组织100mg用眼科剪迅速剪碎后玻璃匀浆管中匀浆。将制备好的匀浆以3000r/min离心10min,留取上清应用ICAM-1和MPO ELISA试剂盒(ICAM-1:BOSTER,EK0371;MPO:BOSTER,EK0943)测定ICAM-1和MPO浓度。ELISA测定按说明书详细步骤进行操作,在450nm用酶标仪测定OD值(光密度值),根据得出的标准曲线,计算肠组织匀浆中ICAM-1和MPO浓度。
6 统计学分析
采用SPSS22.0 统计软件进行分析。计量资料以均数±标准差(¯x±s)表示,组间比较采用单因素方差分析,多重比较采用LSD-t检验,P< 0.05 为差异有统计学意义。
结 果
1 模型动物一般状态及腹腔感染情况
造模后,Sham组小鼠苏醒用时最短,短时间内恢复日常饮水及进食,正常活动; SEP组小鼠进食量显著降低,呼吸频率加快,神志为嗜睡状态,精神萎靡,伴有寒战、竖毛、口角及眼角的分泌物增多表现,保护性反射减弱。随着病情进展,症状逐渐加重,并出现血尿、脓尿、腹泻等表现;SIM组小鼠活动减少,呼吸略急促,神志表现为嗜睡状态。
解剖发现:SEP组小鼠腹腔中有大量血性渗出物,伴有恶臭味,肠蠕动减慢,小肠肿涨,结扎端盲肠肿胀更为显著,并存在坏死、粘连,腹腔内其他脏器亦可见充血水肿;SIM组小鼠肠管轻度扩张,提示造模成功。
根据Simon分级法评估腹腔感染情况,SEP组小鼠为3~4 级,SIM组小鼠为2~3 级,Sham组小鼠为0级。
盲肠结扎穿孔法造模小鼠24h存活率为83.3%。
2 辛伐他汀减轻脓毒症肠组织病理学损害
HE染色观察发现,Sham组小肠绒毛排列整齐,黏膜形态基本正常,Sham 12h和Sham 24h肠组织病理表现无显著差异;SEP 组肠壁变薄,上皮坏死脱落,绒毛结构模糊,大量炎细胞浸润,SEP24h损害更加明显;SIM组肠壁结构部分破坏,轻度黏膜水肿及少量炎细胞浸润,较SEP组相同观察点比较组织损伤减轻(图1)。根据Chiu 评分标准,Sham组评分在0~1分,SEP组评分在3~5分,SIM组评分在2~4分(图2)。
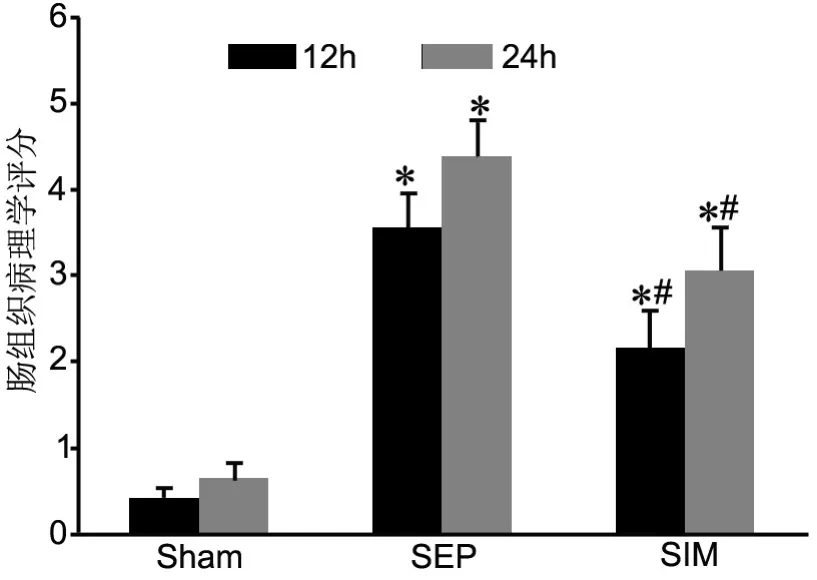
图2 辛伐他汀对脓毒症肠组织HE染色病理评分的影响。*,与Sham组比较,P<0.01,P<0.05;#,与SEP组比较,P<0.01;n=10Fig. 2 Effect of simvastatin on HE staining pathological scores of the intestine tissues with sepsis. *, compared with Sham group, P<0.01, #,compared with SEP group, P <0.01; n=10
3 辛伐他汀抑制脓毒症肠组织中ICAM-1和MPO含量的升高
ELISA检测显示,SEP组肠组织中ICAM-1和MPO含量在12h和24h均较Sham组显著升高,24h升高更加明显;腹腔注射辛伐他汀对脓毒症所致肠组织中ICAM-1和MPO含量升高具有明显的抑制作用:SIM组肠组织中ICAM-1和MPO含量明显低于SEP组,但仍高于Sham组(表1)。
讨 论
在脓毒症的产生及发展过程中,肠道的病理生理改变起到重要作用[10]。脓毒症时,肠道不仅是受到损害的主要器官,还是能加重脓毒症反应的器官[11]。正常情况下,肠黏膜屏障可以阻止微生物等进入体内,同时可以防止水和电解质的丢失,进行人体和环境之间的分子交换。因此,完整的肠黏膜屏障是必不可少的,它可以防止肠源性疾病,同时能够保证身体营养供给[12-13]。脓毒症时,肠道内环境平衡失调,炎症因子及产物增加,肠黏膜屏障受损,改变肠道通透性,肠道细菌等穿透肠黏膜上皮,肠道菌群的移位导致肠源性感染,使脓毒症进一步加重,甚至进展为多器官功能衰竭[14]。
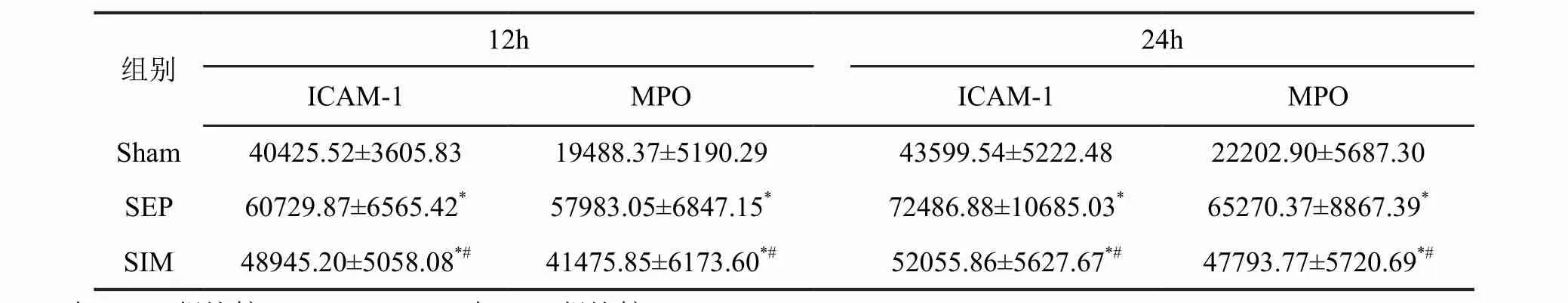
表1 辛伐他汀对脓毒症肠组织中ICAM-1和MPO含量(pg/ml)影响的统计学分析Tab.1 Statistical analysis of simvastatin’s effect on the contents (pg/ml) of ICAM-1 and MPO in the intestine tissues of mice with sepsis
目前认为,过度激活的全身炎症反应可使脓毒症进展恶化。多种炎症介质可激活中性粒细胞(PMN),激活的PMN聚集于肠黏膜,释放溶酶体酶,破坏血管和组织,引起“呼吸爆发”,可显著放大组织损伤。白细胞在肠道微血管中的迁移和募集和肠道的炎症损伤联系紧密,是造成组织损伤的终末环节[15]。
ICAM-1是黏附分子中IGSF(免疫球蛋白超家族)中的一员,低表达于呈静息状态的白细胞和内皮细胞。脓毒症时,在炎症因子(如TNF-α)的作用下,白细胞上ICAM-1的表达快速上调,结合于内皮细胞表面上的特异性受体,发挥生物学活性[16-17]。ICAM-1与特异性受体的结合,可影响白细胞等与内皮细胞之间的粘附程度,使其粘附作用增强,活化内皮细胞,使其更易穿透内皮屏障转移到损伤或炎症部位。内皮细胞上的细胞间黏附分子能够介导细胞之间及其和细胞外基质之间的接触与结合,参与炎症反应及免疫应答等病理生理过程[18-19]。脓毒症时,位于内皮细胞表面的E-选择素、L-选择素及P-选择素在活化的内皮细胞上表达增多,同时黏蛋白表达增多,促进白细胞沿着内皮层滚动,作为白细胞粘附的前奏。选择素可与糖类相结合,使白细胞重复的黏附、脱离。在这个过程中,来自内皮或间质释放的趋化因子使得白细胞表面Mac-1等整合素亲和力增大,激活白细胞黏附活性,使其更容易地和ICAM-1,ICAM-2,VCAM-1 等黏附分子结合,使白细胞能够更牢固的粘附于内皮细胞,为它们进入内皮下参加生理病理过程提供了基础[20]。脓毒症时,ICAM-1血清及组织浓度显著增加,可能成为脓毒症早期诊断指标之一[21]。高水平的ICAM-1与多器官衰竭发生有关[22]。van Griensven 等的研究发现ICAM-l 基因敲除的小鼠在脓毒症中白细胞组织浸润减少,器官损伤减轻,死亡率下降[23]。
MPO是一种糖蛋白,由PMN、单核细胞和某些组织的巨噬细胞分泌,是血红素过氧化物酶超家族成员之一。MPO是中性粒细胞的功能标志和激活标志。炎症发生后, PMN被激活后,MPO通过脱颗粒作用被释放到胞外或吞噬小体内,催化H2O2生成具有强氧化作用的活性氧分子,这些活性氧分子同时有细胞毒作用, 可杀伤细菌微生物。MPO、H2O2及卤族元素离子可组成一个杀菌系统,三者反应可生成次卤酸,其中次氯酸可通过与氨基基团反应来生成氯胺。脓毒症时,氯胺作用于球蛋白,使免疫蛋白激活,上调机体免疫反应。MPO还可以通过活化NF-κB等信号通路,使细胞因子及粘附分子增多,使白细胞更容易的穿透内皮屏障,到达炎症组织,促进炎症反应。组织中MPO活性高低基本上可反映PMN数量,同时也可反应其激活程度[24]。
新近的研究表明他汀类除降脂外,还能起到抗炎、调节免疫、稳定内皮等作用。他汀类药物可以抑制促炎细胞因子(TNF-α, IL-6等)的生成和分泌,促进抗炎细胞因子(IL-10等)的释放,同时可以抑制趋化因子释放,抑制炎症进展[25]。他汀类药物有助于血管内皮完整性的维持,同时能够降低血管通透性、减轻组织水肿[26],抑制白细胞和内皮细胞之间的互相作用,抑制白细胞激活、募集和迁移至组织,阻止炎症级联反应来减轻肠道病理损伤,发挥对脓毒症肠损伤的保护作用[27]。
本实验通过CLP 造模,观察脓毒症小鼠肠组织ICAM-1、MPO浓度发现, 与Sham组相比, SEP组小鼠肠组织ICAM-1及MPO的浓度在CLP 术后12h均明显升高, 术后24h浓度更高。与SEP组相比,SIM组肠组织ICAM-1及MPO浓度在CLP术后12h、24h均降低, 表明辛伐他汀可以抑制脓毒症肠组织中中性粒细胞聚集,下调ICAM-1水平。光镜下所见SEP 组肠壁变薄,绒毛结构模糊,上皮坏死脱落,大量中炎细胞浸润,SEP24h损害更加明显;SIM组肠壁结构部分破坏,轻度黏膜水肿及少量炎细胞浸润,较SEP组相同观察点比较组织损伤减轻。提示辛伐他汀可减少由脓毒症导致的肠黏膜水肿及炎症细胞浸润,对脓毒症肠损伤起保护作用。

