苦参碱调控结肠癌奥沙利铂耐药性及机制研究
王伟,郑兵,任锐,朱涛
(四川省宜宾市第一人民医院,普外科, 四川 宜宾 644000)
结肠癌是临床上常见的消化道疾病之一,临床上主要采用手术与化疗联合治疗,但患者的长期生存率较低,且有时不能完全治愈,甚至化疗药物的耐药性问题也随着出现,这是临床上结肠癌治疗失败的主要原因之一[1-2],故研究结肠癌化疗耐药性尤为重要。研究显示[3-6],肿瘤对化疗药物多药耐药是影响结肠癌化疗疗效的主要因素,耐药基因MDR1编码调控P-糖蛋白(glycoprotein, P-gp),结肠癌细胞高表达P-gp是影响治疗效果的主要障碍之一。众多研究表明[7-9],JNK/SAPK信号通路与肿瘤细胞的化疗耐药性密切相关,本研究将探讨苦参碱(matrine, Ma)对人结肠癌耐奥沙利铂细胞株(SW480/Oxa)耐药性的影响及是否与JNK/SAPK信号通路有关。
1 材料与方法
1.1 材料
结肠癌SW480细胞购自购自中科院上海细胞库,环王巴明、二甲基亚砜(dimethylsulfoxide, DMSO)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium, MTT)均购自Sigma公司,RPMI 1640培养基、胎牛血清、胰蛋白酶均购自Gibco公司,Annexin-V-FITC/PI凋亡试剂盒购自南京生物建成研究所,P-gp、c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)、磷酸化c-Jun氨基端激酶(phosphorylated c-Jun N-terminal kinase, p-JNK)、c-Jun、 磷 酸 化 c-Jun(phosphorylated c-Jun, p-c-Jun)抗体购自Abcam公司,过氧化物酶增殖物激活受体γ(peroxisome proliferator activated receptor gamma, PPARγ)和JNK阻断剂 SP600125均购自美国R&D Systems公司,Trizol试剂盒、逆转录试剂盒、PCR扩增试剂盒均购自日本TaKaRa公司,TGL-16G-A型高速冷冻离心机(上海安亭科学仪器厂),7300型实时荧光定量PCR(qRT-PCR)仪(美国Applied Biosystems公司),基础电泳仪(美国Bio-Rad公司),酶标仪(Thermo公司),EL204-电子天平(上海特勒-托多利多仪器有限公司),凝胶成像仪(美国Bio-Rad公司),电泳仪(北京六一仪器厂)。
1.2 方法
1.2.1 细胞培养 结肠癌SW480细胞,采用RPMI 1640培养液[添加10%FBS,1%双抗(链霉素100 u/ml,青霉素 100 u/ml)],置于 5% 二氧化碳 CO2,37℃的培养箱条件下进行培养。
1.2.2 获得性Oxa耐药结肠癌SW480细胞的建立 按照文献[10],首先,采用0.1 μmol/L的奥沙利铂(oxaliplatin, Oxa)处理SW480细胞,Oxa处理后大部分细胞死亡,少量细胞存活,待存活细胞继续生长到融合度达90%时,进行传代3代,之后提高浓度至0.5 μmol/L的Oxa处理SW480细胞,以此方法再提高到1.0 μmol/L的Oxa处理SW480细胞,最终获得临床血药浓度2.0 μmol/L,传代5代,稳定的耐药细胞SW480/Oxa细胞。
1.2.3 MTT法检测Ma给药浓度 为选择合适的Ma浓度进行后续实验,首先采用MTT法检测Ma对SW480/Oxa耐药细胞的IC50值。取对数生长期的细胞,以2×104个/孔接种于96孔培养板中,37℃、5%CO2培养箱中培养24 h贴壁后,分组进行实验。加入终浓度分别为 0、1、5、10、20 及 30 μmol/L 的 Ma(含DMSO的终浓度为0.1%);溶剂对照组调整DMSO的终浓度为0.1%;空白对照组不做任何处理。继续培养24 h。每孔加20 μl MTT,37℃孵育4 h,弃上清,再加入100 μl DMSO溶液,在酶标仪上测定570 nm波长各孔吸光度A值(A570)。细胞抑制率(IR):IR(%)=(1-处理组平均A值/对照组平均A值)×100%。
1.2.4 MTT法检测细胞增殖 取对数生长期的SW480/Oxa细胞,以2×104个/孔接种于96孔培养板中,37℃、5% CO2培养箱中培养24 h贴壁后,分组与给药:①NC组:空白对照组(细胞不做任何处理);②Oxa组:Oxa(2 μmol/L);③Ma+Oxa组:Ma(10 μmol/L)+Oxa(2 μmol/L)。继续培养24 h。每孔加 20 μl MTT,37℃孵育4 h,弃上清,再加入100μl DMSO溶液,在酶标仪上测定570 nm波长各孔吸光度A值(A570)。每组设置3个复孔。细胞抑制率(IR):IR(%)=(1-处理组平均A值/对照组平均A值)×100%。
1.2.5 流式细胞仪检测细胞凋亡情况 取对数生长期的细胞,以5×103个/ml接种于6孔板,每组设置3个复孔。用含10%胎牛血清的RPMl l640培养基培养在37℃、5% CO2培养箱中培养24 h至贴壁,实验分组与给药同1.2.4项下,根据Annexin-V-FITC/PI凋亡试剂盒说明书操作,流氏细胞仪检测细胞凋亡情况。
1.2.6 qRT-PCR检 测P-gp、MDR1 mRNA表 达水平 参照文献[11],检测P-gp、MDR1 mRNA。取对数生长期的细胞,以5×103个/ml浓度接种于6孔板,每组设置3个复孔。用含10%胎牛血清的RPMI 1640培养基培养在37℃、5% CO2培养箱中培养24 h至贴壁,实验分组与给药:①NC组:空白对照组(细胞不做任何处理);② Oxa组:Oxa(2 μmol/L);③ Ma+Oxa 组 :Ma(10 μmol/L)+Oxa(2 μmol/L);④ PPARγ+Oxa组:PPARγ(0.1 μg/L)+Oxa(2 μmol/L);⑤ SP600125+Oxa 组:SP600125(100 μg/L)+Oxa(2 μmol/L);⑥ PPARγ+Ma+Oxa组:PPARγ(0.1 μg/L)+Ma(10 μmol/L)+Oxa(2 μmol/L);⑦ SP600125+Ma+Oxa组:SP600125(100μg/L)+Ma(10 μmol/L)+Oxa(2 μmol/L)。根据 Trizol试剂盒提取组织总RNA,采用核酸测定仪测定RNA纯度和浓度,取1 μg进行逆转录,生成cDNA。采用SYBR green染料法进行定量检测,P-gp扩增引物序列为:P-gp,正向 5'-TACTCACGCCTCGAAACCT-3',反向 5'-GTCTGCTTTCCTCCCTGATG-3';MDR1,正向5'-CCC ATCATTGCAATAGCAGG-3',反向5'-GTTCAAACTTC TGCTCCTGA。以GAPDH基因为内参,其引物序列如下:GAPDH,正向5'-CCTAGTTCGTCATGGGTG TGAACCA-3',反向5'-GCCAGTAGAGGCAGGGATGA TGTTC-3',扩增条件及计算方法参考文献[12]。
1.2.7 Western blot检测P-gp、p-JNK蛋白的表达水平 参照文献[13]。取对数生长期的细胞,以5×103个/ml浓度接种于6孔板,每组设置3个复孔。用含10%胎牛血清的RPMl 1640培养基培养在37℃、5%CO2培养箱中培养24 h至贴壁,实验分组与给药同1.2.6项下。常规方法提取组织总蛋白,二喹啉甲酸(bicinchoninic acid, BCA)方法测定蛋白质含量后,进行凝胶电泳,每孔上样20 μg,电转至聚偏氟乙烯薄膜(polyvinylidene fluoride, PVDF)上后,3%的脱脂奶封闭2 h,分别孵育P-gp、p-JNK(目的蛋白)和β-actin(内参蛋白)一抗,4℃孵育过夜,TBST洗膜,孵育二抗后显影。采用Quantityone软件对条带亮度进行分析。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Ma的给药浓度
Ma对SW480/Oxa细胞的IC50浓度为30 μmol/L。考虑到Ma与Oxa对癌细胞可能存在协同杀伤癌作用,并且为尽量减轻高浓度药物引发的毒副作用,选择IC50前一浓度作为Ma浓度进行后续实验,即选择20 μmol/L作为后续实验Ma的给药浓度。见图1。

图1 MTT法检测Ma给药浓度
2.2 细胞增殖活性情况
NC组、Oxa组和Ma+Oxa组细胞增殖活性分别为(99.67±2.12)、(72.12±1.12)和(61.34±1.15),差异有统计学意义(F=12.218,P=0.000)。进一步分析显示,Oxa组细胞增殖活性低于NC组,差异有统计学意义(P<0.05)。而Ma+Oxa组细胞增殖活性低于Oxa组,差异有统计学意义(P<0.05)。
2.3 细胞凋亡情况
Oxa组与NC组细胞总凋亡率比较,采用t检验,差异有统计学意义(t=4.012,P=0.049),Oxa组细胞总凋亡率高于NC组。Ma+Oxa组与Oxa组细胞总凋亡率比较,采用t检验,差异有统计学意义(t=4.342,P=0.043),Ma+Oxa组细胞总凋亡率高于Oxa组。见图2。
2.4 Ma对SW480/Oxa细胞P-gp、MDR1 mRNA表达的影响
研究发现,在Ma+Oxa组、PPARγ+Oxa组及PPARγ+Ma+Oxa组 3组 间 的 P-gp mRNA(F=14.315,P=0.000)以及 MDR1 mRNA(F=16.267,P=0.000)的相对表达水平差异有统计学意义。见表1。在Ma+Oxa组、SP600125+Oxa组以及SP600125+Ma+Oxa组3组间的P-gp mRNA(F=13.213,P=0.000)以及 MDR1 mRNA(F=15.221,P=0.000)的相对表达水平差异有统计学意义。

图2 流式细胞仪检测细胞凋亡情况
表1 Ma对SW480/Oxa细胞P-gp、MDR1 mRNA表达的影响 (n =3,±s)
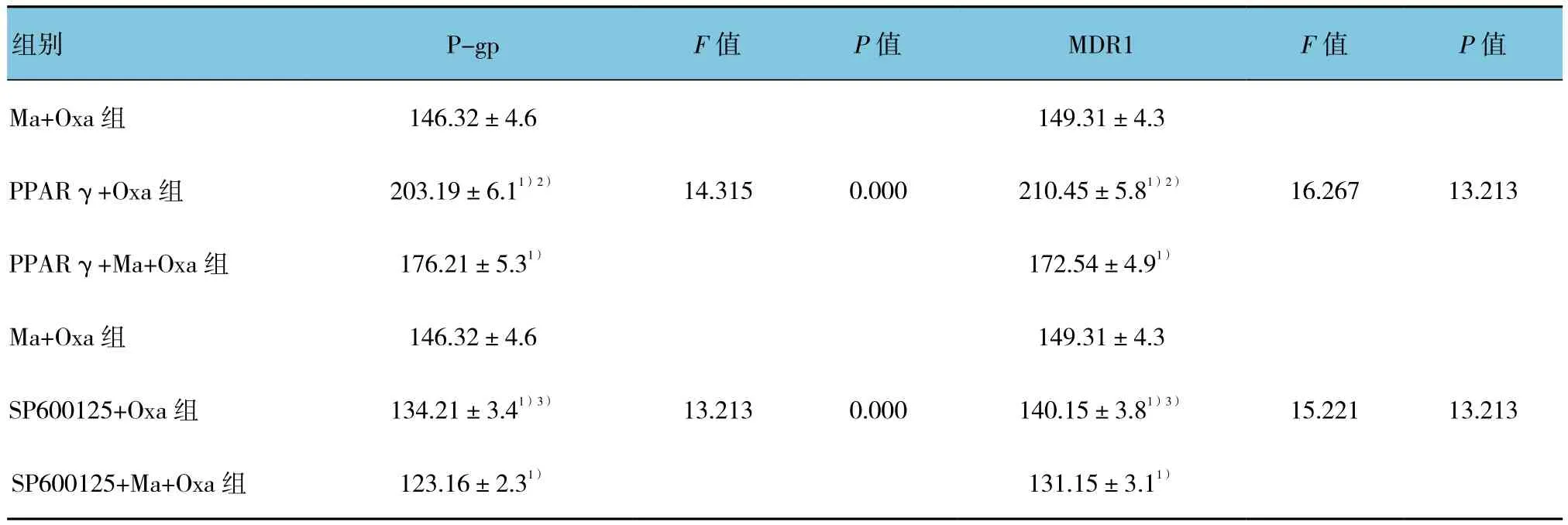
表1 Ma对SW480/Oxa细胞P-gp、MDR1 mRNA表达的影响 (n =3,±s)
注:1)与 Ma+Oxa组比较,P <0.05;2)与 PPARy+Ma+Oxa组比较,P <0.05;3)与 SP600125+Ma+Oxa组比较,P <0.05
组别 P-gp F值 P值 MDR1 F值 P值Ma+Oxa组 146.32±4.6 149.31±4.3 PPARγ+Oxa组 203.19±6.11)2) 14.315 0.000 210.45±5.81)2) 16.267 13.213 PPARγ+Ma+Oxa组 176.21±5.31) 172.54±4.91)Ma+Oxa组 146.32±4.6 149.31±4.3 SP600125+Oxa 组 134.21±3.41)3) 13.213 0.000 140.15±3.81)3) 15.221 13.213 SP600125+Ma+Oxa组 123.16±2.31) 131.15±3.11)
2.5 P-gp、p-JNK蛋白的表达水平
研究发现,在Ma+Oxa组、PPARγ+Oxa组以及PPARγ+Ma+Oxa组3组间的P-gp蛋白(F=12.315,P=0.000)以及p-JNK蛋白(F=15.267,P=0.000)的相对表达水平差异有统计学意义。见图3和表2。在Ma+Oxa组、SP600125+Oxa组以及SP600125+Ma+Oxa组3组间的P-gp蛋白(F=13.213,P=0.000)以及p-JNK蛋白(F=15.221,P=0.000)的相对表达水平差异有统计学意义。见图3和表2。
表2 Western blot检测P-gp,p-JNK蛋白的相对表达水平 (n =3,±s)

表2 Western blot检测P-gp,p-JNK蛋白的相对表达水平 (n =3,±s)
注:1)与Ma+Oxa组比较,P <0.05;2)与PPARγ+Ma+Oxa组比较,P <0.05;3)与SP600125+Ma+Oxa组比较,P <0.05
组别 P-gp F值 P值 p-JNK F值 P值Ma+Oxa组 0.489±0.052 0.221±0.031 PPARγ+Oxa组 0.867±0.0771)2) 12.315 0.000 0.434±0.0421)2) 15.267 0.000 PPARγ+Ma+Oxa组 0.576±0.0561) 0.284±0.0331)Ma+Oxa组 0.489±0.052 0.221±0.031 SP600125+Oxa组 0.369±0.0271)2) 13.213 0.000 0.246±0.0191)2) 15.221 0.000 SP600125+Ma+Oxa组 0.298±0.0241) 0.135±0.0131)

图3 Western blot检测P-gp,p-JNK蛋白的相对表达
3 讨论
中药苦参为豆科多年生落叶灌木植物苦参的干燥根。苦参性苦、寒,具清热燥湿、杀虫、利尿等功效,用于热痢、便血、黃疸尿闭、赤白带下、湿疹等。苦参碱是苦参中的抗癌有效成分,对肝癌、胃癌、肺癌、乳腺癌和直肠癌等细胞均具有生长抑制作用。奥沙利铂能够通过作用于DNA形成链内和链间交联来抑制DNA的合成,产生抗肿瘤活性以及细胞毒作用[14]。由于因个体基因遗传差异,结肠癌患者对于奥沙利铂化疗敏感性存在较大的差异,其中产生奥沙利铂的耐药性是导致患者化疗失败的主要原因。肿瘤细胞多药耐药(multi drug resistance, MDR)机制复杂,如MDR基因过多表达、DNA拓扑异构酶Ⅱ活性降低或含量减少、谷胱甘肽解毒酶系统活性增高、MDR相关蛋白基因表达增高等。其中P-gp和LRP介导的MDR研究较多,是机制最为明确的MDR产生途径。P-gp和LRP在细胞的表达水平与细胞耐药程度呈正相关。最近已经有多项研究表明苦参碱能够抑制结肠癌细胞的生长。FOFARIA[15]研究发现,2.0 mg/ml苦参碱能够抑制结肠癌细胞HT-29的生长并且能够抑制 COX-2的表达;NIU等[16]也观察苦参碱能够抑制结肠癌细胞SW116的增殖,并且抑制细胞端粒酶的活性;CHANG等[17]进一步深入研究发现苦参碱通过上调Bax的表达以及下调Bcl-2的表达来诱导HT-29细胞的调亡,从而起到抑制结肠癌细胞HT-29增殖的作用。众多研究表明[18-20],JNK/SAPK信号通路与肿瘤细胞的化疗耐药性密切相关,本研究为了尽量减轻高浓度药物引发的毒副作用,笔者选择IC50前一浓度作为Ma浓度进行后续实验,即选择10 μmol/L作为后续实验Ma的给药浓度。结果发现,Ma可抑制其增值,促进其凋亡,Ma可降低P-gp,MDR1 mRNA表达,还可降低P-gp、p-JNK蛋白的表达,提示Ma具有调控人结肠癌耐药细胞株耐药性的作用,可能与抑制JNK/SAPK信号通路,降低P-pg表达有关。本研究结果提示,Ma对调控结肠癌化疗耐药性有一定效果,研究结果为应用苦参碱干预结肠癌机制提供实验依据,Ma有望成为改善结肠癌化疗耐药性的新药物,但还需大量的基础实验和临床实验深入研究。
综上所述,Ma具有调控人结肠癌耐药细胞株耐药性的作用,可能与抑制JNK/SAPK信号通路,降低P-pg表达有关。

