牛奶过敏原β-乳球蛋白抗体的制备及免疫检测方法的建立
李亚璞,麻云莲,樊丹,张小兵
(1.河北省科学院生物研究所,河北石家庄 050081)(2.河北工业大学化工学院,天津 300132)
近年来食品过敏性疾病的发病率呈持续快速上升的趋势,食品过敏原的种类和来源急剧增加,与食品过敏直接相关的过敏疾病亦趋于多样化、复杂化的趋势[1],食物过敏问题被认为是一个不容忽视的食品安全问题[2]。常见的食物过敏反应主要由八大类食物引起,包括牛奶、大豆、蛋类、花生、坚果、小麦、鱼虾和水生贝壳类动物,美国和欧盟已先后颁布了新的食品标签法规,要求八大类过敏食品都应在食品标签中明确标示[3,4]。牛奶过敏是其中最重要的一个方面,牛奶过敏极大地影响了婴幼儿的身体健康,可以引起婴幼儿腹泻、皮疹、发育不良,严重时可引起过敏性休克等。
导致牛奶过敏的蛋白质主要有酪蛋白(CN)、β-乳球蛋白(β-Lg)、α-乳白蛋白(α-La)等,其中 β-Lg被认为是其中重要的致敏蛋白质之一[5]。β-Lg是牛乳中主要的蛋白质,在乳清蛋白中总含量达50%,占牛乳总蛋白的10%,它是由乳腺上皮细胞合成的牛乳特有蛋白,β-Lg单体的分子质量大约为 18.3 ku,含有162个氨基酸残基,等电点为5.3[6]。目前,国内外对食品中β-Lg的检测方法主要有色谱法(HPLC)[7]、酶联免疫吸附法(ELISA)[8]以及聚合酶链反应(PCR)[9]等,由于ELISA方法具有高灵敏度、高通量、操作简单等方面的优势,目前市场上出现的商业化试剂盒多以ELISA技术为主,而且多数都是进口产品,价格昂贵,检测成本较高,因此很有必要研制成本较低的检测产品,以满足国内检测机构的需要。因此,本研究以牛奶β-Lg为免疫原,制备其多克隆抗体和单克隆抗体,尝试研制出能够用来检测β-Lg的ELISA试剂盒,以满足国内检测机构的需要。
1 材料与方法
1.1 实验动物
免疫用BALB/c小鼠购自河北医科大学实验动物中心,许可证号:SCXK(冀)2013-1-003;免疫用新西兰大白兔购自鹿泉当地养殖场。
1.2 实验试剂
β-乳球蛋白标准品、酪蛋白、α-乳白蛋白、牛血清白蛋白、鸡卵清蛋白、弗氏完全佐剂、弗氏不完全佐剂、甘油、吐温-20均为Sigma公司产品;胎牛血清、DMEM均为Gibco公司产品;HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG、HRP标记兔抗山羊IgG均为北京中杉金桥公司产品,其它试剂均为国产分析纯试剂。
1.3 实验仪器
洗板机,Thermo;酶标仪,Bio-TEK;37 ℃恒温培养箱,SANYO;超高速低温离心机,HITACHI;ND-2000核酸蛋白测定仪,Thermo;灭菌锅,Panasonic;CO2培养箱,Edison;倒置显微镜,OLYMPUS。
1.4 实验方法
1.4.1 免疫抗原的制备
在天平上准确称取一定量β-Lg标准品,用超纯水稀释至1 mg/mL,然后将抗原液分装,-20 ℃保存备用。
1.4.2 动物免疫
用β-Lg抗原免疫新西兰大白兔1只,免疫剂量400 μg/只,初次免疫用弗氏完全佐剂,每隔2周免疫1次,第二次免疫剂量不变,免疫佐剂换为弗氏不完全佐剂,三次免疫后耳缘静脉取血,离心取上清初步测定抗血清效价,接着继续进行免疫,直到血清效价没有变化即可取血,离心所得上清即为抗β-Lg兔多克隆抗体。同上述方法免疫3只BALB/c小鼠,免疫剂量为40 μg/只,经过三次免疫后断尾取血,离心取上清测定小鼠血清效价,选取效价最高的小鼠进行加强免疫,剂量减半,准备细胞融合。
1.4.3 血清效价测定
抗体效价表明有效抗体浓度,是抗体质量的基本指标。试验采用间接ELISA法进行血清效价测定:用碳酸盐缓冲液稀释β-Lg抗原至浓度为10 μg/mL,将抗原液100 μL/孔加入到酶标板孔中,4 ℃包被过夜;取出包被板洗涤3次后每孔加入200 μL封闭液,37 ℃放置1 h;洗涤后加入抗血清100 μL,首孔抗血清以1:200倍稀释,接着进行倍比稀释,连续稀释23孔,并设空白对照,阴性对照血清处理同上,37 ℃放置45 min;洗涤后加入相应酶标二抗,37 ℃放置30 min;洗涤后加入底物显色液 100 μL,37 ℃避光反应 15 min;每孔加入50 μL H2SO4终止反应,用酶标仪测定吸光度OD450nm。结果判定:抗血清OD450nm值记为P,阴性对照OD450nm值记为N,以P/N≥2.1的血清稀释倍数即为抗血清效价。上述实验所用主要液体中,ELISA洗液配方为含0.05%吐温-20的生理盐水溶液,封闭液为含1%明胶的洗液。
1.4.4 抗β-Lg单克隆抗体细胞株的建立
1.4.4.1 细胞融合
准备细胞融合前应将实验所需各种液体放置于37 ℃培养箱中进行预热,然后将脾细胞和SP2/0细胞在50 mL无菌离心管内进行混合,充分混匀,离心,用手轻轻弹击离心管底部的细胞,然后向其中加入 l mL PEG溶液,时间控制在1 min内,之后加入DMEM不完全培养基,离心,沉淀用HAT完全培养基重悬,然后将重悬液加入已铺有饲养细胞的酶标板中,最后将酶标板置于CO2培养箱中进行培养。
1.4.4.2 亚克隆筛选及单克隆抗体的制备
通过有限稀释法对检测较好并且为单克隆的阳性孔进行3~6次的亚克隆筛选,待检测结果全阳性时进行扩大培养细胞,待细胞数目达到一定量后采用小鼠体内诱生腹水的方法制备单克隆抗体,向每只经过处理的小鼠腹腔内注射细胞,经过一段时间后取腹水,离心弃脂肪,所得液体即为腹水单抗,并将腹水置于-20 ℃保存,同时还要进行细胞建株及液氮保存工作。
1.4.5 抗体特性测定
1.4.5.1 多克隆抗体的特性测定
采用免疫印迹法对抗β-Lg多抗进行鉴定,将β-Lg抗原进行SDS-PAGE电泳,然后电转到硝酸纤维素膜上,以抗β-Lg兔多抗为一抗,以HRP标记的山羊抗兔IgG为二抗,最后用DAB显色。由于Protein A和Protein G对不同种属及类型的免疫球蛋白有不同的亲和力,因此应根据所要纯化的免疫球蛋白的种属和类型选择合适的纯化方法,一般纯化兔多克隆抗体需选用ProteinA的分离纯化方法。首先采用饱和硫酸铵法对多抗血清进行纯化,然后再将所得上清液采用ProteinA柱进一步纯化,透析后所得液体即为纯化多抗,用ND-2000测定纯化抗体蛋白浓度。
采用间接ELISA法对纯化多抗进行特异性测定,分别以乳中其它主要蛋白CN、α-La和BSA以及其它主要过敏原蛋白如鸡卵清蛋白、虾原肌球蛋白、花生蛋白和大豆蛋白包被酶标板,其它步骤同多克隆抗体效价测定,以确定纯化多抗的特异性。
1.4.5.2 单克隆抗体的特性测定
单克隆抗体的效价测定同血清效价测定,抗体亚型采用亚型测定试剂盒进行测定,具体方法如下:将β-LG抗原包板,包被浓度为10 μg/mL,将1A4、3A7、2B10 3株抗体分别用洗液按1:10000进行稀释,3C10抗体因为效价比较低,按照1:2000进行稀释,将稀释好的抗体加入到酶标板孔中,每个抗体3个重复,37 ℃反应45 min;洗涤后加入分型抗体,分型抗体用洗液进行稀释,按照1:1000稀释比例进行稀释,37 ℃反应30 min;洗涤后加入HRP标记兔抗山羊IgG,稀释液为加入10%小牛血清的洗液,按照1:10000进行稀释,37 ℃反应30 min;再次洗涤后加入显色液,37 ℃反应10 min,H2SO4终止反应,酶标仪读数。
单抗腹水采用辛酸-硫酸铵法[10]进行纯化,用ND-2000测定纯化抗体蛋白浓度,单克隆抗体特异性测定同多克隆抗体测定方法。
1.4.6 双抗体夹心 ELISA检测方法的初步建立
双抗体夹心 ELISA法是常用的检测食品过敏原的方法之一[11]。首先用碳酸盐缓冲液稀释β-Lg纯化多抗至浓度为10 μg/mL包被过夜,倒掉包被液,洗涤后每孔加入200 μL封闭液,37 ℃孵育1 h,倒掉封闭液,加入待检测样品,每孔加100 μL,阴性对照孔用PBS代替,37 ℃反应1 h,洗涤后再加入按1:10000比例稀释的3A7纯化单抗,每孔加入100 μL,37 ℃反应45 min,再次洗涤后加入HRP标记的山羊抗鼠IgG,每孔加100 μL,37 ℃反应30 min,经过洗涤后加入显色底物液,37 ℃反应10 min,H2SO4终止反应,酶标仪读数。
将乳中主要蛋白以及其它主要过敏原蛋白标准品分别配制成一定浓度作为待检样品,并对这些样品进行编号,利用所建立的检测方法对这些样品进行测定,依据显色情况及测定数值判断所检测样品中是否含有β-Lg,同时用色谱法进行验证。
2 结果与讨论
2.1 多克隆抗体测定结果
2.1.1 多克隆抗体效价测定结果
采用间接ELISA法进行多克隆抗体效价测定,测定结果如表1所示,依据血清效价的判定方法可知,经过三次免疫后,β-Lg兔多抗血清效价很高,已达到1:3.28×106,第四次免疫后,效价有所提高,达到了1:6.56×106,而第五次免疫后效价不再有变化。抗血清的效价随着免疫次数增加而提高,经过几次加强免疫后,血清效价就会达到一个最高值而稳定在某一水平。因此,新西兰大白兔经过5次免疫后取血,离心后得到35 mL多抗血清。

表1 β-Lg兔多克隆抗体效价测定Table 1 The titers of the rabbit PcAb against β-Lactoglobulin
2.1.2 Western-blotting鉴定结果
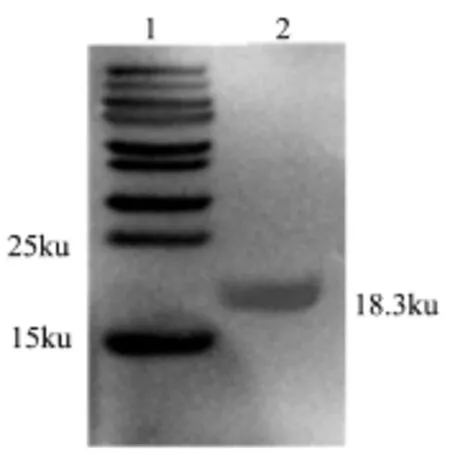
图1 抗β-Lg多克隆抗体的免疫印迹鉴定Fig.1 Western-blotting analysis of PcAb against β-lactoglobulin
Western-blotting鉴定结果如图1所示,用兔抗牛奶过敏原β-Lg多克隆抗体与β-Lg抗原进行免疫印迹,结果显示该多抗能够与β-Lg蛋白呈强阳性反应,大约在18.3 ku处有明显的阳性条带出现,条带位置正确,说明该实验制备的兔多克隆抗体与 β-Lg免疫反应良好。
2.1.3 兔多克隆抗体的纯化及浓度测定
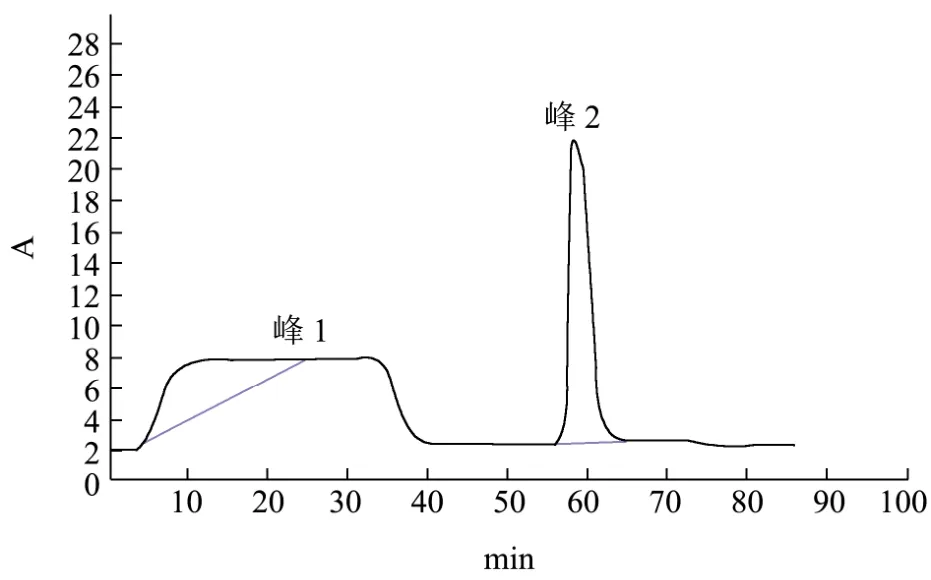
图2 ProteinA亲和纯化色谱图Fig.2 The affinity chromatography of PcAb
将兔多抗血清首先经过饱和硫酸铵纯化,再经Protein A柱进一步纯化,Protein A纯化过程如图2所示,首先将ProteinA柱平衡,然后用0.01 mol/L PBS将待纯化血清稀释后进行上样,峰1为杂蛋白,然后将上样缓冲液换成洗脱缓冲液,峰2为洗脱出的特异性蛋白,即目标蛋白。
由于峰2峰尖较尖,峰形较好,初步说明该抗体的纯化效果较好。洗脱完毕后换成清洗缓冲液以洗脱少量顽固结合的杂蛋白。将目标蛋白再用0.01 mol/L PBS液进行透析,透析后的液体即为纯化的兔多抗,用ND-2000测定抗体蛋白浓度为2.07 mg/mL,然后将透析液进行分装,备用。
2.1.4 纯化多抗的特异性测定

图3 纯化多抗特异性测定Fig.3 The detection of the specificity of the purified PcAb
交叉反应的测定是用来表征抗体与不同结构抗原发生结合的能力,同时也是衡量抗体特异性的指标。本实验采用间接竞争ELISA法,将乳中主要交叉蛋白以及主要过敏原蛋白包被酶标板,包被浓度均为 10 μg/mL,测定结果如图 3所示,该纯化多抗仅与 CN有一定的交叉反应,而与乳中其它蛋白以及主要过敏原蛋白完全没有交叉反应,因此该多抗具有一定的特异性。
2.2 单克隆抗体测定结果
经过三次免疫,测定 3#小鼠血清效价为1:8.20×105,1#和 2#小鼠血清效价为 1:4.10×105,因此挑选3#小鼠进行细胞融合。细胞融合后7 d观察细胞培养板,6块细胞培养板共计有576孔,其中有518孔有杂交瘤细胞形成,融合率为 90%。用间接竞争ELISA检测细胞上清液,选其中OD450nm值较高的10孔进行亚克隆筛选,然后进行了扩大培养。在扩大培养的过程中通过测定细胞培养上清又进行了特异性筛选,最后得到了4株能稳定分泌单克隆抗体而特异性较好的细胞株,分别为1A4、3A7、2B10和3C10,然后对这些抗体进行了效价等特异性测定。
2.2.1 单抗细胞株效价测定结果
实验采用动物体内诱生法制备腹水,每株抗体大约都获得了10 mL的腹水抗体。采用间接ELISA法测定单抗细胞株效价,测定结果如表2,除3C10抗体外,其余3株抗体效价均在106以上,较之融合前小鼠血清效价有很大的提高,该抗体效价完全能够满足免疫分析的要求。

表2 单抗细胞株效价测定结果Table 2 The titers of the McAbs against β-Lactoglobulin
2.2.2 单抗亚型测定结果
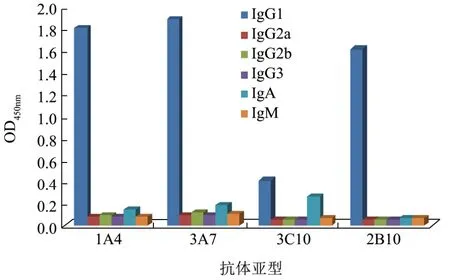
图4 抗体亚型测定Fig.4 The detection of the subclass of McAbs
将筛选得到的4株杂交瘤细胞制备的腹水抗体进行亚型鉴定,测定结果如图4所示,由测定结果可知,该4株抗体亚型均为IgG1型,只有3C10抗体对IgA亚类抗体有一定的反应。因为单抗亚型是选择单抗纯化方法的基础,辛酸-硫酸铵法主要用于IgG1和IgG2b亚类抗体的纯化,而且这种方法对抗体的活性影响较小,产率较高,并且获得抗体的纯度也较高,因此本实验对单抗的纯化选择辛酸-硫酸铵法。
2.2.3 纯化单抗特异性测定结果
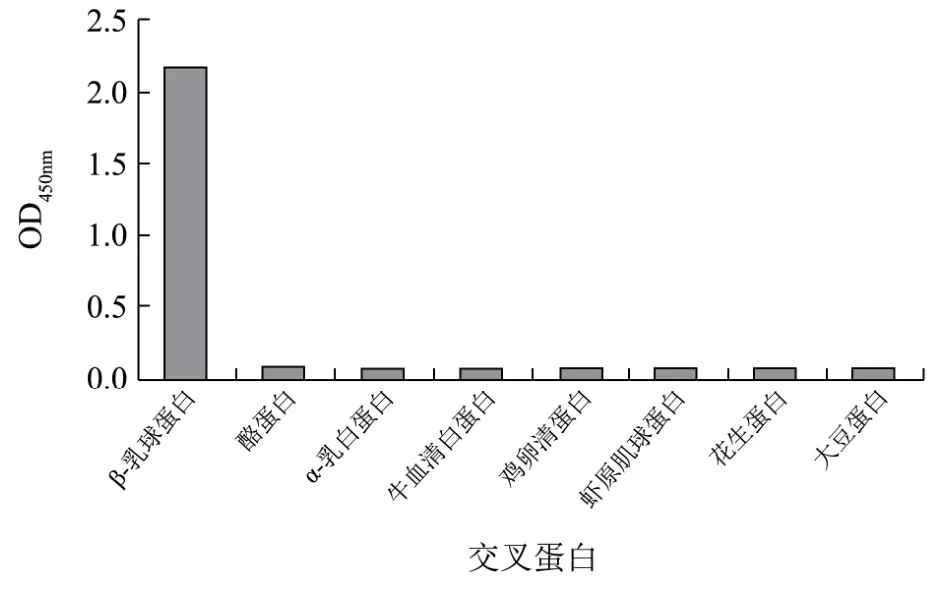
图5 3A7抗体特异性测定Fig.5 The detection of the specificity of 3A7 McAb
本实验采用辛酸-硫酸铵法对其中效价最高的3A7抗体进行了纯化,纯化后抗体蛋白浓度为 5.06 mg/mL,对这株纯化抗体特异性测定结果如图5所示,由图可知,该纯化抗体与β-Lg反应的OD450nm值与其它蛋白反应的 OD450nm值相比有明显的差异,说明该纯化单抗特异性很好,与乳中其它相关蛋白及主要过敏原蛋白基本无交叉反应,特异性优于多克隆抗体。
2.3 样品的初步检测
利用所建立的双抗体夹心 ELISA检测方法对蛋白样品进行检测,结果如表3所示,只有3#检测孔变为黄色,该孔P/N值为19.51,判为阳性;而其余孔没有任何颜色变化,P/N值均在1左右,说明这些样品与阴性对照接近,判为阴性;同时将这些样品用色谱法进行验证,结果显示只有3#样品含有β-Lg,两种方法的检测结果一致,因此该实验所建立的检测方法可以定性的检测样品中的β-Lg。

表3 样品检测结果Table 3 The test results of samples
3 结论
3.1 ELISA法是检测食品过敏原常用的方法之一,它是利用酶标记物同抗原抗体复合物的免疫反应与酶的催化放大作用相结合,即可保持酶催化反应的敏感性,又保持了抗原抗体反应的特异性[12]。酶联免疫检测技术的灵敏度和准确度取决于所用抗体的效价和特异性,因此制备高效价、高特异性的抗体是建立ELISA检测方法的关键因素。因为单克隆抗体具有较好的特异性,而多克隆抗体具有较高的灵敏度,这二者的结合所建立的双抗体夹心 ELISA法就可以将食品中的微量物质检测出来。
3.2 目前,ELISA法用于牛奶过敏原的检测主要集中在对牛奶蛋白全组分以及CN单一组分方面的研究,而对 β-Lg单组分的研究还比较少。高淑霞[13]通过将β-Lg抗原分别免疫新西兰大白兔和BALB/c小鼠制备了兔多克隆抗体和鼠多克隆抗体,并建立了竞争ELISA检测方法。李欣等[14]通过纯化水牛乳的β-Lg,制备了抗水牛乳β-Lg的兔多克隆抗体,并通过实验证明所制备的兔多克隆抗体与牛乳中主要蛋白都存在交叉反应,这可能是由免疫抗原纯度造成的。本实验为了得到特异性较好的抗体,所用抗原为 β-Lg的标准品。
3.3 本实验将 β-Lg抗原免疫新西兰大白兔制备了抗β-Lg多克隆抗体,所制备的多抗血清效价高达1:6.56×106,通过特异性测定结果及 Western-blotting鉴定结果可知,该多抗具有较好的特异性,仅与 CN具有一定的交叉反应。在单克隆抗体的制备过程中,细胞融合是最关键的步骤,而影响细胞融合效果的因素有很多,如SP2/0细胞和脾细胞的生长状态和融合比例、PEG的用量以及PEG的作用时间等等,通过对以上几个方面的控制,本次实验的细胞融合率高达90%。在细胞亚克隆筛选的过程中,通过对细胞上清特异性的测定,最后筛选得到了 4株特异性好的抗β-Lg单克隆抗体细胞株,从而保证了腹水抗体的特异性。实验选择了其中效价最高的3A7抗体进行了辛酸-硫酸铵纯化,特异性测定结果显示该纯化抗体与乳中其它蛋白以及主要过敏原蛋白没有任何交叉反应,特异性很好。利用所建立的双抗体夹心ELISA检测方法对一些蛋白样品进行了定性测定,并且用色谱法对实验结果进行验证,两者的符合率为 100%。目前本工作所得的抗 β-Lg单克隆抗体和多克隆抗体是建立双抗体夹心ELISA检测方法的基础,若要进一步应用其建立双抗体夹心的ELISA定量检测方法,还需从反应体系组成、反应条件等方面进行深入的研究。

