短链葡聚糖包合姜黄素的分子机制
冯涛,曾小兰,张钰,Marcelo Carignano,Osvaldo Campanella,李晓玺
(1.上海应用技术大学香料香精技术与工程,上海 201418)(2.卡塔尔环境与能源研究所,多哈 5825)
(3.普度大学食品科学系惠斯特勒碳水化合物研究中心,美国印第安纳州 47907)
(4.华南理工大学食品科学与工程学院,广东广州 510640)
姜黄素(curcumin)是从姜科姜黄属植物姜黄(Curcum a longa L)根茎中提取的一种酚类色素,是有效的药物单体[1]。姜黄素分子对环境条件敏感,如对光、氧、热敏感。姜黄素表现出极低的水溶性,稳定性低,代谢快,吸收性差,这些特点严重降低了它的生物利用率,从而影响了它的健康功效[2]。
淀粉是丰富,廉价,天然可再生和可生物降解的多糖[2]。不同来源的淀粉具有直链淀粉和支链淀粉的差异,其在许多物理性质上显着不同[3,4]。一般情况下,B类型的淀粉具有长的支链淀粉,A类型的淀粉具有大量聚合度为6~12的短链[5]。短链葡聚糖是一种低分子量的亲水性线性聚合物,其聚合度约为20,是由支链淀粉通过酶解脱支制备而得[6]。短链葡聚糖可以用作控释的疏水性功能物质的纳米载体,来保持疏水性物质的水溶性、生物活性等。支链淀粉经酶解脱支,形成具有一定聚合度的线性直链淀粉短链,线性短链通过两两碰撞、缠绕并形成双螺旋分子,使支链淀粉的消化性降低,改善了天然淀粉作为壁材输送生物活性物质易被人体胃肠道中酸和酶侵蚀的缺点。
为了提高姜黄素的水溶性,提高其在人体胃肠道中的吸收率,本研究拟采用蜡质玉米淀粉为原材料。淀粉聚合物由于其复杂的结构,需要酶(内切酶和外消旋酶)的组合用于将淀粉解聚成寡糖和较小的糖,或者通过产生新的键(脱支酶和糖基转移酶)转移低聚葡萄糖苷键和残基来转化淀粉[2]。通过普鲁兰酶制备得到了短链葡聚糖,后利用溶液混合法制备了短链葡聚糖-姜黄素包合物,其载药量和包埋率分别为28.46%和1.27%。初步实验探究证明短链葡聚糖-姜黄素包合物的溶解性高于单独的姜黄素水溶液,随着包合物粒径的减小,包埋率也提高了,考虑将短链葡聚糖-姜黄素包合物制备成纳米乳液以提高芯材的包埋率和载药量,从而提高其生物利用率。并利用分子动力学模拟的方法来分析短链葡聚糖与姜黄素包合机制。虽然短链葡聚糖-姜黄素水溶性纳米粒子体系已经在实验室进行研究,但是在分子水平上对其形成机理的研究还很少。
分子模拟是目前常用的一种对分子行为进行解释或预测的研究方法,广泛地应用于各学科领域[7]。YinZhang[8]报告了开发支链共价结构和动态构象多重性方法的应用,其结合分子动力学(MD)模拟和镧系元素辅助顺磁性NMR光谱,以评估动态支链寡糖的构象组合。M Umemura等[9]在分子动力学模拟的水溶液中麦芽糖和低聚果糖的糖苷键的水合对构象柔性的影响,已经在二千个TIP3P水分子中进行了从单体到六聚体的麦芽糖和纤维寡糖的分子动力学模拟。麦芽糖和大麦低聚糖均由d-吡喃葡萄糖组成,但在其糖苷键具有不同的构象柔性;后者比前者更僵硬。本文的目的是调查糖苷键上的构象柔性对水溶液中水合状态的影响。
1 材料和方法
1.1 材料
蜡质玉米淀粉(食品级),国民淀粉;普鲁兰酶(E.C.3.2.1.41,6000 APU/g,1.15 g/mL,其中ASPU定义为在pH 4.4和60 ℃下1 min内从淀粉中释放出1.0 mg葡萄糖的酶量),一水合柠檬酸(分析纯),上海国药集团;磷酸氢二钠(分析纯),上海国药集团;无水乙醇(分析纯),上海国药集团;姜黄素标准品(色谱纯),Sigma试剂(上海)有限公司。
1.2 方法
1.2.1 短链葡聚糖的制备
短链葡聚糖的制备可参见Sun(2014)[10]。分别称取一定量的蜡质玉米淀粉,分别加入200 mL缓冲液(pH=5.0的Na2HPO4-柠檬酸缓冲液),配制成浓度为10%、15%、20%、25%(W/V)的淀粉浆。沸水浴并剧烈地搅拌30 min以充分糊化,降温至58 ℃,分别加入一定量的普鲁兰酶(添加量是30 APU/g),搅拌保温8 h,快速离心(10000×g 2 min),取上清液。100 ℃加热30 min以灭酶,4 ℃保持8 h,冷冻12 h;冷冻干燥48 h,即得短链葡聚糖。由浓度10%、15%、20%、25%的淀粉液制备的短链葡聚糖分别记为SC1、SC2、SC3、SC4。
1.2.2 短链葡聚糖-姜黄素包合物的制备
称取一定量的姜黄素,配成4 mg/mL的姜黄素乙醇溶液。称取一定量SC2,配成5 mg/mL的短链葡聚糖水溶液,超声15 min,80 ℃水浴30 min。姜黄素缓慢加入到糊化后的短链葡聚糖溶液中,姜黄素与短链葡聚糖的重量百分比分别为1 wt%、2 wt%、3 wt%、4 wt%。加热搅拌30 min,38 ℃旋转蒸发30 min除去乙醇。高剪切分散乳化机(19000×g 5 min)。冷冻24 h,真空冷冻干燥48 h,即得短链葡聚糖-姜黄素包合物。
1.2.3 包埋率和载药量的测定
包埋率EE(%)=(1-样品中游离姜黄素/样品中姜黄素总量)×100
载药量LC(%)=(样品中姜黄素的总量/样品中短链葡聚糖的总量)×100
1.2.4 短链葡聚糖-姜黄素分子动力学模拟过程
短链葡聚糖是由Gregor博士提供的 V-型直链淀粉分子模型[11]截取而得的,是由 17个葡萄糖残基组成的。姜黄素的prep文件来自Berhanu[12]等的补充信息。利用 AMBER14程序包实现的,采用了GLYCAM-06力场。短链葡聚糖和姜黄素作为溶质都溶于最小宽度为10 Å的水盒子,溶剂模型是TIP3P。能量最小化处理经历三个阶段,接着整个体系达到平衡过程,最后是动力学的模拟,在NPT系统下,体系进行了600 ns的模拟。在模拟中,调用了周期性边界条件。整个体系的截断半径设为10 Å。同时,还采用了SHAKE法则来限制氢原子,因此步长设为2 fs。对于轨迹,采取了每隔1 ps保存一帧的做法。在本文中,所有的图都是由VMD及grace完成的。
1.2.5 数据统计分析
本实验利用 AMBER 14程序包实现分子动力学模拟计算的,短链葡聚糖采用了GLYCAM-06力场,姜黄素选用的是GAFF力场。实验利用Origin软件进行作图,采用SPSS 18.0中ANOVA模块对试验数据进行方差分析。
2 结果与讨论
2.1 短链葡聚糖-姜黄素、载药量
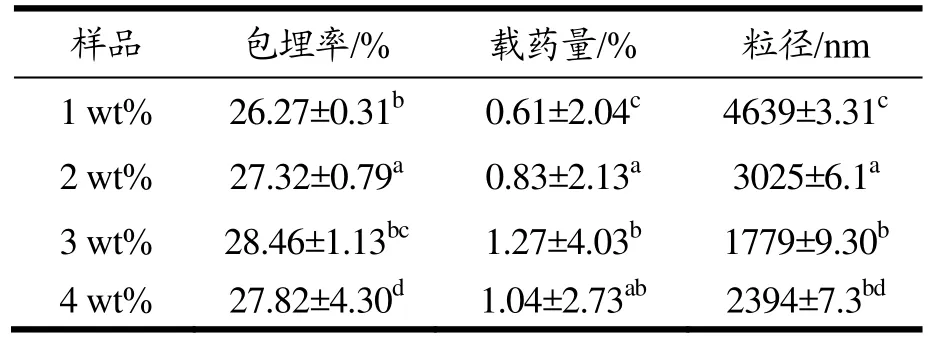
表1 短链葡聚糖-姜黄素包合物样品的包埋率、载药量和粒径Table 1 encapsulation efficiency and loading content of inclusion complex and inclusion complexes
从表 1可知,姜黄素-短链葡聚糖包埋率最大为28.46%。Aditya[13]等以硬脂酸甘油酯、油酸和卵磷脂制备的油相体系为壁材,包埋姜黄素制得姜黄素包合物,所制得的包合物包埋率达到了(78±2)%,姜黄素的亲脂特性和硬脂酸甘油酯的无序晶格结构(有利于容纳更多的客体分子)是所制得的包合物包埋率高的原因。从表1可以看出包埋率和载药量最高时,包合物的粒径是最小的,但却高于1000 nm。
2.2 短链葡聚糖与姜黄素包埋过程

图1 短链葡聚糖与姜黄素质心之间的距离Fig.1 the COM (center of mass) distance between short glucan chain and curcumin
短链葡聚糖在600 ns内的构象转变快照图及其与姜黄素的自组装快照图附件一和附件二。通过观察发现,该模拟所产生的结构和初始状态的结构显著不同。在模拟过程中,以近似V型直链淀粉结晶结构为短链葡聚糖的起始结构。附件一未添加姜黄素的短链葡聚糖体系中可以看出,在第50 ns时,短链葡聚糖的螺旋结构已经伸展开,这可能是由于水分子与短链葡聚糖葡萄糖残基上的O3和O2强烈作用破坏了分子内氢键网络结构[14]。从100 ns到600 ns,短链葡聚糖在水中的构象为随意的、无规律的无规卷曲构象,这与López等[14]的结果一致。附件二添加姜黄素短链葡聚糖与姜黄素的自组装快照图。可以看出,0 ns时姜黄素分子位于SGC螺旋空腔外部;50 ns时SGC伸开,姜黄素分子与SGC缠绕在一起;接着在100 ns时,SGC与姜黄素分子再次分开;130 ns时,SGC与姜黄素分子仍处于分开的状态,从图中可以开出,姜黄素分子发生折叠;150 ns时,SGC与姜黄素分子重新缠绕在一起;200 ns时,姜黄素分子被包裹在短链葡聚糖尾部;250 ns时,SGC对姜黄素分子由环绕变成半缠绕;300 ns时,SGC与姜黄素分子缠绕位置及方式相似;310 ns,SGC与姜黄素再次分离,姜黄素分子在短链葡聚糖尾部折叠成V型结构;350 ns时,SGC形成一个不在同一个平面上的不闭合圆环,姜黄素分子一半嵌入圆环内,另外一半处于圆环外;370 ns时,姜黄素分子完全被SGC包裹;400 ns,姜黄素分子被缠绕在SGC的中部;从450 ns到550 ns,SGC将姜黄素分子包埋进其空腔中;600 ns时,SGC半缠绕姜黄素分子。
从图1可看出,短链葡聚糖与姜黄素分子质心之间的距离处于动态的变化中,从0 ns到600 ns,两者的距离呈现出先减小后增加的循环往复的变化直至最后减小且波动不大,这说明短链葡聚糖与姜黄素分子呈现出先包埋后解离的循环的构象变化,最后又包埋直至比较稳定的状态,这也与短链葡聚糖自身构象发生折叠和翻转有一定的关系。这与附件二的结构转变快照图所呈现的构象变化一致。因此,我们可以得出短链葡聚糖与姜黄素分子形成的包合物前400 ns不是很稳定,400 ns以后趋于稳定状态。
2.3 体系的回转半径
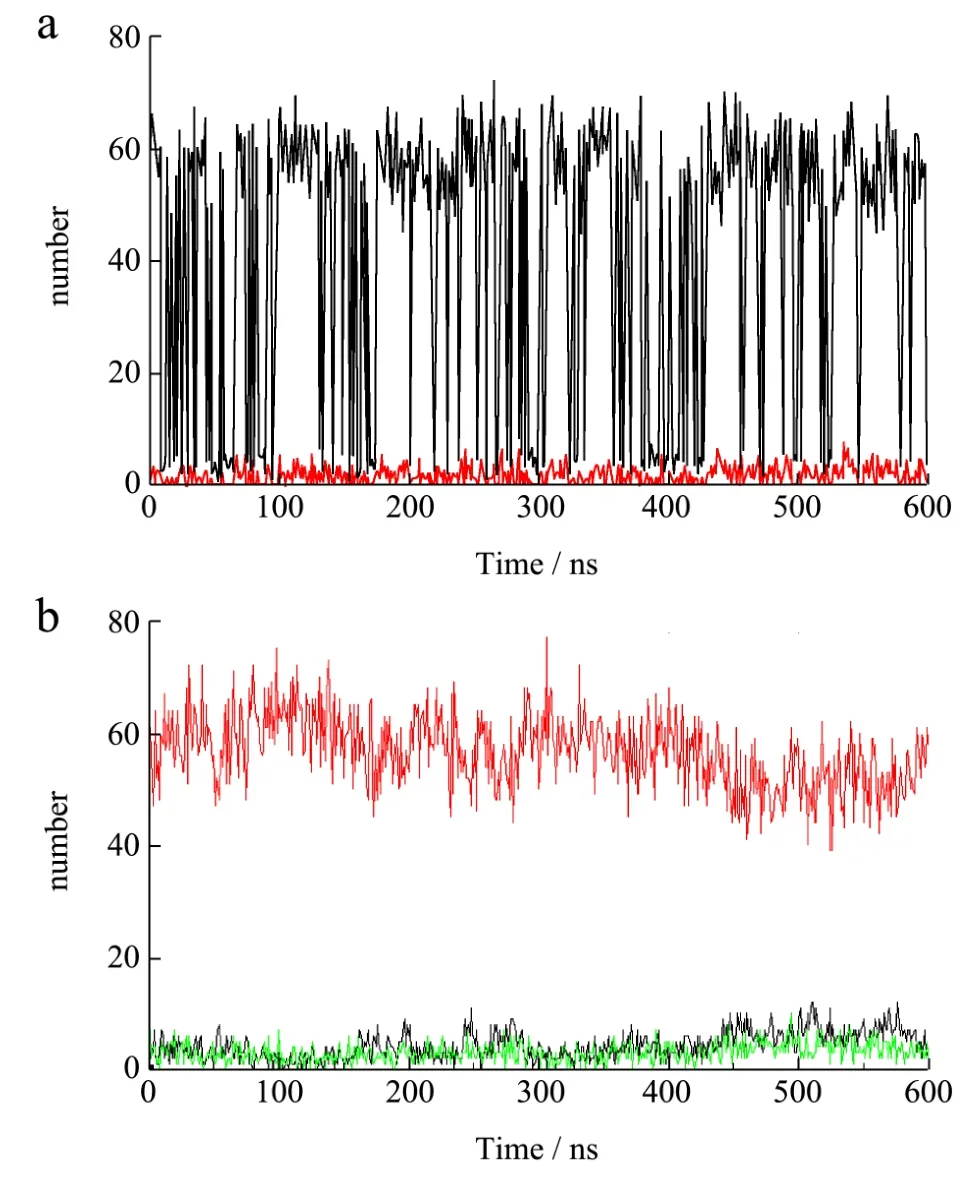
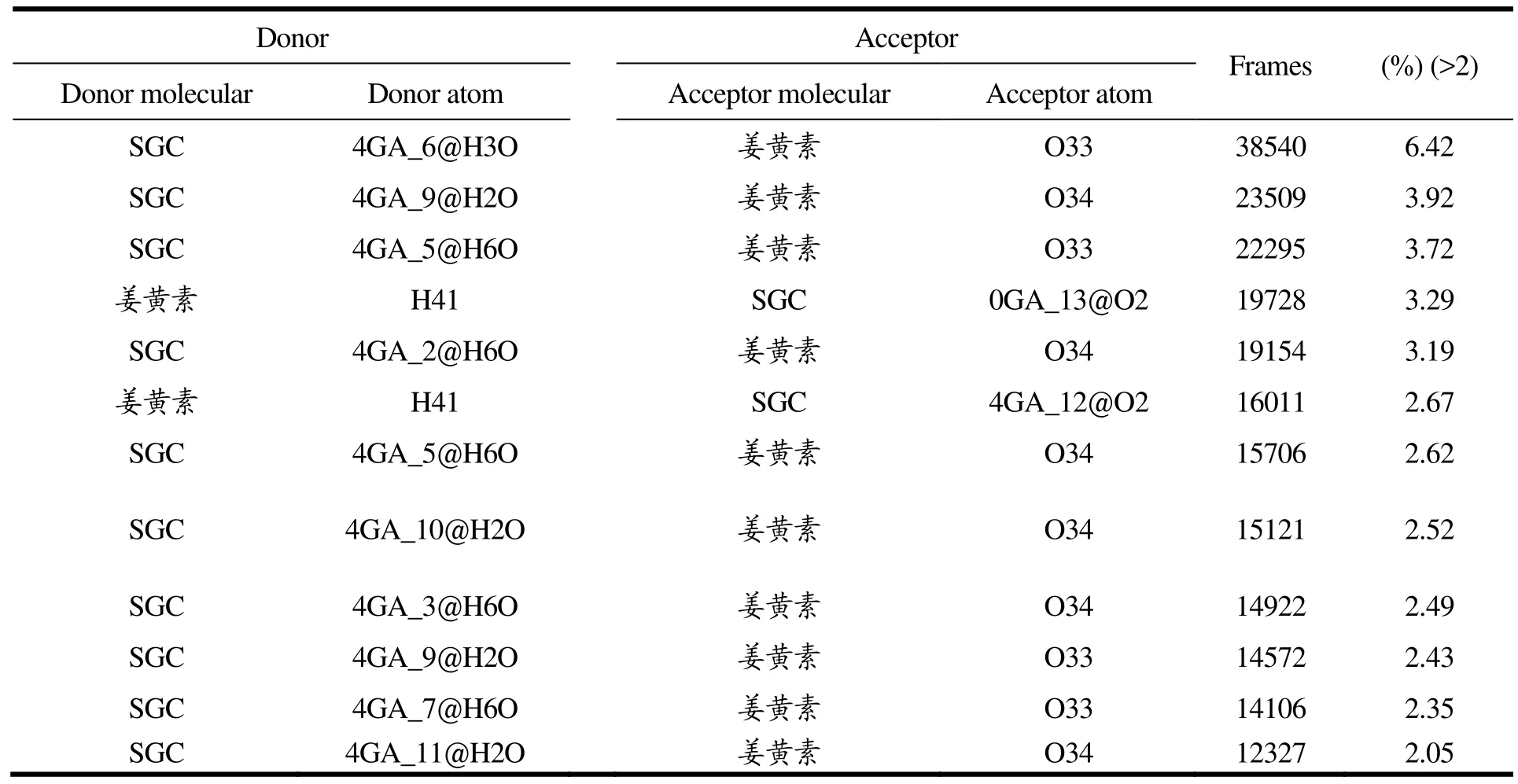
回转半径是直接反映复合物溶解特性的主要特征之一。在短链葡聚糖、姜黄素二元体系中,短链葡聚糖的回转半径可以分为两个阶段,在第一阶段(0 图2 体系中短链葡聚糖的回转半径Fig.2 Radius of gyration (Rg) of short glucan chains 图3 体系中溶质与溶剂之间的氢键数量及溶质-溶剂-溶质的盐桥数量Fig.3 The number of hydrogen bonds and salt bridges of curcumin aqueous solution 为了研究短链葡聚糖与姜黄素之间的分子间相互作用,分析了体系氢键和盐桥的变化。氢键是分子体系中一种重要的非共价结构力,氢键第一次被描述出来是在 1992年[16]。氢键的判据设定为氢键供体与受体的距离小于3.5 Å,角度小于135°,而盐桥的判据也设定为供体与受体的距离小于3.5 Å。从图3a可以看出,600 ns间未添加姜黄素和添加姜黄素的短链葡聚糖体系中溶质-溶剂分子间氢键的总数量都在不断的变化,在此过程中,不断有氢键断裂和新的氢键形成,两者差值的绝对值即为此刻的氢键数量。从图 3可以看出未添加姜黄素的体系中溶质-溶剂分子间氢键数量大部分时间保持在60以下,而添加了姜黄素的体系中溶质-溶剂氢键数量在60左右平稳的振动,这说明添加了姜黄素分子的体系中溶质-溶剂的氢键数量比未添加姜黄素的体系中氢键数量多,姜黄素对短链葡聚糖的构象有一定的作用。 氢键的供体和受体无论是在溶液(他们和周围的水形成氢键)中还是在活性位点(他们和受体残基形成氢键)都很容易形成[17]。表2给出了未添加姜黄素分子的体系中短链葡聚糖分子内形成的氢键,其中表中的 nGA (n=0, 4)表示短链葡聚糖上的葡萄糖残基(n=0表示短链葡聚糖上一端的葡萄糖残基,n=4表示短链葡聚糖上中间的葡萄糖残基)。nGA后的数字表示残基序号,@符号后的H3O及O2分别是在力场中氢原子和氧原子的名称,体系模拟了600 ns,下同。从表2中可以看出氢键占有比例最高的是短链葡聚糖中第十二个葡萄糖残基上的 H3O氢原子与短链葡聚糖中第十三个葡萄糖残基上的O2氧原子形成的氢键,为8.63%,该氢键仅存在了51780帧,即在600 ns中仅存在了51.78 ns,说明该氢键不稳定。因此未添加姜黄素分子的体系中短链葡聚糖分子间形成的氢键不稳定。 表3给出了添加姜黄素分子的体系中短链葡聚糖分子内形成的氢键,可以看出,氢键占有比例最高的是短链葡聚糖中第九个葡萄糖残基上的 H3O氢原子与短链葡聚糖中第十个葡萄糖残基上的O2氧原子形成的氢键,为31.90%。其中在未添加姜黄素分子的体系中出现的占有比例最高的氢键在此体系中仍然存在,占有比例变为14.72%,说明了该氢键在添加了姜黄素的短链葡聚糖水溶液体系中比未添加姜黄素的体系中稳定。其中,通过对比发现,未添加姜黄素体系中短链葡聚糖分子内形成的氢键占有比例在10%以上的没有,而添加了姜黄素的体系中占有比例在10%以上的氢键个数为11个,这说明在添加了姜黄素的体系中,短链葡聚糖分子内氢键个数增加,氢键稳定性增强。 表4给出了短链葡聚糖与姜黄素分子之间形成的氢键,从表4中可以看出,占有比例最高的是短链葡聚糖上第六个葡萄糖残基上的 H3O氢原子与姜黄素分子上的O33氧原子,占有比例为6.42%,出现的帧数为38540,即在600 ns的模拟过程中有38.54 ns出现该氢键。 由图1中0~600 ns结构转变构象图可知,短链葡聚糖与姜黄素的包埋处于动态过程中,即包埋和解离相互交替,又由于氢键是根据简单的氢供体原子和受体原子之间的距离及供体-氢-受体角度的几何标准来判定,因此当短链葡聚糖与姜黄素包合物解离并相互远离时,该氢键发生断裂,当两者再次靠近时,该氢键重新形成。所以该氢键出现的38.54 ns很可能是在短链葡聚糖与姜黄素包埋过程中出现的。 表2 未添加姜黄素分子的体系中短链葡聚糖分子内形成的氢键Table 2 The hydrogen bonds formed in the short glucan chain molecules in the system without the addition of curcumin molecules 表3 添加姜黄素分子的体系中短链葡聚糖分子内形成的氢键Table 3 The hydrogen bonds formed in the short glucan chain molecule in the system of adding curcumin molecules 表4 添加姜黄素分子的体系中短链葡聚糖与姜黄素分子间形成的氢键Table 4 The hydrogen bonds formed between the short glucan chain and the curcumin molecule in the system of adding curcumin molecules 本文利用Amber软件进行分子动力学模拟,研究了短链葡聚糖-姜黄素体系包埋过程的自组装机制。发现短葡聚糖链与姜黄素分子包埋处于包埋和解离的动态过程中,即包埋和解离交替进行最终达到一个相对稳定的包结状态。从分子模拟的角度发现不仅姜黄素的存在影响了短链葡聚糖的构象转变,姜黄素分子体系中短链葡聚糖分子内形成的氢键,姜黄素分子的体系中短链葡聚糖与姜黄素分子间形成的氢键的数量及稳定性分别都大于短链葡聚糖水溶液体系中氢键的数量及稳定性,这说明姜黄素的存在增加了短链葡聚糖的水合作用,在一定程度上提高了姜黄素的溶解度,为医学领域开发新型壁材提供理论依据。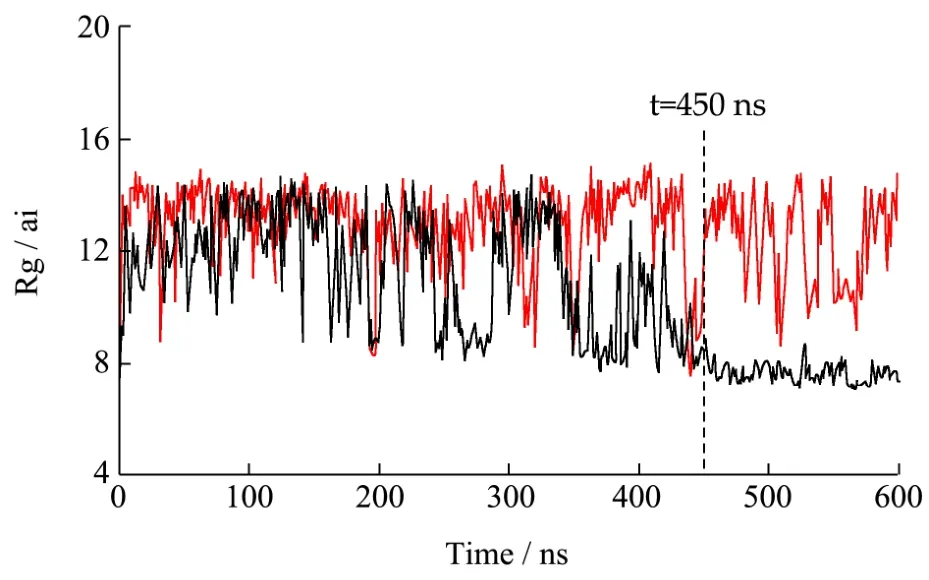
2.4 分子间相互作用


3 结论

