液体发酵黑木耳多糖的分离纯化及保湿性研究
范秀芝,殷朝敏,姚芬,史德芳,高虹
(湖北省农业科学院农产品加工与核农技术研究所,国家食用菌加工技术研发分中心,湖北武汉 430064)
多糖(Polysaccharide)是一类由醛糖或酮糖通过糖苷键连接成的天然高分子聚合物,它广泛存在于高等植物、真菌、藻类、细菌及动物体细胞中,是构成生命的四大基本物质之一[1,2]。真菌多糖不仅作为细胞壁的结构组成和细胞中能量存储分子发挥重要作用,还具有多种生物活性,如对心脑血管、肿瘤和急慢性炎症等疾病具有预防和治疗作用,在调节免疫、降血压、降血糖、降低胆固醇和甘油三酯,抗肿瘤、抗炎、抗血小板凝集、抗氧化及抗衰老等方面具有独特的生物活性,而且毒副作用低[3~7]。
黑木耳(Auricularia heimuer)[8]是一种药食兼用的胶质菌,在中国、泰国、韩国和日本等东南亚国家广泛种植和消费,是全球第三大栽培食用菌[9]。在中国,黑木耳子实体作为传统食品和民间药物已有1000多年的历史,而且已有研究证实黑木耳具有多种生物学活性,包括增强免疫[10]、抗肿瘤[11]、抗病毒[12]、抗凝血[13]、抗氧化[14]、降血糖[15]、降血脂[16]、降低胆固醇[17]以及保护心脏[18]等功效,其中上述功效的明确主要来自对黑木耳子实体中多糖(胞内多糖)的研究。
然而,食用菌子实体的生产受季节和气候的影响较大,而且栽培周期长,劳动强度大,子实体中多糖的提取存在工艺繁琐、提取效率低等问题。因此,近年来越来越多的研究者将目光转向具有生产周期短、成本低、易于控制,活性产量高、质量好等优势的深层发酵(液体发酵)技术上。且已有研究表明液体发酵产物中具有与子实体相同的营养、风味以及活性物质,发酵产物中各类成分含量均显著高于子实体[19];液体发酵所得的多糖具有与子实体多糖相同的结构[20]和活性[21,22]。
目前,在黑木耳中已有液体发酵研究主要集中在液体发酵菌株的筛选[23],液体发酵培养基及培养条件优化、发酵所得胞内或胞外多糖的抑菌性、抗氧化活性研究[24~27],以及外源添加中药提取物对黑木耳多糖合成、活性影响以及合成调控机理研究[28,29]。本研究,在优化培养基基础上,开展液体发酵多糖,包括胞外多糖(extracellular polysaccharide,EPS)和胞内多糖(intracellular polysaccharide,IPS)的分离、纯化以及官能团分析,并对纯化胞外和胞内多糖的抗氧化和保湿性进行比较研究,在明确二者异同的同时为开展黑木耳液体发酵多糖的合理利用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
优选的黑木耳菌株,黑木耳2号[23](HME2,国家审定编号2007018)。
1.1.2 试剂
纤维素DEAE-52、葡聚糖凝胶Sephadex G-200,上海源叶生物科技有限公司;中性蛋白酶(50000 U/g),南京庞博生物工程有限公司;葡萄糖、磷酸二氢钾、磷酸氢二钾、硫酸镁、无水乙醇、苯酚、硫酸、三氯甲烷、正丁醇、抗坏血酸、1,1-二苯基-2-三硝基苯肼(DPPH)、铁氰化钾、三氯乙酸、乙二胺四乙酸二钠(EDTA-Na2)、双氧水、三羟甲基氨基甲苯(Tris)、邻苯三酚、甘油等试剂。
1.1.3 供试培养基
液体完全培养基(LCYM):葡萄糖20.00 g,蛋白胨 2.00 g,酵母膏 2.00 g,MgSO4·7H2O 0.50 g,K2HPO41.00 g,KH2PO40.46 g,加蒸馏水定容至1.00 L,pH自然;
基础发酵培养基(BFM):葡萄糖20.00 g,蛋白胨 2.00 g,KH2PO42.00 g,MgSO4·7H2O 1.00 g,加蒸馏水定容至1.00 L,pH自然;
发酵培养基:葡萄糖28.67 g/L,麸皮117.83 g/L,MgSO4·7H2O 1.00 g/L,K2HPO42.00 g/L。麸皮浸泡30 min后,沸水煮30 min,取滤液用于发酵培养基[30]。
1.2 仪器与设备
LRH-250L恒温培养箱,上海一恒科学仪器有限公司;ZWY-2102恒温摇床,上海智城分析仪器制造厂;SW-CJ-1CU超净工作台,苏州净化设备有限公司;LDZM-80KCS高压蒸汽灭菌锅,上海申安医疗器械厂;FE-20 pH计,梅特勒;RE-52旋转蒸发器,上海亚荣生化仪器厂;3K15高速冷冻离心机,德国Sigma;101-2AB型电热恒温鼓风干燥箱,天津市泰斯特仪器有限公司;SCIENTZ-18N冷冻干燥机,宁波新芝生物科技股份有限公司;KQ-5200DE超声波清洗器,昆山市超声波仪器公司;数控计滴SBS-100A自动部分收集器,上海沪西分析仪器厂;UV-1800紫外可见分光光度计,日本岛津;Nanodrop 2000C超微量分光光度计,美国热电;BSC-250恒温恒湿箱,上海博迅实业有限公司医疗设备厂;TENSOR 27傅立叶变换红外光谱仪,德国Bruker。
1.3 方法
1.3.1 菌种制备及培养条件
菌种接种到含固体完全培养基的 90 mm平板于25 ℃培养5 d;用8 mm打孔器打孔后取接种块接入30 mL LCYM培养基中培养5 d;匀浆取5 mL菌液接种到100 mL基础发酵培养基中,25 ℃、120 r/min振荡培养4 d;按1:10接种量吸取菌液接种到优化的发酵培养基中,25 ℃、160 r/min振荡培养7 d。
1.3.2 多糖的分离、提取
培养结束后将发酵液连同菌球于6000 r/min离心15 min,收集上清,用蒸馏水洗涤菌球2次,离心后合并上清液,60 ℃真空减压浓缩,加入4倍体积无水乙醇于4 ℃沉淀过夜[27];8000 r/min离心10 min,收集沉淀,冷冻干燥后称重得到胞外粗多糖,记EPS。
将洗涤后的菌球冷冻干燥、称重,根据发酵液体积计算菌丝体产量(g/L)。粉碎过60目筛,按料液比1:10加入蒸馏水,于121 ℃高压蒸汽灭菌锅中提取1.5 h,冷却后过滤出滤液,重复上述操作2次,合并滤液进行减压浓缩、醇沉,离心冻干后得胞内粗多糖,记作IPS。
1.3.3 含量的测定
多糖含量的测定采用苯酚-硫酸法。参考标准NY/T 1676-2008绘制葡萄糖标准曲线,Y=10.003X-0.022(R2=0.996)。将干燥至恒重的粗多糖研磨成粉末,精确称取0.50 g用蒸馏水溶解并定容至100 mL,按照葡萄糖标准品的苯酚-硫酸法浓度测定步骤,测定样品490 nm处吸光度,对照标准曲线,计算多糖含量(C,g/100 g)。并由此计算出多糖产量(Y,g/L):

其中,C为多糖含量;m为粗多糖EPS或IPS的重量,g;V是发酵液体积,L。
蛋白质含量的测定采用考马斯亮蓝G-250法。
1.3.4 粗多糖除蛋白
采用酶-Sevag法去除粗多糖EPS和IPS中蛋白质。将干燥粗多糖制成1.00%(m/V)的多糖水溶液,加入多糖质量3.00%的中性蛋白酶,调节pH到7.0,42 ℃酶解3 h。室温下将多糖水溶液和Sevag试剂[氯仿:正丁醇=4:1(V/V)]按 4:1体积比混合,充分振摇,4000 r/min离心15 min,收集上层水相。重复上述步骤直至水相和有机相间无明显白色粘稠物质,期间取上层水相,用超微量分光光度计扫描其在220~400 nm波长内吸光度,确保在260 nm和280 nm处无明显的吸收峰。最后将除蛋白的多糖水溶液浓缩、醇沉,冷冻干燥得到除蛋白的多糖样品DEPS和DIPS。苯酚-硫酸法检测多糖含量(p,%),计算多糖损失率(L,%)。

式中,L为多糖损失率;md为DEPS或DIPS产量,g/L;p为DEPS或DIPS的纯度;Y为式(1)中对应EPS和IPS的产量,g/L。
1.3.5 多糖的柱层析分离纯化
选用 26 mm×30 cm玻璃层析柱,称取 50.00 g DEAE-52粉末,超纯水浸泡过夜,装柱,0.01 mol/L pH 7.8的PBS溶液平衡柱子。准确称取200 mg去除蛋白的多糖粉末溶于10 mL超纯水中,0.45 μm微孔滤膜过滤上样,依次用PBS、0.10 mol/L NaCl-PBS、0.20 mol/L NaCl-PBS、0.30 mol/L NaCl-PBS溶液各125 mL进行梯度洗脱,洗脱流速为1.0 mL/min,每5 mL收集一管[32]。
苯酚-硫酸法测定每管490 nm波长处吸光度,以收集的管号对应吸光值作图得洗脱曲线,根据出峰情况收集各组分,浓缩、透析,醇沉后冻干。
将多糖含量最多的组分用Sephadex G-200进一步分离纯化,流动相选用0.10 mol/L NaCl溶液,上样前柱子用流动相平衡10 h。超纯水溶解多糖组分制成20 mg/mL溶液,1 mL上样,流速为0.3 mL/min,3 mL/管,收集液用苯酚-硫酸法检测多糖含量,绘制洗脱曲线,合并同一色谱峰的各管收集液为单一组分,浓缩、透析,醇沉冻干备用,分别记PEPS和PIPS。
1.3.6 红外光谱分析
取充分干燥的纯化多糖组分2.00 mg,分别与KBr混合,研磨后压片,放入傅里叶变换红外光谱仪内进行扫描,扫描区间为400~4000 cm-1。
1.3.7 液体发酵黑木耳多糖抗氧化活性研究
1.3.7.1 还原能力的测定
吸取0.5、1.0、2.0、5.0、10.0和20.0 mg/mL的纯化多糖组分溶液各2.5 mL,分别加入2.5 mL PBS缓冲液(0.2 mol/mL,pH=6.6)和2.5 mL 1%的铁氰化钾,混匀后于50 ℃水浴反应20 min。向反应液加入2.5 mL 10%的三氯乙酸,混匀后1000 r/min离心10 min,取5.0 mL上清液,加入5.0 mL蒸馏水和1.0 mL 0.1%三氯化铁溶液,混匀后静置10 min测定700 nm处吸光度[33]。用相同浓度的抗坏血酸(Vc)水溶液作阳性对照,每个浓度三个平行,取平均值(下同)。1.3.7.2 羟基自由基清除能力测定
番红在520 nm处有最大紫外吸收峰,通过利用H2O2与Fe2+反应产生羟基自由基(·OH)可特异地使番红褪色原理,根据番红褪色程度来表示羟基自由基含量[33]。吸光度越大,表明羟基自由基含量越少,样液清除羟基自由基能力越强。
配制反应体系,总体积为10.0 mL,包括1.0 mL PBS缓冲液(150 mmol/mL,pH=7.4),2.0 mL番红溶液(520 μg/mL),1.0 mL EDTA-Na2-Fe2+溶液(6 mmol/mL),0.8 mL新鲜配制0.3% H2O2溶液,0.5 mL不同浓度(0.5~20.0 mg/mL)的多糖溶液和4.7 mL蒸馏水。40 ℃恒温水浴30 min,取出冷却20 min后测定520 nm处吸光度Ai。对照组不添加多糖溶液,吸光度记Ac;空白组以蒸馏水代替H2O2和多糖溶液,吸光度记A0。以相同浓度的Vc水溶液作阳性对照。

1.3.7.3 DPPH自由基清除能力的测定
分别取 4.0 mL不同浓度多糖溶液(0.05~0.80 mg/mL)加入1.0 mL DPPH溶液(0.2 mmol/mL),震荡混匀,室温下避光静置30 min,测定517 nm处吸光度Ai;取4.0 mL不同浓度多糖溶液加1.0 mL无水乙醇作为空白组,摇匀后室温放置30 min,测定吸光度为A0;取4.0 mL DPPH溶液加1.0 mL无水乙醇作对照组,混匀后室温静置30 min,测定吸光度为Ac。相同浓度的Vc水溶液作阳性对照,操作方法同上。

1.3.7.4 超氧阴离子自由基清除能力的测定
取Tris-HCl(50 mmol/L,pH=8.2)缓冲液4.5 mL,25 ℃平衡 20 min,分别加入 0.1 mL不同浓度(0.05~0.50 mg/mL)的多糖溶液,然后加入0.2 mL 5 mmol/mL邻苯三酚溶液(10 mmol/L HCl溶液配制),混匀后25 ℃保温10 min,迅速加入10 mol/L HCl溶液1 mL终止反应,立即于320 nm下测吸光度记Ai。10 mmol/mL HCl代替邻苯三酚溶液做空白组,测定吸光度为A0;对照组以蒸馏水多糖溶液,吸光度为Ac。相同浓度的Vc水溶液作对照,操作方法同上。

1.3.8 多糖体外保湿性评价
参照文献[34,35],将纯化多糖和甘油分别用蒸馏水配成5%的溶液,选用60 mm培养皿(恒重),分别在培养皿内侧贴一层3 M医用透气胶带,分别吸取多糖溶液、甘油溶液、蒸馏水各500 μL点在透气胶带上,称重后放入25 ℃相对湿度60%的恒温恒湿箱内6 h,每隔1个小时称重一次,据与初始重量差计算保湿率:

注:M0为初始重量,g;Mt为取样点重量,g;t为取样时间,h。
1.3.9 统计分析
每个实验重复3次以上,试验数据采用Excel进行整理,再使用SPSS 17.0软件对数据进行差异显著性分析,以p<0.05和p<0.01判断差异显著性程度,实验结果以(mean±SD)表示。采用Origin 8.0软件进行数据分析作图。
2 结果与讨论
2.1 液体发酵黑木耳多糖含量
发酵结束后,得到粗多糖EPS 21.50±0.51 g/L,苯酚-硫酸法检测得胞外多糖的含量为48.79±0.11 g/100 g,由公式(1)得胞外多糖产量为10.49±0.27 g/L,显著高于其他黑木耳品种液体发酵胞外多糖产量[24~29]。冻干菌丝体产量为24.78±0.63 g/L,高压热水浸提得到粗多糖IPS产量为4.23±0.03 g/L,苯酚-硫酸法检测胞内多糖的含量为72.13±0.17 g/100 g,胞内多糖产量为3.05±0.03 g/L。醇沉所得EPS和IPS中蛋白质含量分别为7.96±0.61 g/L和0.67±0.06 g/L。酶-Sevag法脱除粗多糖EPS和IPS中蛋白质后得到DEPS和DIPS分别为9.83±0.27 g/L 和2.79±0.04 g/L,苯酚-硫酸法检测DEPS和 DIPS中多糖含量分别为 95.22±0.91%和98.50±0.30%,表明酶-Sevag法可以很好的脱除黑木耳液体发酵所得EPS和IPS中蛋白质。由公式(2)计算胞外和胞内多糖损失率为 10.75±0.77%和10.06±0.67%,表明酶-Sevag法在脱蛋白提高多糖纯度的同时会造成一定的多糖损失,分析原因可能是部分糖链与蛋白质共价相连构成糖蛋白而被去除。考马斯亮蓝法测定 DEPS和 DIPS中蛋白质含量分别为0.43±0.17 g/L和0.03±0.01 g/L,这些未被完全去除蛋白质的存在使得多糖纯度达不到100%。
2.2 多糖分离纯化
DEAE-52纤维素柱层析对200 mg DEPS和DIPS分离纯化结果见图1。由洗脱曲线可以看出,DEPS(a)只有一个主峰(DEPS-I),分析原因可能是优化的培养基和培养条件在提高胞外多糖产量的同时可使其组分更加单一化。DIPS(b)的在PBS洗脱液中有一个主峰(DIPS-I),另在0.10 mol/L NaCl-PBS和0.20 mol/L NaCl-PBS洗脱液中有2个小峰(DIPS-II和DIPS-III)。分别收集DEPS和DIPS最多的组分DEPS-I和DIPS-I,经浓缩、透析、醇沉后得冻干样品167.64±3.48 mg和132.72±2.64 mg,回收率分别为 83.82±1.74%和66.36±1.32%。
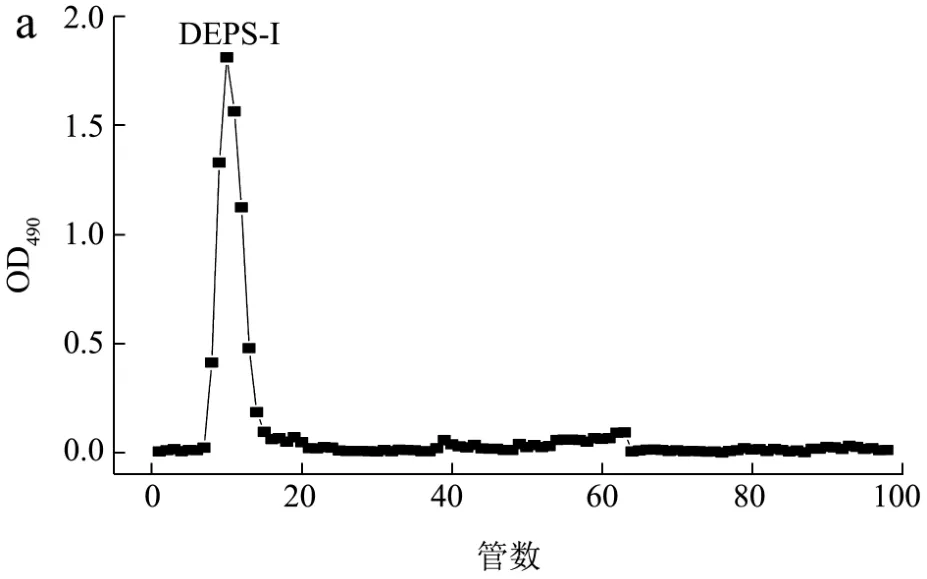
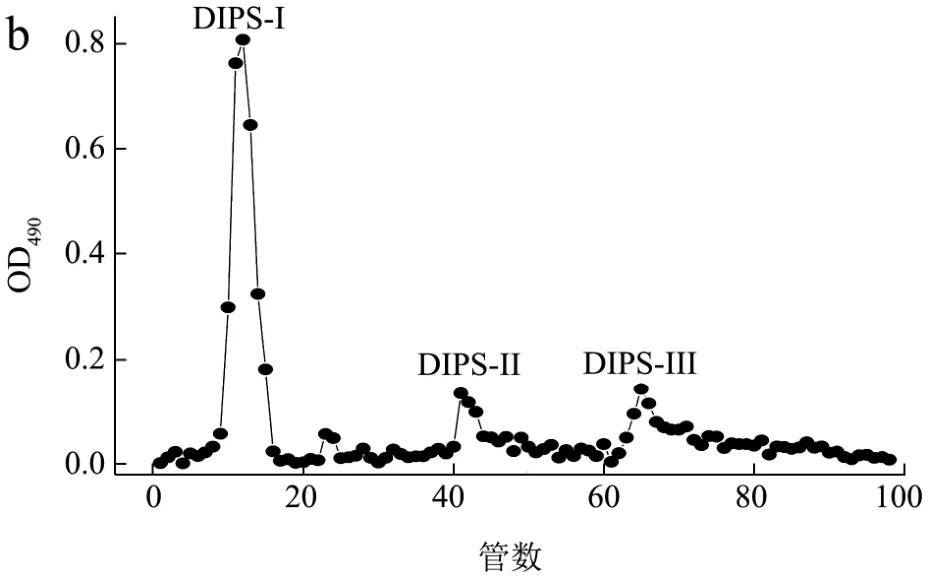
图1 除蛋白多糖DEPS(a)和DIPS(b)的DEAE-52柱层析洗脱曲线Fig.1 Elution profile of the deproteinized polysaccharide DEPS(a) and DIPS (b) by column chromatography of DEAE-52

图 2 多糖分离组分DEPS-I(a)和 DIPS-I(b)的 Sephadex G-200柱层析纯化曲线Fig.2 Sephadex G-200 column chromatographic purification curves of the polysaccharide components DEPS-I (a) and DIPS-I (b)
将DEPS-I和DIPS-I用Sephadex G-200进一步分离纯化,洗脱曲线如图2。可以看出,DEPS-I和DIPS-I组分都是单峰,表明采用 DEAE-52分离所得 DEPS和DIPS各组分是可靠的。从峰形来看,DIPS-I的峰型较DEPS-I的对称性好且峰宽,表明DIPS-I组分的分子量分布较 DEPS-I的广。分别收集 DEPS-I和DIPS-I经 0.10 mol/L NaCl溶液洗脱的第7~20管和5~20管,经浓缩、透析、醇沉后得冻干样PEPS和PIPS。
称重后计算回收率分别为 93.63±2.76%和95.85±2.02%,表明 DEPS-I和 DIPS-I纯度较高,即DEAE-52对黑木耳液体发酵多糖组分的分离效果好。因此,在后续的黑木耳液体发酵多糖应用中可只用DEAE-52进行一次分离纯化,既可节省时间又能节约成本。
2.3 红外光谱分析

图3 多糖组分PEPS(a)和PIPS(b)的红外光谱图Fig.3 FT-IR spectra of PEPS (a) and PIPS (b)
PEPS和PIPS红外光谱官能团分析见图3。PEPS(a)和PIPS(b)的峰型基本一致,且与已报道的黑木耳子实体多糖[37~39]、固体发酵菌质多糖[36]以及液体发酵胞外多糖[29]的红外图谱相似,PEPS(a)和PIPS(b)分别在3396.09 cm-1和3398.01 cm-1处有强的O-H伸缩振动吸收峰,在2925.53 cm-1和2927.46 cm-1处具有C-H伸缩振动峰,这两处吸收峰为多糖类物质的典型特征峰[29,36,37]。PEPS(a)和 PIPS(b)在 1654.65 cm-1处吸收峰可能由 C=O伸缩振动导致[37],或因存在结合水[38,40]或少量蛋白质[41]。PEPS(a)和PIPS(b)分别在1407.80 cm-1和1411.66 cm-1处有C-H变角振动吸收峰,在1200~1000 cm-1范围内各有三个由C-O-H和吡喃糖环C-O-C中C-O伸缩振动引起的吸收峰,说明 PEPS和 PIPS是吡喃型多糖[29,36,37,39,41];PEPS和PIPS分别在931.46 cm-1和935.32 cm-1处有吸收峰,与 β-糖苷键的存在有关,推测黑木耳液体发酵 PEPS和PIPS为β-构型[38]吡喃糖。此外,PIPS在1243.88 cm-1处有S=O对称拉伸振动吸收峰[42],表明PIPS中存在硫酸根。
2.4 多糖的抗氧化活性研究
2.4.1 还原力

图4 黑木耳液体发酵PEPS和PIPS还原力Fig.4 The reducing power of PEPS and PIPS from submerged fermentation of A. heimuer
由图4可知,在0.5~20.0 mg/mL的浓度范围内,黑木耳纯化PEPS、PIPS的还原力与其浓度均呈良好的线性关系(YPEPS=0.1129+0.0984X,R2=0.9996;YPIPS=0.1040+0.0598X,R2=0.9983),随着浓度的增加,还原力逐渐增强。在检测浓度范围内,DEPS的还原力极显著高于PIPS的(p<0.01),且随着浓度的增加差异性越来越大,这与已报道的未纯化黑木耳液体发酵胞外和胞内多糖还原力比较结果相反[27],推测原因可能是所用培养基组成不同,改变了PEPS的单糖组成[29],从而提高了其还原力。与 Vc相比,PEPS和PIPS还原力均显著低于同浓度的Vc,这与已有报道一致[26,27]。
2.4.2 对羟自由基(·OH)清除能力
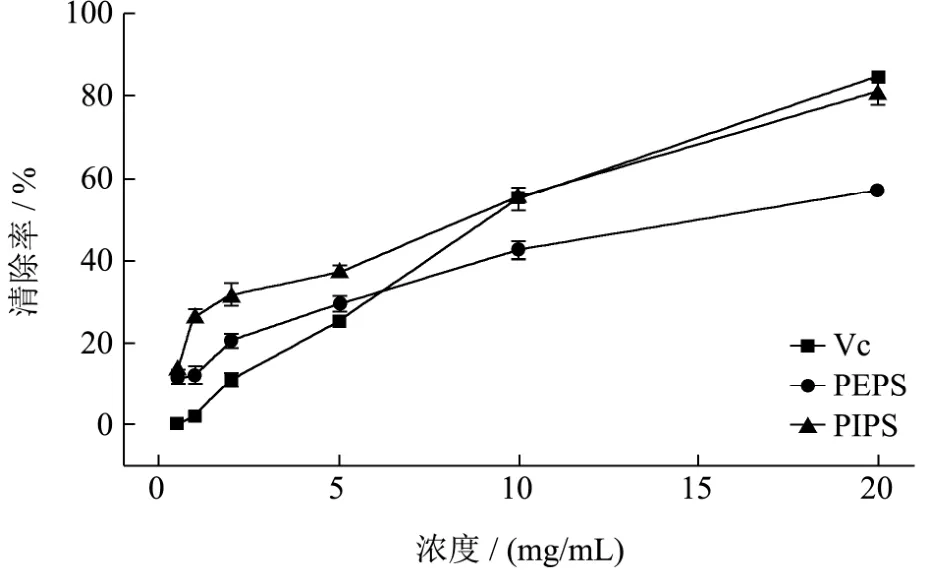
图5 黑木耳液体发酵PEPS和PIPS对羟基自由基的清除效果Fig.5 Scavenging capacity of PEPS and PIPS from submerged fermentation of A. heimuer on hydroxyl free radicals
浓度在0.5~20.0 mg/mL之间,各样品的羟基自由基清除率随着浓度的增加而增大(图5)。当浓度在0.5~5.0 mg/mL范围内时,PEPS和PIPS的羟基自由基清除能力均显著高于 Vc(p<0.01);在浓度大于 5.0 mg/mL时,PEPS的羟基自由基清除能力极显著低于 Vc(p<0.01),而 PIPS的清除能力与 Vc差异不显著(p<0.05),清除率为81.03±2.92%,表明PIPS抗氧化力较强。在检测浓度范围内PIPS的清除能力始终高于PEPS,表明黑木耳液体发酵胞内多糖羟基自由基清除能力显著高于胞外多糖的,与报道未纯化液体发酵胞内和胞外多糖清除羟基自由基能力比较结果一致[27]。
2.4.3 对DPPH自由基清除能力
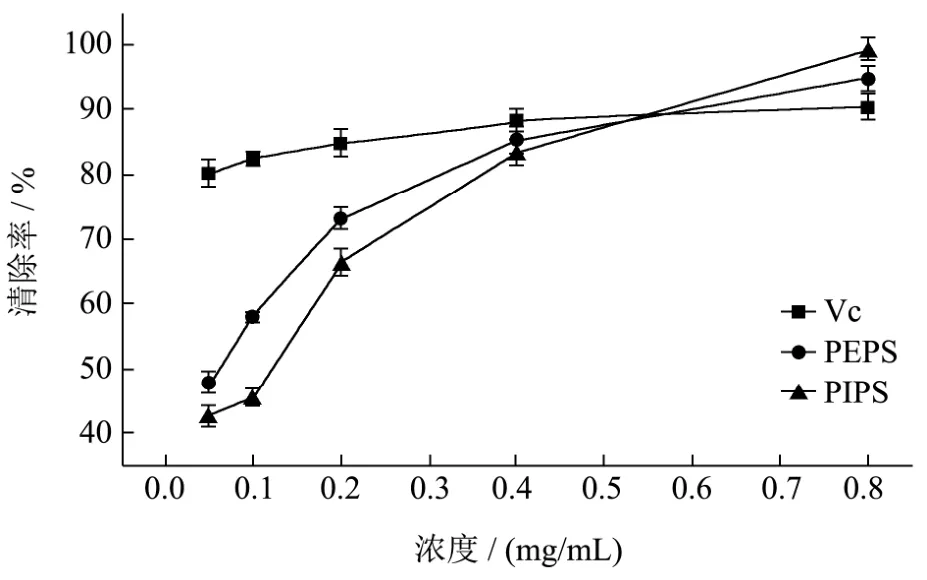
图6 黑木耳液体发酵PEPS和PIPS对DPPH 自由基的清除效果Fig.6 Scavenging capacity of PEPS and PIPS from submerged fermentation of A. heimuer on DPPH free radicals
由图6可知,随着浓度的增加,Vc、PEPS和PIPS对DPPH自由基清除能力均有所增加,其中PEPS和PIPS增加幅度明显大于Vc。当浓度在0.05~0.4 mg/mL时,DPPH 自由基清除能力为 Vc>PEPS>PIPS,而当浓度大于0.4 mg/mL时,PEPS和PIPS的DPPH自由基清除能力迅速增强超过Vc的,其中PIPS的DPPH自由基清除清除率显著高于PEPS和Vc的(p<0.05),最高为98.77±1.73%。PIPS较强的DPPH自由基清除能力,可能是因为其得电子能力更强,与DPPH自由基上电子结合更快,从而使其清除率更高[33]。
2.4.4 对超氧阴离子自由基(O2-·)清除能力

图7 黑木耳液体发酵PEPS和PIPS对超氧阴离子自由基的清除效果Fig.7 Scavenging capacity of PEPS and PIPS from submerged fermentation of A. heimuer on superoxide anion free radicals
由图7可知,当浓度在0.05~0.5 mg/mL范围内时,Vc、PEPS和PIPS对超氧阴离子自由基清除能力随着浓度的增加而提高。当浓度≤0.2 mg/mL时,PIPS的超氧阴离子自由基清除能力显著高于PEPS的(p<0.05),但清除率仅为68.20±0.86%;而当浓度≥0.3 mg/mL时,PEPS的超氧阴离子自由基清除率超过PIPS,当浓度为0.5 mg/mL时,PEPS的超氧阴离子自由基清除率最高为85.79±1.60%,显著高于PIPS的(p<0.05),这与已报道未纯化胞内和胞外多糖的研究结果一致[27]。
2.5 多糖的保湿性评价
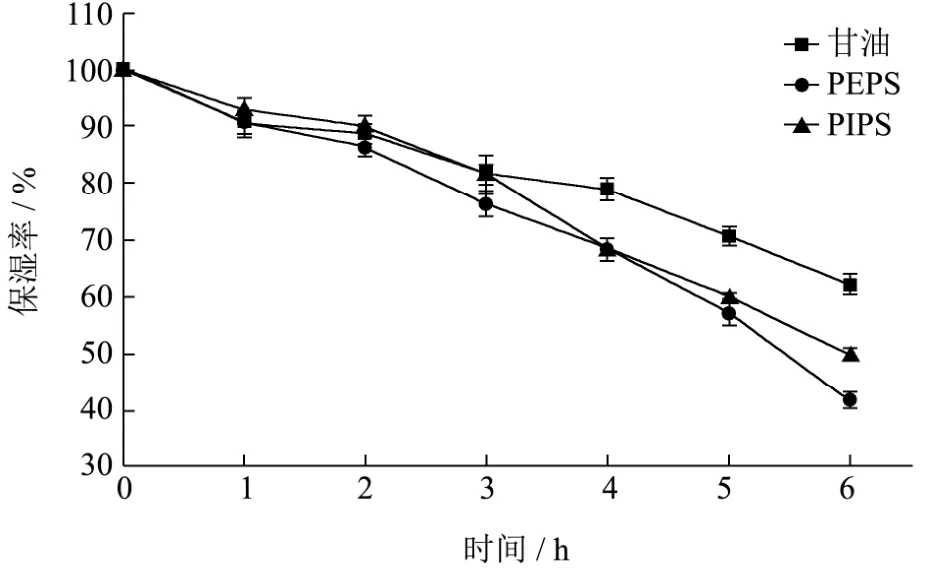
图8 黑木耳液体发酵PEPS和PIPS的保湿效果Fig.8 Moisturizing effect of PEPS and PIPS from submerged fermentation of A. heimuer
25 ℃相对湿度60%条件下5%的PEPS、PIPS溶液以及5%甘油溶液在一定时间内的保湿率如图8所示。随时间延长,3种样品的保湿性均呈下降趋势,比较检测周期内PEPS和PIPS的保湿率发现:6 h内,PIPS的保湿率均高于PEPS的,但仅在第3 h和第6 h表现出明显的优势(p<0.01),表明纯化所得黑木耳液体发酵胞内多糖保湿效果稍优于胞外多糖的,推测可能是PIPS含有较多的羟基等亲水性基团,能够吸附更多的水分子,从而表现出更好的保湿效果。与 5%甘油溶液相比,PIPS在1~3 h内保湿率高于甘油的,虽差异不显著,但5% PIPS 3 h后保湿率仍在80%以上(81.63±2.09%),表明纯化的液体发酵黑木耳胞内多糖3 h内具有良好的保湿效果。
3 结论
利用优选的黑木耳菌株和优化培养基进行液体发酵获得胞外和胞内粗多糖产量分别为 10.49±0.27 g/L和3.05±0.03 g/L,经除蛋白与分离纯化获得单一的纯化组分PEPS和PIPS,通过红外光谱官能团分析推测二者均为β-构型吡喃糖。比较2种多糖组分的抗氧化活性和保湿性发现,PEPS在还原力、超氧阴离子自由基清除能力方面优于PIPS,而PIPS在DPPH自由基、羟基自由基清除能力以及保湿性能方面优于PEPS。本研究为黑木耳液体发酵多糖不同组分的合理利用提供依据,为它们在食品、化妆品等方面的应用奠定了理论基础。

