玉米与赤霉素对向日葵列当种子萌发、防除以及对后茬作物向日葵生长的影响*
王 玥, 叶晓馨, 王 恺, 李朴芳, 郭振国, 陈芳洁, 马永清,**
玉米与赤霉素对向日葵列当种子萌发、防除以及对后茬作物向日葵生长的影响*
王 玥1, 叶晓馨2, 王 恺1, 李朴芳3, 郭振国1, 陈芳洁1, 马永清1,3**
(1. 西北农林科技大学林学院 杨凌 712100; 2. 安徽大学资源与环境工程学院 合肥 230601; 3. 中国科学院水利部水土保持研究所黄土高原土壤侵蚀与旱地农业国家重点实验室 杨凌 712100)
向日葵列当(Wallr.)是一种根寄生草本植物, 对向日葵等经济作物造成严重危害。为了减少向日葵列当对向日葵的寄生, 降低土壤中向日葵列当种子库, 本试验以新疆地区广泛种植的玉米品种‘京糯一号’和‘新玉57号’为研究材料, 通过穴盘试验研究在不同时期(出苗后10 d和15 d)施加两种不同浓度赤霉素(10-4mol·L-1和10-5mol·L-1)对上述两个品种玉米生长发育和分泌列当萌发刺激物质的影响; 24 d后收集并提取玉米根系分泌物, 用其进行刺激向日葵列当种子的萌发试验, 从而筛选出刺激向日葵列当种子萌发能力较强的玉米品种进行盆栽试验。通过盆栽试验, 在玉米种植后的不同时期(20 d和40 d)喷施10-4mol·L-1赤霉素以探究玉米与赤霉素共同防除向日葵列当种子的效果, 收获时(105 d后)采集玉米地上部、根和根际土样品, 用其甲醇浸提液刺激向日葵列当种子萌发; 次年在种植过玉米的盆中种植后茬作物向日葵, 收获时测定向日葵的农艺指标并统计向日葵列当的出土数。结果表明: 穴盘试验中施加赤霉素对玉米的株高有显著增高作用, 对玉米根系分泌萌发刺激物质没有抑制作用, 即在玉米生长时期可以施加10-4mol·L-1和10-5mol·L-1赤霉素。此外, ‘新玉57号’根系分泌物的100倍稀释液刺激向日葵列当种子的萌发率显著高于‘京糯一号’, 因此选取‘新玉57号’作为盆栽试验的玉米品种。盆栽试验中不同时期施加10-4mol·L-1赤霉素, 玉米株高同样显著高于对照, 增长率分别为22.5%、19.1%。次年种植后茬作物向日葵, 在第20 d向玉米施加赤霉素处理的盆中种植的向日葵的花盘直径比对照(种植玉米时不施加赤霉素)显著增加57.1%。与对照相比, 在种植玉米后的20 d和40 d施加赤霉素的处理种植向日葵, 向日葵列当的出土数分别是1.3个·盆-1、1.8个·盆-1, 分别降低76.4%和67.3%。因此, 可以在玉米种植的后20 d和40 d施加10-4mol·L-1赤霉素, 与玉米共同诱导向日葵列当种子“自杀发芽”, 以减少向日葵列当对向日葵植株的危害。
向日葵列当; 种子萌发; 玉米; 赤霉素; 根系分泌物
列当(spp.)为列当科(Orobanchaceae)列当属(L.)根寄生植物, 主要分布于中低纬地区, 包括: 非洲、地中海地区、欧洲中东部、中东地区、亚洲以及美洲的部分地区[1]。杂草列当种类繁多, 对我国危害较严重的有向日葵列当(Wallr.)、瓜列当(Pers.)、分枝列当(L.)、小列当(Sm.)和弯管列当(Loefl.)。列当的寄主主要分布在菊科(Asteraceae)、豆科(Leguminosae)、葫芦科(Cucurbitaceae)、茄科(Solanaceae)、十字花科(Cruciferae)、伞形科(Umbelliferae)及大麻科(Cannabaceae)等植物中[2]。由于缺乏叶绿素, 无法进行光合作用, 列当的生长必须依赖从寄主植物根系吸取水分和营养物质来完成自身的生命活动[3]。列当种子接触到寄主根部分泌的萌发刺激物质, 并在其诱导下开始发芽, 接着在吸器诱导物质的作用下形成吸器, 然后寄主植物根部的维管组织与吸器连接从而形成寄生关系[4]。
列当种子十分细小且数量庞大, 据报道瓜列当每枝平均生产种子3.8万粒, 每株产生大约11.4~114.0万粒(每株3~30枝), 向日葵列当每株平均生产17.4万粒[5]。新疆是我国遭受列当危害较严重的地区, 2011年伊犁疫区向日葵(L.), 被向日葵列当寄生后, 千粒重较健康植株减少55%以上, 此外单株向日葵被向日葵列当寄生15株以上, 向日葵的株高、茎粗以及花盘直径较健康植株也均降低65%以上[6]。同时, 在南疆加工番茄(Mill)种植区, 瓜列当造成加工番茄减产30%~80%[7]。由于列当是根寄生杂草, 在列当地下生长阶段就已经对寄主植物的生长造成了严重影响, 因此, 防除列当的关键时期就是地下生长阶段。目前, 防除列当的措施主要是人工拔除、喷施除草剂[8-9]、微生物防治[10-11]以及利用诱捕作物[12-13]等。
寄主与非寄主植物均可以分泌诱导列当种子萌发的化学物质[14-15]。玉米(L.)作为列当的非寄主, 在其根系分泌物中分离出列当种子萌发刺激物质[16]。像玉米这类可以分泌萌发刺激物质诱导列当种子萌发但不会被列当寄生的作物称为“诱捕作物”[17]。若将玉米种植在含有列当种子的土壤中, 列当种子在玉米分泌的萌发刺激物质的诱导下发芽, 但是由于没有与玉米形成寄生关系, 无法获得水分与养分, 从而“自杀发芽”[18]。玉米刺激列当种子萌发的能力受品种的影响[19]。同时, 玉米作为全世界产量前三的粮食作物, 种植面积大, 收获后玉米秸秆可以作为生活能源、工业原料及反刍动物的饲料[20]。
赤霉素作为植物激素可以促进植物茎秆的伸长、打破种子休眠、促进种子的萌发。白菜(Rupr.)经过外源赤霉素处理, 在形态方面促进了茎的伸长, 在生理方面增加了可溶性糖和可溶性蛋白的含量[21]。赤霉素与其他植物激素之间存在相互协同的作用, 研究表明赤霉素通过刺激生长素运输增加了生长素在茎中的含量, 并且在细胞生长方面赤霉素与生长素具有共同的转录组[22]。有报道指出, 在向日葵列当种子预培养过程中, 加入10-4mol·L-1赤霉素溶液, 可以打破向日葵列当种子的二次休眠, 使其仍保持较高的发芽率[23]。也有研究发现将油菜素类固醇与赤霉素一起施用, 诱导更多的小列当种子“自杀发芽”以期减少小列当对寄主的侵染[24]。前期研究表明, 在预培养阶段外源施加赤霉素可以打破列当种子进入二次休眠并提高列当种子对发芽刺激物质的响应[23]。本研究通过穴盘和盆栽试验的方式验证上述结果应用于生产的可行性。通过种植玉米后施加赤霉素溶液, 打破土壤中向日葵列当种子的休眠, 增强向日葵列当种子对玉米根系分泌物的敏感程度, 以期达到加速诱导土壤中向日葵列当种子的“自杀发芽”的目的。
新疆南疆地区位于天山与昆仑山之间的塔里木盆地, 属温带大陆性气候区, 其气候特点为昼夜温差大、光照时间长, 干旱且降雨量稀少。由于地理位置及气候环境的特殊性, 玉米种植时间始于3月中下旬, 种植方式采用精量点播机向地膜中播种玉米, 结合滴灌带灌水。基于生产实际, 本研究采用诱捕作物玉米与喷施赤霉素相结合的方法, 首先通过比较两个玉米品种对向日葵列当种子萌发的刺激能力强弱从而筛选刺激萌发能力更强的玉米品种, 然后在此品种玉米生长的不同时期喷施赤霉素溶液, 研究诱捕作物玉米与赤霉素对土壤中向日葵列当种子的诱捕效果, 以减少向日葵列当对寄主植物向日葵造成的危害, 进而为向日葵列当的防除提供新思路。
1 材料与方法
1.1 穴盘试验
穴盘试验于恒温室中进行。供试玉米品种为‘京糯一号’和‘新玉57号’。试验穴盘中所用基质为蛭石, 穴盘规格为5´8, 穴内直径和深度各为5 cm、4 cm。试验共设5个处理, 每个处理3次重复。每穴中播种玉米2粒, 出苗后定苗1株。玉米生长的第10 d喷施10-4mol·L-1和10-5mol·L-1赤霉素, 分别记为10-4(1)和10-5(1); 第15 d喷施10-4mol·L-1和10-5mol·L-1赤霉素, 分别记为10-4(2)和10-5(2)及不施加赤霉素的处理(CK京糯和CK新玉)。生长期间保持蛭石表面湿润。24 d后收集活性炭并提取其中玉米根系分泌物用于刺激向日葵列当种子萌发, 通过统计向日葵列当种子萌发率的高低进而筛选出盆栽试验的供试品种; 同时测量不同处理玉米的株高、叶面积及称量地上部和根部生物量鲜重和干重。
穴盘中赤霉素溶液施加方法。将配制好的10-4mol·L-1、10-5mol·L-1赤霉素溶液用喷壶喷施在整个穴盘上, 每盘约50 mL。
玉米根际分泌物的提取方法。种植玉米前, 穴盘每穴底部放置一层无菌纱布, 将等量活性炭置于纱布上方, 并再放置一层纱布将其覆盖, 最后用蛭石填满穴盘并播种玉米。21 d后取出活性炭并加入100 mL超声3.0 min, 再用布氏漏斗抽滤直至滤液无杂质。将滤液中的丙酮蒸发出后剩余溶液转移至分液漏斗, 向分液漏斗中加入50 mL乙酸乙酯, 振荡摇匀后, 待静置分层。将下层的水接出, 向剩余的乙酸乙酯相中再加入50 mL乙酸乙酯, 上述过程重复3次。将3次得到的乙酸乙酯相(含有乙酸乙酯与有机物)混合在一起加入无水硫酸钠, 待水分完全被吸收后过滤。将滤液旋转蒸发直至蒸干后, 加入5.0 mL丙酮并超声1.0 min, 冷藏备用。
向日葵列当种子的消毒和预培养。将颜色较深、成熟度高的向日葵列当种子放置在底部具有纱网的容器中, 并将容器置于盛有1.0%次氯酸钠溶液的烧杯中, 烧杯放置在超声波清洗机中超声3.0 min同时用玻璃棒搅拌, 超声结束后用无菌水冲洗种子至水无色。接着放置于盛有75%的乙醇溶液的烧杯中, 后续步骤同上。将消毒好的列当种子置于无菌操作台中晾干备用。在直径为9 cm的培养皿中放入一层滤纸, 加入5 mL无菌水浸湿滤纸, 并将直径5 mm的玻璃纤维滤片(Whatman GF/A)叠放在滤纸上。将完成消毒的种子均匀撒在玻璃纤维滤片上(每片上约为20~40粒列当种子)。最后将培养皿用Parafilm封口膜封口置于25 ℃的恒温培养箱中暗培养3 d。
玉米根际分泌物刺激向日葵列当种子萌发试验。试验在超净工作台中进行。将制备好的样品提取液用移液枪吸取30 μL置于消毒过玻璃纤维滤片上, 放置30 min至甲醇充分挥发后, 将预培养3 d的向日葵列当种子置于其上方再加入30 μL的无菌水, 最后在培养皿中央放置浸湿的三角形滤纸片, 保持湿润。每个处理5个平行, 3次重复, 将培养皿封口置于25 ℃的恒温培养箱培养10 d后在显微镜下观察并统计向日葵列当种子发芽率。
发芽率=玻璃纤维滤纸上已发芽向日葵列当种子/玻璃纤维滤纸上全部种子×100% (1)
试验分别以1 mg·L-1GR24和无菌水的处理作为正对照和负对照。
1.2 盆栽试验

盆栽中赤霉素溶液施加方法。用滴管施加, 每盆施加10-4mol·L-1的赤霉素100 mL, 滴加时将表层3~5 cm土壤翻松, 均匀施加。
玉米根际土样品采集与浸提液制备。取距离玉米根系5 mm的根际土, 称取5.0 g于三角瓶中, 加入10 mL甲醇, 超声振荡30 min后过滤, 得到的滤液即为浸提液原液, 将原液用分析纯甲醇稀释10倍、100倍备用。
玉米地上部和根部样品的采集与甲醇浸提液的制备。将采集后的玉米植株样分地上部和根部烘干并粉碎, 粉碎样品称取0.1 g于1.5 mL的离心管中, 加入1 mL分析甲醇, 超声振荡30 min后用6 400 r∙min-1离心2 min, 所得上清液即为原液, 将原液用分析甲醇分别稀释10倍和100倍备用。
玉米地上部、根部及根际土刺激向日葵列当种子萌发试验。试验步骤按照上述1.1.4玉米根系分泌物刺激向日葵列当种子萌发试验方法进行。
1.3 数据处理
试验数据穴盘试验与盆栽试验结果分别为各处理的3次和6次重复测定值。将结果采用DPS统计软件进行单因素方差分析和二因素方差分析并用Tukey法多重比较。应用Sigmaplot作图软件将试验结果以柱状图显示。
2 结果与分析
试验所用向日葵列当种子在GR24处理下的萌发率(正对照)在95%以上, 无菌水(负对照)的处理下不能够萌发, 说明向日葵列当种子只有在萌发刺激物质的作用下, 才能正常萌发, 同时验证了试验所用向日葵列当种子活力较强, 品质较好, 可以用于萌发试验。
2.1 施加赤霉素对穴盘种植玉米生长的影响
玉米生长期间施加10-4mol·L-1或10-5mol·L-1赤霉素溶液对玉米株高有显著影响。穴盘种植两个品种玉米10 d后施加两种浓度的赤霉素均对玉米株高有显著影响(表1)。施加赤霉素对‘京糯一号’地上部鲜重无显著影响, 而‘新玉57号’第2次(播种15 d后)施加10-4mol·L-1赤霉素处理玉米地上部鲜重比对照显著增加51.3%。‘新玉57号’根部鲜重大于‘京糯一号’, 在‘新玉57号’各处理之间, 第2次施加赤霉素溶液处理的根部鲜重显著高于第1次施加的处理, 大小顺序为‘新玉57号’10-4(2)>10-5(2)>CK>10-5(1)>10-4(1)。
2.2 赤霉素浓度及喷施时间对玉米分泌萌发刺激物质的影响
两个玉米品种的根系分泌物原液刺激向日葵列当的萌发率均在60%以上(图1a), 可作为使向日葵列当“自杀发芽”的诱捕作物。‘京糯一号’和‘新玉57号’在施加10-4mol·L-1或10-5mol·L-1赤霉素后收集其根系分泌物刺激向日葵列当种子的萌发率与对照相比没有显著差异, 表明此两种浓度赤霉素不会抑制玉米根部分泌萌发刺激物质。此外, ‘新玉57号’在发芽后的10 d和15 d喷施10-4mol·L-1赤霉素处理向日葵列当种子的萌发率有显著差异, 分别为94.0%和74.2%。

表1 不同时间施加不同浓度赤霉素对玉米幼苗生长的影响
同列数据后不同小写字母表示Tukey法检验在<0.05水平差异显著。10-4(1)和10-4(2)分别代表玉米出苗后10 d和15 d施加10-4mol·L-1赤霉素, 10-5(1)和10-5(2)分别代表玉米出苗后10 d和15 d施加10-5mol·L-1赤霉素, CK代表施加水处理。Different lowercase letters in the same column indicate significant differences at< 0.05 level by Tukey test. 10-4(1) and 10-4(2) represent applied 10-4mol·L-1GA3at 10 days and 15 days after maize germination, respectively. 10-5(1) and 10-5(2) represent applied 10-5mol·L-1GA3at 10 days and 15 days after maize germination, respectively. CK represent applied water.
‘新玉57号’根系分泌物10倍稀释液刺激向日葵列当种子的萌发率仍均高于60%(图1b), 且各处理间没有显著差异, 其中在第10 d喷施10-4mol·L-1赤霉素处理向日葵列当种子萌发率达到89.5%, 各处理后的萌发率大小为: 10-4(1)>CK>10-5(1)>10-5(2)>10-4(2)。对于‘京糯一号’, 第15 d喷施10-4mol·L-1赤霉素与第10 d喷施10-5mol·L-1赤霉素的处理比其他3个处理间显著降低40%, 分别为36.6%和30.1%。
‘新玉57号’根系分泌物100倍稀释液刺激向日葵列当种子的萌发率均高于‘京糯一号’(图1c), 原因可能是‘京糯一号’的根系分泌物在此浓度下抑制萌发物质的浓度高于萌发刺激物质浓度, 因而萌发率降低。除15 d喷施10-5mol·L-1赤霉素以外, ‘新玉57号’各处理的萌发率均高于50%, 萌发率高低为: CK>10-4(1)>10-5(1)> 10-4(2)>10-5(2), 其中对照处理的萌发率为79%。‘京糯一号’各处理间均无显著差异, 且萌发率均低于30%。综合图1a、1b和1c可以看出, 两个玉米品种根系分泌物刺激向日葵列当种子萌发的总体趋势为随着浓度降低萌发率减小, 其中‘京糯一号’减小较明显。
此外, 将玉米品种与赤霉素的喷施对玉米根系分泌物原液刺激向日葵列当种子萌发的影响进行二因素方差分析, 玉米品种显著影响根系分泌物原液刺激向日葵列当种子的萌发率, 且玉米品种与赤霉素的喷施之间有显著的交互作用, 但是喷施赤霉素对向日葵列当种子萌发率没有显著影响, 说明在玉米生长过程中喷施赤霉素对玉米根系分泌刺激列当种子萌发的物质没有抑制作用, 因此在盆栽试验中选取刺激向日葵列当种子萌发能力更强的玉米品种‘新玉57号’作为盆栽试验的玉米品种。同时根据Ye等[23]研究表明在向日葵列当种子预培养阶段, 加入10-4mol·L-1的赤霉素可以打破向日葵列当种子的二次休眠, 同时提高向日葵列当种子对萌发刺激物质的响应程度, 试验将采取10-4mol·L-1的赤霉素作为盆栽试验施加的赤霉素浓度(表2)。
2.3 盆栽试验中喷施赤霉素对玉米生长的影响
不同时期喷施赤霉素对盆栽玉米株高有显著影响。种植玉米后的第20 d和第40 d喷施10-4mol·L-1赤霉素处理玉米株高分别比对照显著增加22.5%和19.1%。d40处理的玉米地上部干重较对照显著增加76.0%。此外, d20处理的玉米根部干重与d40、CK相比有显著差异, 大小顺序为: d40>CK>d20。造成差异的原因可能是在生长初期喷施赤霉素, 促进了茎的伸长生长, 减弱了根部的生长发育, 从而导致根部积累干物质受阻(表3)。
2.4 盆栽玉米植株样与根际土刺激向日葵列当种子萌发试验
‘新玉57号’玉米地上部植物样的甲醇浸提液10倍与100倍稀释液可以刺激向日葵列当种子萌发, 而原液刺激向日葵列当种子的萌发率低于1%(图中未列出)。玉米地上部甲醇浸提液10倍稀释液与100倍稀释液处理下向日葵列当种子的萌发率顺序为: d20>d40>CK(图2a), 萌发率达到最高的是d20处理下的100倍稀释液, 为45.3%, 且10倍稀释液刺激向日葵列当种子萌发的能力较100倍稀释液低。说明随着植物样提取液的稀释, 可能提取液中抑制向日葵列当种子萌发的物质也随之被稀释。d20与d40处理的萌发率均显著高于CK, 说明喷施赤霉素可能会促进玉米植株内部萌发刺激物质的合成与分泌。
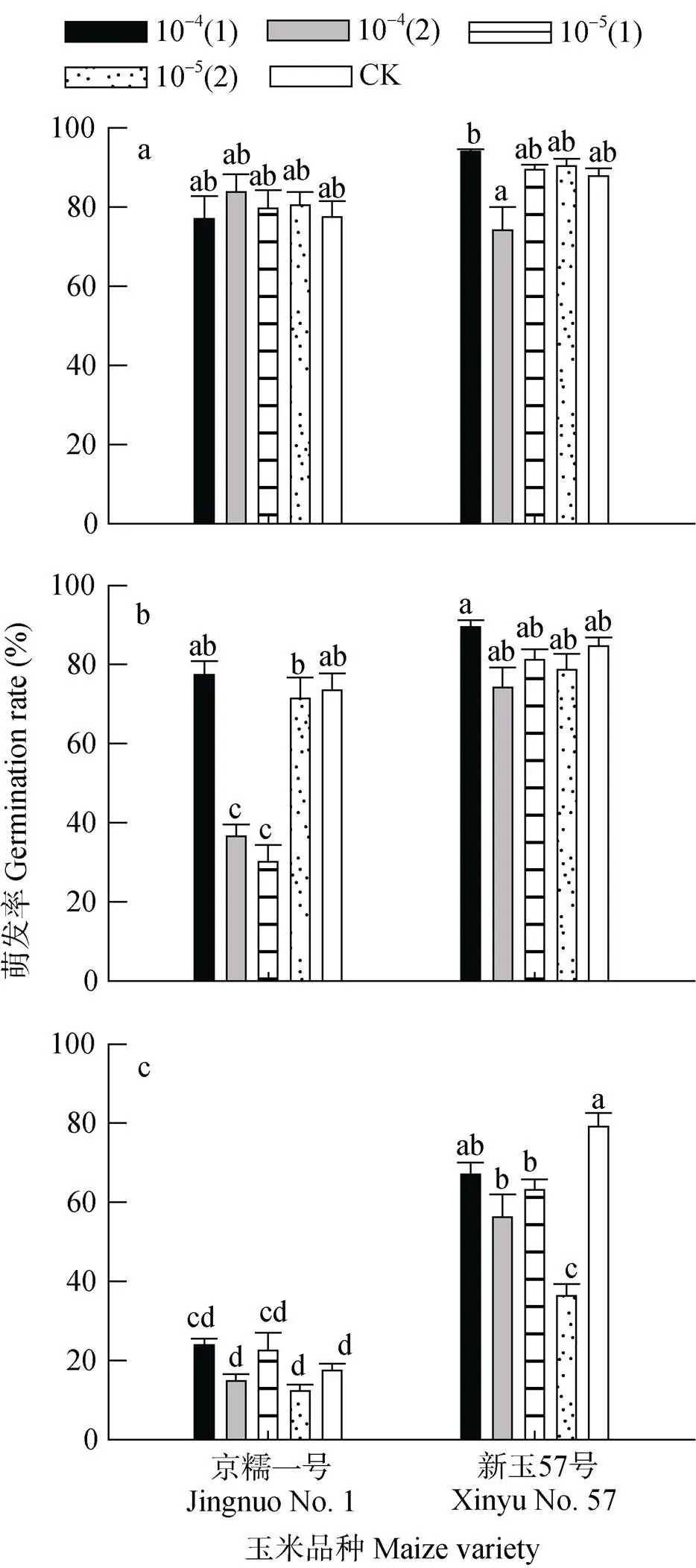
图1 不同时间施用不同浓度赤霉素下不同品种玉米根系分泌物原液(a)、10倍稀释液(b)和100倍稀释液(c)刺激向日葵列当种子的萌发率
两个玉米品种在一起进行多重比较, 不同小写字母表示处理间差异显著(<0.05)。10-4(1)和10-4(2)分别代表玉米出苗后10 d和15 d施加10-4mol·L-1赤霉素, 10-5(1)和10-5(2)分别代表玉米出苗后10 d和15 d施加10-5mol·L-1赤霉素, CK代表施加水处理。Two maize varieties were multiple compared. Different small letters mean significant difference among different treatments at 0.05 level. 10-4(1) and 10-4(2) represent applied 10-4mol·L-1GA3at 10 days and 15 days after maize germination, respectively. 10-5(1) and 10-5(2) represent applied 10-5mol·L-1GA3at 10 days and 15 days after maize germination, respectively. CK represent applied water.
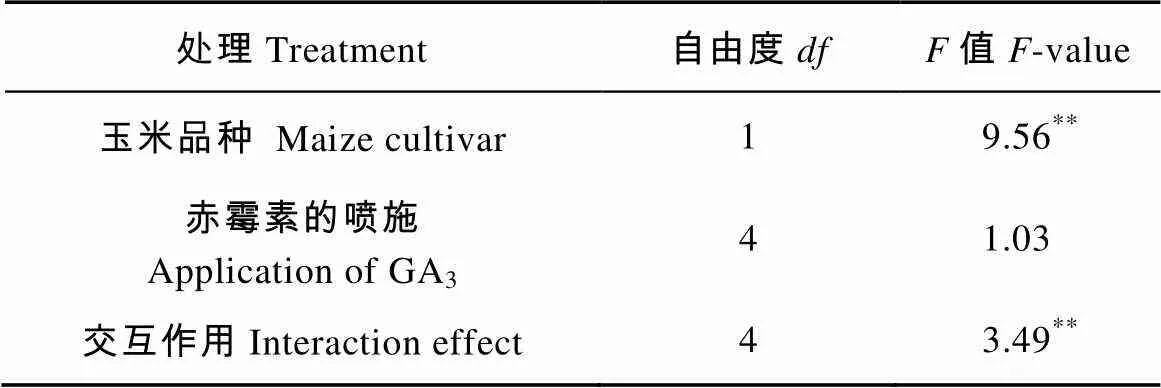
表2 玉米品种及喷施赤霉素对向日葵列当发种子萌发率影响的方差分析结果
*和**分别表示在<0.05和<0.01水平影响显著。* or ** show significant effects at< 0.05 or< 0.01 levels, respectively.
玉米根部甲醇浸提液100倍稀释液刺激向日葵列当种子的萌发率大于10倍稀释液(图2b)。在10倍稀释液中, 各处理间无显著差异。d20和d40处理的玉米根部浸提液100倍稀释液刺激向日葵列当种子的萌发率均高于50%, 分别是51.7%和51.1%, 显著高于对照, 较对照分别增加了46.5%和44.8%。
利用根际土刺激列当种子萌发是一种鉴定植株是否含有并能够分泌列当种子萌发刺激物质的一类方法。玉米根际土刺激向日葵列当种子的萌发率高低顺序为: 原液>10倍液>100倍液, 且相同处理的不同倍数稀释液刺激向日葵列当种子萌发率也依次降低。根际土甲醇浸提液原液刺激向日葵列当种子的萌发率均在40%以上, d40处理的根际土原液刺激向日葵列当种子萌发率最高, 为47.5%, d20和d40处理分别较对照增加10.3%和13.4%。10倍稀释液与100倍稀释液中, d40处理的向日葵列当种子的萌发率与对照之间有显著差异。100倍稀释液下, d20和d40处理的向日葵列当种子萌发率均低于20%, 表明‘新玉57号’玉米根系分泌物稀释到100倍时, 萌发刺激物质的浓度也随之被降低。
2.5 盆栽试验中玉米喷施赤霉素对下茬作物向日葵生长的影响
向日葵列当的寄生严重影响了向日葵的生长。含有向日葵列当种子但不喷施赤霉素处理(CK)比不含有向日葵列当种子也不喷施赤霉素处理(PC)的向日葵花盘鲜重和花盘直径显著降低75.8%、62.5%。d20处理的向日葵花盘直径显著高于CK, 增加了133.0%。d40处理的向日葵花盘鲜重和花盘直径分别为41.8 g和5.9 cm, 较CK增加了52.0%和63.9%。此外, 喷施赤霉素对向日葵地上部与根部的鲜干重均无显著影响, 但CK地上部鲜重、根部鲜重与干重的均值都低于其他3个处理。由于赤霉素是种植前茬诱捕作物玉米时施加, 因此对向日葵的株高均无显著影响(表4)。
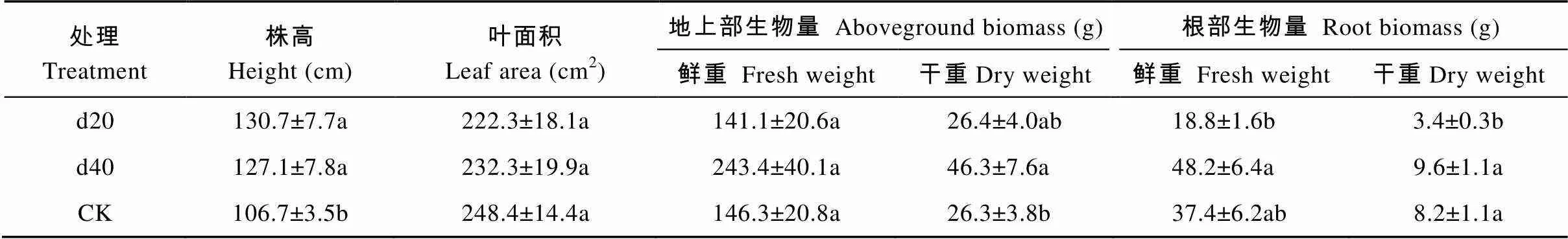
表3 不同时期喷施赤霉素对盆栽玉米生物量的影响
d20、d40分别代表种植玉米后的第20 d和第40 d施加赤霉素, CK代表不施加赤霉素。同列数据后不同小写字母表示Tukey法检验在<0.05水平差异显著。d20 and d40 represent applying GA3at the 20thday and the 40thday after planting maize, respectively. CK represents no applying GA3. Different lowercase letters in the same column indicate significant differences at< 0.05 level by Tukey test.
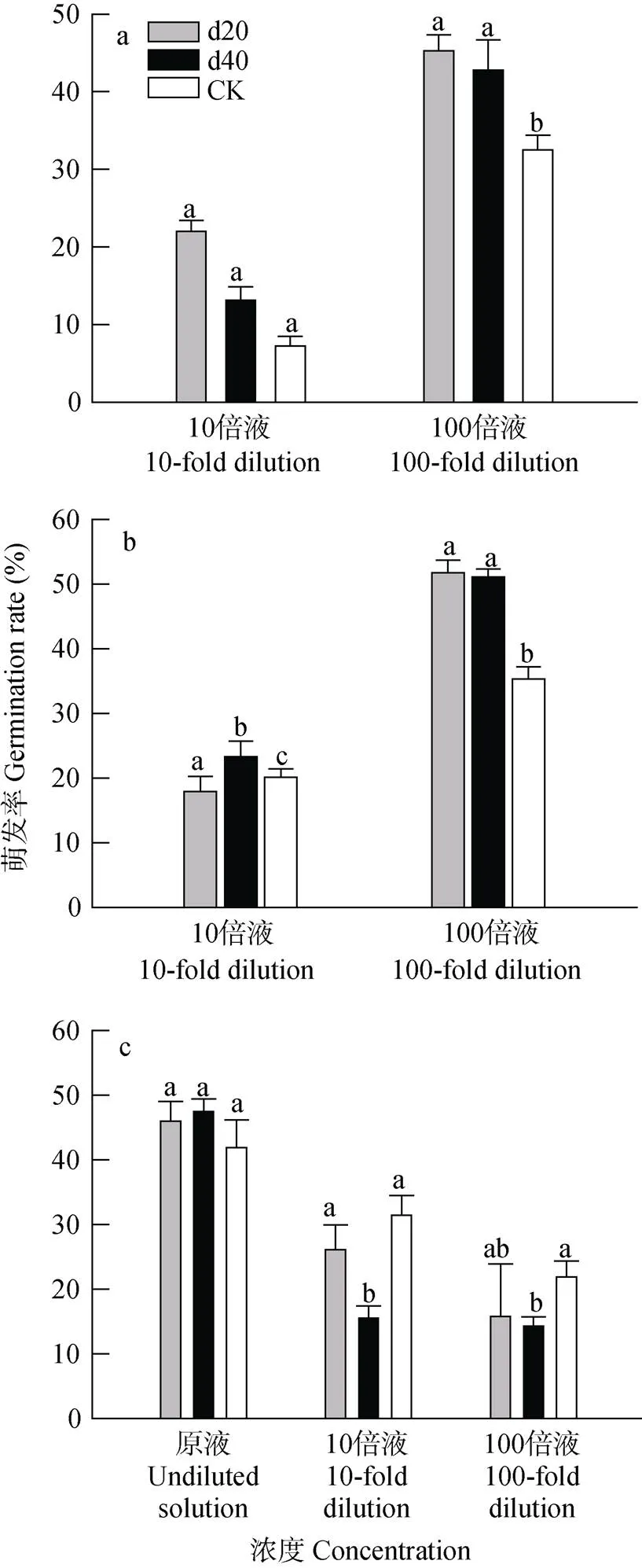
图2 不同时间施加赤霉素的盆栽玉米地上部(a)、根部(b)和根际土(c)甲醇浸提液刺激向日葵列当种子的萌发率
不同小写字母表示处理间差异显著(<0.05), d20和d40分别代表玉米播种后20 d和40 d施加10-4mol·L-1赤霉素, CK代表不施加赤霉素。Different lowercase letters mean significant differences among different treatments at 0.05 level. d20 and d40 represent applying 10-4mol·L-1GA3at 20 days and 40 days after sowing of maize, respectively. CK represent not applying GA3.
2.6 盆栽试验中喷施赤霉素对向日葵列当寄生的影响
上一年在种植玉米后的两个不同时期向火箭盆中的土壤喷施了10-4mol·L-1赤霉素溶液, 赤霉素提高了土壤中向日葵列当种子对玉米根系分泌的萌发刺激物质的响应, 但由于玉米非向日葵列当的寄主, 因而产生“自杀发芽”。经d20和d40处理后的向日葵列当出土平均数比对照显著降低76.4%和67.3%。寄生总数与对照相比差异显著, 向日葵列当出土数均为2.8个·盆-1, 较对照降低63.6%。根据列当出土数降低表明, 在前茬种植玉米同时喷施10-4mol·L-1浓度的赤霉素, 有助于减少土壤中向日葵列当的出土。此外, d20处理的向日葵列当地下干重与对照相比有显著差异, 较对照降低了77.8%(表5)。
3 讨论与结论
采用穴盘种植玉米并收集其根系分泌物刺激向日葵列当种子萌发试验发现, 选择的两个玉米品种的根际分泌物中均存在能够刺激向日葵列当种子萌发的物质。两个玉米品种根系分泌物刺激向日葵列当种子萌发率总体趋势为原液>10倍稀释液>100倍稀释液, 其中‘新玉57号’根系分泌物100倍稀释液处理的向日葵列当种子萌发率显著高于‘京糯一号’, 由此可见, 不同品种玉米的根系分泌物(包含刺激萌发的物质和抑制萌发的物质)的含量及比例也是不同的。二因素方差分析也表明, 两个玉米品种刺激向日葵列当种子的萌发率有显著差异。Awad等[25]研究发现高粱[(L.) Moench]不同品种间萌发刺激物质独脚金内酯的种类和含量也有所差异。Yoneyama等[26]将一种易被独角金侵染的玉米品种(‘Pioneer 9253’)和一种对独角金耐受型的玉米品种(‘KST 94’)分泌的独角金内酯对比研究, 发现前者主要产生5-脱氧独脚金醇(5-deoxy-strigol), 而后者则主要产生高粱醇(sorghumol)。
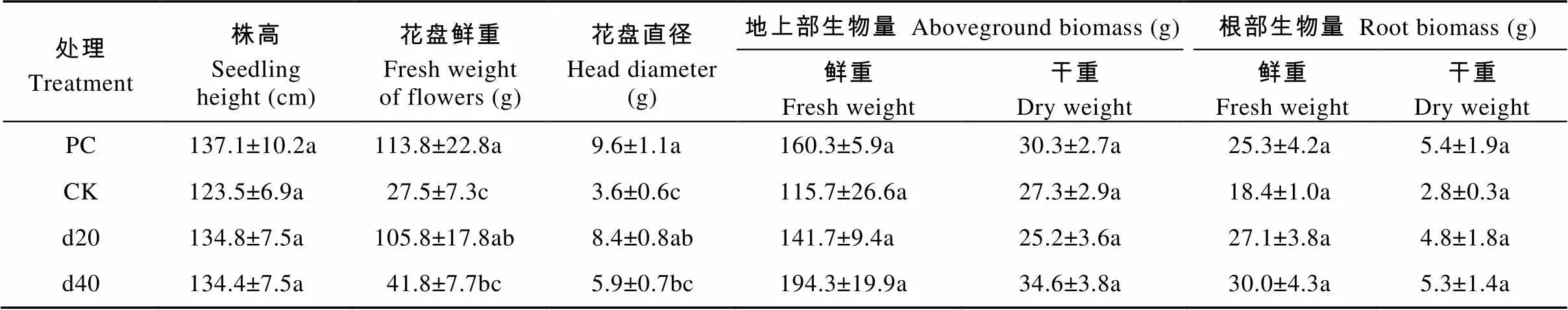
表4 玉米不同时期喷施赤霉素对后茬作物向日葵生长的影响
PC: 无向日葵列当种子也未施加赤霉素; CK: 有向日葵列当种子但未施加赤霉素; d20: 玉米播播种后20 d施加10-4mol·L-1赤霉素且有向日葵列当种子; d40: 玉米播种后40 d施加10-4mol·L-1赤霉素且有向日葵列当种子。同列数据后不同小写字母表示Tukey法检验在<0.05水平差异显著。PC: no adding sunflower broomrape seeds into soil and no applying GA3; CK: adding sunflower broomrape seeds without applying GA3; d20: adding sunflower broomrape seeds with 10-4mol·L-1GA3application at 20 days after maize seeding in the last year; d40: adding sunflower broomrape seeds with 10-4mol·L-1GA3application at 40 days after maize seeding in the last year. Different lowercase letters in the same column indicate significant differences at< 0.05 level by Tukey test.
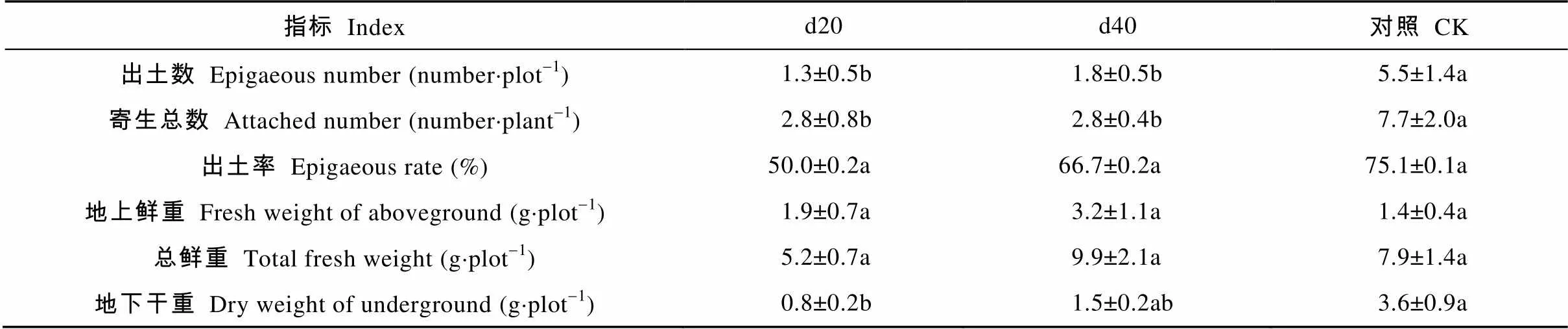
表5 玉米不同时期喷施赤霉素对后茬向日葵列当寄生和生物量的影响
d20: 玉米播播种后20 d施加10-4mol·L-1赤霉素且有向日葵列当种子; d40: 玉米播种后40 d施加10-4mol·L-1赤霉素且有向日葵列当种子; CK: 有向日葵列当种子但未施加赤霉素。同列数据后不同小写字母表示Tukey法检验在<0.05水平差异显著。d20: adding sunflower broomrape seeds with 10-4mol·L-1GA3application at 20 days after maize seeding in the last year; d40: adding sunflower broomrape seeds with 10-4mol·L-1GA3application at 40 days after maize seeding in the last year; CK: adding sunflower broomrape seeds without applying GA3. Different lowercase letters in the same column indicate significant differences at< 0.05 level by Tukey test.
盆栽玉米品种‘新玉57号’的地上部、根部甲醇浸提液刺激向日葵列当种子的萌发率为根部>地上部>根际土, 可以推测根部积累的萌发刺激物质较多。研究表明列当种子萌发刺激物质是由根部合成然后运输到地上部和根际周围, 根中萌发刺激物质的含量高于地上部与根际部位[27], 因此根部刺激向日葵列当种子萌发的能力大于地上部与根际部位。盆栽玉米‘新玉57’在不同时期施加赤霉素后, 地上部与根部甲醇浸提液100倍稀释液刺激向日葵列当种子萌发率均为d20处理>d40处理>CK(不施加赤霉素), 原因可能是施加赤霉素会增加玉米植株内萌发刺激物质的分泌。Björklund等[22]研究指出赤霉素能够刺激生长素的极性运输从而增加茎中生长素的水平, 但本试验中这个结论有待于进一步证明。
由于播种诱捕作物后, 列当种子处于一定温湿环境的土壤中, 相当于进行预培养, 而过长时间预培养会导致列当种子二次休眠, 从而影响到列当种子的萌发率[28]。在含有向日葵列当种子的土壤里施加10-4mol·L-1赤霉素, 赤霉素直接与列当种子接触, 打破列当种子的二次休眠[21], 维持列当种子对玉米分泌的萌发刺激物质的敏感程度, 达到其“自杀发芽”的目的。研究表明, 棉花(spp.)在2叶一心期对向日葵列当也具有较强的诱捕效果, 及时在此时期将棉花整株翻耕于土壤中, 可诱捕向日葵列当种子“自杀发芽”[29]。
在种植过玉米的土壤中次年轮作向日葵, 向日葵被向日葵列当寄生后, 造成花盘鲜重和直径降低。任文义等[30]调查发现向日葵列当发生地, 造成向日葵生长严重受阻, 表现为株高下降、茎粗变细、花盘变小以及籽粒干瘪甚至无籽, 当向日葵根部每株有11~30个列当, 产量下降到50%以上。盆栽试验在玉米生长过程的不同时期喷施赤霉素并在次年种植向日葵, 列当的出土数和寄生总数相比没有喷施赤霉素的对照显著减少, 此外向日葵的花盘鲜重与直径显著高于对照(有列当种子但没喷施赤霉素的处理), 说明赤霉素的施加延长列当种子对萌发刺激物质的响应敏感度并诱导更多的向日葵列当种子“自杀发芽”, 从而减少了土壤中向日葵列当种子库的含量。值得注意的是, d20处理的列当地下部总干重较对照减少77.8%, 而该处理的向日葵花盘鲜重与直径较对照增加, 原因可能是向日葵列当通过与向日葵植株根系相连以夺取水分、养分, 从而影响向日葵植株地上部的营养与生殖生长, 若向日葵列当地下干重较小时, 表明向日葵列当对向日葵根系的寄生以及寄生后的养分竞争都有降低, 从而向日葵植株的地上生长才能正常进行。
因此, 在两个玉米品种中, ‘新玉57号’的根系分泌物对向日葵列当种子萌发刺激作用更强, 更加适合作为诱捕作物的品种。在玉米播种后的20 d和40 d喷施10-4mol·L-1赤霉素, 均可以诱捕向日葵列当种子产生“自杀发芽”, 其中在玉米生长阶段的第20 d左右施加10-4mol·L-1赤霉素诱捕效果更强。玉米可作为向日葵种植的前茬作物, 收获时也可将玉米地上部刈割后青贮, 根部留在土壤中, 使萌发刺激物质自然释放。喷施赤霉素一方面对玉米生长没有影响, 另一方面可以结合玉米一起防除土壤中向日葵列当种子库, 在向日葵列当杂草出土前进行防除, 减轻对向日葵的危害以及向日葵列当种子的传播。
[1] PARKER C. The parasitic weeds of the orobanchaceae[M]// JOEL D M, GRESSEL J, MUSSELMAN L J. Parasitic Orobanchaceae: Parasitic Mechanisms and Control Strategies. Berlin, Heidelberg: Springer, 2013: 313‒344
[2] 宋文坚, 曹栋栋, 金宗来, 等. 我国主要根寄生杂草列当的寄主、危害及防治对策[J]. 植物检疫, 2005, 19(4): 230–232 SONG W J, CAO D D, JIN Z L, et al. The parasitism, harm and control measures of the main parasitic weedspp.[J]. Plant Quarantine, 2005, 19(4): 230‒232
[3] JOEL D M, HERSHENHORN J, EIZENBERG H, et al. Biology and management of weedy root parasites[M]// JANICK J. Horticultural Reviews, Volume 33. New York: John Wiley & Sons, 2007: 267
[4] BOUWMEESTER H J, MATUSOVA R, SUN Z K, et al. Secondary metabolite signalling in host-parasitic plant interactions[J]. Current Opinion in Plant Biology, 2003, 6(4): 358‒364
[5] 王焕, 赵文团, 陈连芳, 等. 列当(spp. andspp.)种子的采集与预处理方法[J]. 杂草学报, 2016, 34(1): 22‒25WANG H, ZHAO W T, CHEN L F, et al. Collection and preconditioning of broomrape (spp. andspp.) seeds[J]. Journal of Weeds, 2016, 34(1): 22‒25
[6] 张映合, 陈卫民. 伊犁地区向日葵列当的危害调查与防治技术研究[J]. 现代农业科技, 2011, (12): 184‒185 ZHANG Y H, CHEN W M. Research on hazard investigation and control technology of sunflower broomreap[J]. Morden Agricultural Technology, 2011, (12): 184‒185
[7] 张学坤, 姚兆群, 赵思峰, 等. 分枝(瓜)列当在新疆的分布、危害及其风险评估[J]. 植物检疫, 2012, 26(6): 31‒33 ZHANG X K, YAO Z Q, ZHAO S F, et al. Distribution, harmfulness and its assessment ofin Xinjiang[J]. Plant Quarantine, 2012, 26(6): 31‒33
[8] NADAL S, MORENO M T, ROMÁN B. Control ofinby glyphosate[J]. Crop Protection, 2008, 27(3/5): 873‒876
[9] COCHAVI A, RUBIN B, SMIRNOV E, et al. Factors affecting Egyptian broomrape () control in carrot[J]. Weed Science, 2016, 64(2): 321‒330
[10] CHEN J, XUE Q H, MCERLEAN C S P, et al. Biocontrol potential of the antagonistic microorganismagainst[J]. Bio Control, 2016, 61(6): 781‒791
[11] 陈杰, 马永清, 薛泉宏. 利用微生物防除根寄生杂草列当[J]. 中国生态农业学报, 2018, 26(1): 49‒56 CHEN J, MA Y Q, XUE Q H. Use of microorganisms in controlling parasitic root weedspp.[J]. Chinese Journal of Eco-Agriculture, 2018, 26(1): 49‒56
[12] TARFA B D, KUREH I, KAMARA A Y, et al. Influence of cereal-legume rotation on soil chemical properties, crop yield andcontrol[J]. Journal of Agronomy, 2006, 5(2): 362‒368
[13] 马永清. 采用植物化感作用与诱捕作物消除列当土壤种子库[J]. 中国生态农业学报, 2017, 25(1): 27–35 MA Y Q. Using allelopathy and trap crops to eliminate soil bank of broomrape seed[J]. Chinese Journal of Eco-Agriculture, 2017, 25(1): 27‒35
[14] ACHARYA B D, KHATTRI G B, CHETTRI M K, et al. Effect ofvar.as a catch crop onseedbank[J]. Crop Protection, 2002, 21(7): 533‒537
[15] MATUSOVA R, RANI K, VERSTAPPEN F W A, et al. The strigolactone germination stimulants of the plant-parasiticandspp. are derived from the carotenoid pathway[J]. Plant Physiology, 2005, 139(2): 920‒934
[16] SIAME B A, WEERASURIYA Y, WOOD K, et al. Isolation of strigol, a germination stimulant for, from host plants[J]. Journal ofAgricutural and Food Chemistry, 1993, 41(9): 1486‒1491
[17] MA Y Q, JIA J N, AN Y, et al. Potential of some hybrid maize lines to induce germination of sunflower broomrape[J]. Crop Science, 2013, 53(1): 260‒270
[18] JOEL D M. The long-term approach to parasitic weeds control: Manipulation of specific developmental mechanisms of the parasite[J]. Crop Protection, 2000, 19(8/10): 753‒758
[19] YE X X, JIA J N, MA Y Q, et al. Effectiveness of ten commercial maize cultivars ininducing Egyptian broomrape germination[J]. Frontiers of Agricultural Science and Engineering, 2016, 3(2): 137–146
[20] 左旭, 王红彦, 王亚静, 等. 中国玉米秸秆资源量估算及其自然适宜性评价[J]. 中国农业资源与区划, 2015, 36(6): 5‒10 ZUO X, WANG H Y, WANG Y J, et al. Estimation and suitability evaluation of corn straw resources in China[J]. Chinese Journal of Agricultural Resources and Regional Planning, 2015, 36(6): 5‒10
[21] 王丽, 李梅兰, 田彩芳, 等. 赤霉素处理对白菜生长发育的影响[J]. 山西农业科学, 2009, 37(3): 58‒60 WANG L, LI M L, TIAN C F, et al. Effects of gibberellins treatment on growth and development of cabbage[J]. Journal of Shanxi Agricultural Sciences, 2009, 37(3): 58‒60
[22] BJÖRKLUND S, ANTTI H, UDDESTRAND I, et al. Cross-talk between gibberellin and auxin in development ofwood: Gibberellin stimulates polar auxin transport and has a common transcriptome with auxin[J]. The Plant Journal, 2007, 52(3): 499‒511
[23] YE X X, ZHANG M, DONG S Q, et al. Conditioning duration and agents involved in broomrape seeds responding to germination stimulants[J]. Plant Growth Regulation, 2017, 81(2): 221‒230
[24] TAKEUCHI Y, OMIGAWA Y, OGASAWARA M, et al. Effects of brassinosteroids on conditioning and germination of clover broomrape () seeds[J]. Plant Growth Regulation, 1995, 16(2): 153‒160
[25] AWAD A A, SATO D, KUSUMOTO D, et al. Characterization of strigolactones, germination stimulants for the root parasitic plantsand, produced by maize, millet and sorghum[J]. Plant Growth Regulation, 2006, 48: 221‒227
[26] YONEYAMA K, ARAKAWA R, ISHIMOTO K, et al. Difference in-susceptibility is reflected in strigolactone secretion profile, but notin compatibility and host preference in arbuscular mycorrhizal symbiosis in two maize cultivars[J]. New Phytologist, 2015, 206(3): 983‒989
[27] KOHLEN W, CHARNIKHOVA T, LIU Q, et al. Strigolactones are transported through the xylem and play a key role in shoot architectural response to phosphate deficiency in nonarbuscular mycorrhizal host arabidopsis[J]. Plant Physiology, 2011, 155(2): 974‒987
[28] GIBOT-LECLERC S, CORBINEAU F, SALLÉ G, et al. Responsiveness ofL. seeds to GR24 as related to temperature, oxygen availability and water potential during preconditioning and subsequent germination[J]. Plant Growth Regulation, 2004, 43(1): 63‒71
[29] 郎明, 马永清, 董淑琦, 等. 苗期棉花对向日葵列当种子萌发诱导作用初探[J]. 生态环境学报, 2011, 20(1): 79‒83 LANG M, MA Y Q, DONG S Q, et al. Allelopathic effect of cotton in seedling stage on sunflower broomrape[J]. Ecology and Environment Sciences, 2011, 20(1): 79‒83
[30] 任文义, 李毅, 马洪锡, 等. 向日葵列当对向日葵主要经济性状的影响及防治方法研究[J]. 河北农业大学学报, 1992, 15(3): 63‒66 REN W Y, LI Y, MA H X, et al. Study on the effect ofW. on main economic properties of sunflower and its control[J]Journal of Hebei Agricultural University, 1992, 15(3): 63‒66
Effect of maize and gibberellic acid on sunflower broomrape germination, control and growth in sunflower field*
WANG Yue1, YE Xiaoxin2, WANG Kai1, LI Pufang3, GUO Zhenguo1, CHEN Fangjie1, MA Yongqing1,3**
(1. College of Forestry, Northwest A & F University, Yangling 712100, China; 2. School of Resources and Environmental Engineering, Anhui University, Hefei 230601, China; 3. State Key Laboratory of Soil Erosion and Dryland Farming, Institute of Soil and Water Conservation, Chinese Academy of Sciences and Ministry of Water Resources, Yangling 712100, China)
Sunflower broomrape (Wallr.) is a parasitic, herbaceous root plant that has severe effect on industrial crops like sunflower. In order to reduce the parasitic effect of sunflower broomrape on sunflower and sunflower broomrape seed bank, two generalized maize varieties (‘Jingnuo No. 1’, ‘Xinyu No. 57’) in Xinjiang Uygur Autonomous Region of China were used in a plug tray experiment to study the effects of application of two exogenous concentrations of gibberellin acid (10-4mol·L-1and 10-5mol·L-1) at different periods (10 d and 15 d after germination) on maize growth and development, and secretion of stimulant of sunflower broomrape seed germination. The study screened out more capable maize variety for pot experiment by collecting and extracting root exudates of maize to stimulate sunflower broomrape seed germination after 24 days. Through applying GA3(10-4mol·L-1) at different times after planting, the study also explored the combined effects of maize and GA3on controlling sunflower broomrape seeds. Thus in the pot experiment, GA3was exogenously applied 20 and 40 days after planting maize, and plant samples (leaves, stems and roots) and rhizosphere soils collected at harvest (105 d) were used to further analyze sunflower broomrape seed germination. Sunflowers were planted in pots that were planted with maize in the past years. The epigaeous number of sunflower broomrape was counted and sunflower plants of agronomic index measured at harvest. The results showed the application of GA3in the plug tray experiment had a significant effect on maize height. In addition, there was no inhibiting effect on maize in terms of secreting germination stimulant of sunflower broomrape. Thus, it was productive to apply GA3(10-4mol·L-1and 10-5mol·L-1) during maize growth period. Moreover, 100-dilution of root exudate of ‘Xinyu No. 57’ maize variety showed more significantly stimulating effect on sunflower broomrape germination rate than ‘Jingnuo No. 1’, ‘Xinyu No. 57’ was finally used in the pot experiment. In the pot experiment, maize heights under 10-4mol·L-1GA3application after 20 and 40 days of maize planting were higher than that under the control (no application of GA3), with respective increases of 22.5% and 19.1%. Sunflower was planted in the second year after maize, which was treated by GA3at 20 days after planting. The diameter of sunflower disk increased by 57.1% compared with the control. Compared with control, the number of epigaeous sunflower broomrape was 1.3·plot-1and 1.8·plot-1, which suggested decreases of 76.4% and 67.3%, respectively. In conclusion, the application of 10-4mol·L-1GA3to maize after 20 and 40 days of planting stopped sunflower broomrape seed germination and thereby reduced sunflower broomrape damage to sunflower.
Sunflower broomrape; Seed germination; Maize; Gibberellin acid; Root exudate
, E-mail: mayongqing@ms.iswc.ac.cn
Jan. 18, 2018;
Apr. 25, 2018
Q939.96
A
1671-3990(2018)11-1672-10
10.13930/j.cnki.cjea.180090
* 新疆生产建设兵团现代科技攻关与成果转化项目(2016AC007)和西北农林科技大学博士科研启动费(2452015338)资助
马永清, 主要从事化感作用与根寄生植物研究。E-mail: mayongqing@ms.iswc.ac.cn
王玥, 主要从事列当生物防除研究。E-mail: vbwy@hotmail.com
2018-01-18
2018-04-25
* This study was supported by the Science and Technology Plan for Agriculture and Social Development by the Xinjiang Production and Construction Corps (2016AC007) and Northwest A&F University Doctoral Research Start-up Fee (2452015338).
王玥, 叶晓馨, 王恺, 李朴芳, 郭振国, 陈芳洁, 马永清. 玉米与赤霉素对向日葵列当种子萌发、防除以及对后茬作物向日葵生长的影响[J]. 中国生态农业学报, 2018, 26(11): 1672-1681
WANG Y, YE X X, WANG K, LI P F, GUO Z G, CHEN F J, MA Y Q. Effect of maize and gibberellic acid on sunflower broomrape germination, control and growth in sunflower field[J]. Chinese Journal of Eco-Agriculture, 2018, 26(11): 1672-1681

