外源赤霉素浸种对北柴胡种子萌发的影响
常海飞,高欣,邓凯,冯晓东*
(1.延安大学 生命科学学院;2.陕西省红枣重点实验室(延安大学),陕西 延安 716000)
北柴胡(Bupleurum ChinenseDC.)别名为地熏、山菜、茈胡、菇草,属于被子植物门,双子叶纲,伞形目,伞形科多年生草本植物[1]。目前,由于不加节制挖掘野生柴胡,我国野生柴胡资源日渐减少,但市场需求量一直不断增加,因此全国各地正在积极开展北柴胡的家种栽培,在湖北、山西、河北、东北、甘肃和陕西城固县等地已形成具有规模化的北柴胡种植基地。从20世纪80年代开始,全国各地就开始开展野生柴胡的家种试验,经过30多年的研究和实践,家种柴胡栽培技术基本成熟,但是北柴胡的种子未完成后熟,必须经过后熟才能出芽,使得北柴胡发芽周期长[2],同时,北柴胡种子的种皮内含有的发芽抑制物,导致种子的发芽率较低。
赤霉素是一种微量高效的植物激素,广泛存在于植物、微生物中,是一类二萜化合物,能够调控植物的多种生长发育和生殖过程,如种子的萌发、茎的延展、叶片的生长、顶芽的休眠以及植物的开花和果实发育等过程,对水果和蔬菜生长发育都有促进作用,早已被各种农业生产实践所证明[3-4]。因此,开展外源赤霉素在提高北柴胡种子萌发率的研究具有很大的实际应用价值。目前,针对赤霉素对北柴胡种子萌发率的影响研究尚鲜见报道。对此,本研究探索了不同浓度赤霉素浸种对北柴胡种子萌发率的影响,以期为北柴胡育苗、栽培提供参考依据。
1 材料和方法
1.1 材料与试剂
北柴胡种子由陕西地道中药材种植有限公司所提供。
赤霉素(东立信生物工程有限公司),高锰酸钾(广州昊宣化工有限公司)。试验用水均为蒸馏水。
1.2 试验设计
1.2.1 种子处理
选取籽粒完整并且饱满,体积均匀的北柴胡种子,首先使用浓度为1%高锰酸钾溶液浸泡种子5 min,再使用蒸馏水反复冲洗3次,以洗去种子表面的残留的高锰酸钾,然后置于洁净烧杯中自然晾干。使用1%高锰酸溶液钾浸泡北柴胡种子,既可以杀死北柴胡种子表面上的杂菌,防止在萌发过程中霉变,同时也能在一定程度上破坏种皮,有利于北柴胡种子萌发。
1.2.2 试验设计
配制梯度赤霉素溶液,浓度分别为0、20、40、60、80、100、120 mg/L,取100粒消毒后的北柴胡种子,置于不同浓度赤霉素溶液中进行处理(赤霉素溶液体积以浸过种子为宜),以0 mg/L为对照组(CK),并于28℃、生化培养箱中培养10 h;然后再将浸泡后的种子放至底部垫有滤纸的培养皿中,并且上加一张滤纸,用蒸馏水润湿保持润湿。再将培养皿置于在20℃、光照条件中培养,定期向培养皿中加入适量蒸馏水,同时每5 d更换滤纸。北柴胡种子的发芽率、活力指数、发芽指数统计时间为第20 d,发芽势统计时间为第18 d。每个重复3次,每次处理100粒种子,最后求平均值。
1.3 测量方法
1.3.1 发芽率的测定
在赤霉素浸种处理后第20 d,统计培养皿中北柴胡种子发芽数,再计算发芽率,发芽标准以北柴胡种子的芽长超过种子长度的一半。发芽率是指测试种子发芽数占测试种子总数的百分比。发芽率=(发芽的种子数/供检测的种子数)×100%
1.3.2 发芽势测定
在赤霉素浸种处理第18 d,统计18 d内的种子发芽数占总数的百分比为标准。发芽势是指在种子发芽过程中,日发芽种子数达到最高峰时,发芽的种子数占被测样品种子数的百分率,是用来鉴别种子发芽整齐度的主要指标。发芽势(%)=18 d内发芽种子个数/供试种子×100%。
1.3.3 发芽指数的测定
在赤霉素浸种处理后20 d内,统计每天的发芽粒数,然后计算发芽指数[5]。计算公式为:GI=∑Gt/Dt。Gt为北柴胡发芽试验终期内每日发芽数,Dt为发芽日数,∑为总和。
1.3.4 活力指数的测定
在赤霉素浸种处理后第20 d,使用游标卡尺测量已发芽北柴胡种子的芽长,然后再计算其平均值[6]。活力指数=发芽指数×S,S为平均每粒种子的芽长值(cm)。
1.4 数据处理与统计分析
实验结果采用SPSS软件(版本21.0)和Microsoft Excel 2010进行数据统计分析,表示为实验数据的平均值±标准差。各处理的比较采用最小显著差数法(LSD)进行多重比较,其中P>0.05和P<0.05分别表示无显著差异、有显著差异。所有图中不同小写字母表示在0.05水平差异显著性。
2 结果与分析
2.1 赤霉素浸种对北柴胡种子发芽率的影响
图1为不同赤霉素浓度对北柴胡种子的发芽率的影响,由图1可知,北柴胡种子的发芽率平均值存在显著差异(P<0.05),随着赤霉素浓度的增高,北柴胡种子的发芽率呈现先增高后下降的趋势。80 mg/L赤霉素与其他浓度赤霉素处理之间存在显著差异(P<0.05),但60 mg/L赤霉素和100 mg/L赤霉素后不存在显著差异(P>0.05)。经赤霉素浸种后发芽率均比对照组高,且存在显著差异。表明赤霉素浸种能提高北柴胡种子的发芽率,当赤霉素浓度在80 mg/L时,北柴胡种子的发芽率最高为62.5%。
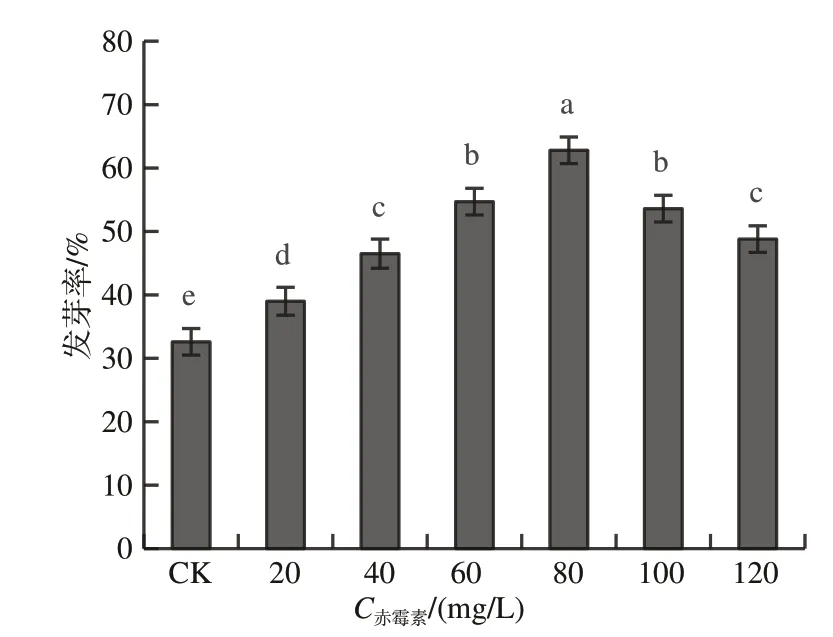
图1 赤霉素浸种对北柴胡种子发芽率的影响
2.2 赤霉素浸种对北柴胡种子发芽势的影响
种子发芽势表示种子发芽的整齐度和出苗的一致性,发芽势高,表示种子活力强,发芽整齐,出苗一致;发芽势低,预示着出苗不齐、弱苗多。在不同赤霉素浓度处理下,北柴胡种子的发芽势存在显著差异(P<0.05),随着赤霉素浓度的增加,北柴胡种子的发芽势呈先增高后下降的变化。100 mg/L赤霉素与其他浓度处理之间存在显著差异(P<0.05);80 mg/L赤霉素与120 mg/L赤霉素处理之间无显著差异。与对照组相比较,经不同浓度赤霉素浸种处理后,均能显著提高北柴胡种子的发芽势。表明赤霉素浸种有利于北柴胡种子发芽势的提高,在处理浓度为100 mg/L时,促芽效果最好。
2.3 赤霉素浸种对北柴胡种子发芽指数的影响
发芽指数也是种子的活力指标。可以反映外界条件对种子活力的影响程度,发芽指数增高表明对种子活力的提高有较大作用。由图2可以看出在不同赤霉素浓度处理下对北柴胡种子发芽指数的影响,发现经赤霉素处理后存在显著差异(P<0.05),随着赤霉素浓度增加,北柴胡种子的发芽指数先增高后下降的变化。当赤霉素浓度为80 mg/L时,发芽指数达到最大为5.63。80 mg/L赤霉素与其他浓度赤霉素处理间存在显著差异(P<0.05),60 mg/L赤霉素与100 mg/L赤霉素处理之间无显著差异。与对照组相比较,经赤霉素浸种处理后,均能显著提高北柴胡种子的发芽指数。

图2 赤霉素浸种对北柴胡种子发芽指数的影响
2.4 赤霉素浸种对北柴胡种子活力指数的影响
在不同赤霉素浓度处理下,北柴胡种子的活力指数存在显著差异(P<0.05,见图3)。随着赤霉素浓度的增高,80 mg/L赤霉素与其他浓度赤霉素处理存在显著差异(P<0.05),对照组与60 mg/L、100 mg/L赤霉素无显著差异,100 mg/L与120 mg/L赤霉素存在显著差异。与对照组相比较,经赤霉素浸种处理后,均能显著提高北柴胡种子的活力指数。在处理浓度为80 mg/L时,活力指数最大为16.4,促进效果最好。

图3 赤霉素浸种对北柴胡种子活力指数的影响
3 讨论与结论
有诸多研究表明,在逆境环境条件下,赤霉素能显著促进植物种子萌发及幼苗生长,如外源赤霉素促进对节白蜡和甜叶菊种子的萌发[7-8]。外源赤霉素可以提高植物种子与内源赤霉素合成相关的关键基因的表达水平,进而促进内源赤霉素的合成反应,增大赤霉素/脱落酸含量比值,促进种子的萌发[9]。同时,在植物种子萌发过程中,赤霉素可以调节物质代谢和能量代谢过程中关键蛋白质的表达水平,促进储存的鹰眼物质分解,满足种子萌发时的生理生化反应需求[10]。例如,外源赤霉素可以提高植物种子淀粉酶和其他水解酶活性,有利于促进淀粉和脂类物质的转化和利用,为核酸合成、蛋白质合成等代谢过程提供能量和前体物质[11]。
研究表明,在北柴胡种子萌发过程中,胚乳中具有活性的赤霉素分泌至糊粉层[12],可以启动多种水解酶的合成,其中包括多种淀粉酶和蛋白水解酶,这些水解酶在胚乳内,首先淀粉酶含量上升,分解淀粉转化为可溶性糖,满足胚芽生长的物质和能量需求,其次是合成大量新的氨基酸,从而形成种子萌发所需的各种蛋白质,种子的总蛋白含量增加[13]。本试验研究结果表明,当用20~120 mg/L赤霉素浸种时,对北柴胡种子的发芽率、发芽势、发芽指数、活力指数均有明显的促进作用,呈现出先增加后降低的变化,表明赤霉素能够促进萌发中的北柴胡种子营养物质加速水解,从而促进了北柴胡种子的萌发,这与李文超的研究一致[14]。本试验中当赤霉素的浓度为80 mg/L时,北柴胡种子的发芽率、发芽指数、活力指数均达到最大,此时种子萌发率最高,促进效果最佳。当浓度为100 mg/L时,与80 mg/L赤霉素相比,发芽率、发芽指数、活力指数均显著降低,但北柴胡种子的发芽势显著增高,表明提高了种子的发芽整齐度,因此,使用80 mg/L的赤霉素浸种能提高种子萌发率,100 mg/L的赤霉素浸种能促进北柴胡种子的整齐度。
外源赤霉素常用来打破种子休眠,据研究结果表明对于贮存时间不超过6个月的北柴胡种子具有提高发芽率的作用,而对于室内月贮藏时间超过1年的北柴胡种子则表现出相反的结论,而且随浓度的升高,发芽率有降低的趋势。因此对北柴胡种子而言,赤霉素能够打破新鲜北柴胡种子的休眠,对贮藏过长的种子却无明显作用[15]。由此可见,外界赤霉素能打破北柴胡种子休眠,促进种子后熟,从而提高北柴胡种子的萌发率,但是对于北柴胡种子的储存时间有关,对于储存时间过长的北柴胡种子,无明显促进作用,且赤霉素对于北柴胡种子存在一定的剂量效应,对于这种剂量效应还得做进一步的研究。
综上所述,当用80~100 mg/L赤霉素浸种时,北柴胡种子的发芽率、发芽势、发芽指数、活力指数保持在较高的水平,能有效提高北柴胡种子萌发率。

