环介导恒温扩增检测生鲜果蔬中致病菌
王文博,苑学霞,邬元娟,冯静,刘磊,李瑞菊,李鸳鸯,张露月
(1. 山东省农业科学院农业质量标准与检测技术研究所/山东省食品质量与安全检测技术重点实验室,山东 济南 250100;2. 山东省农业科学院-北卡罗莱纳州立大学农产品检测技术和风险评估联合实验室,山东 济南 250100;3. 北京勤邦生物技术有限公司,北京 102206;4. 北京良润生物科技有限公司,北京 102200;5. 烟台市食品药品检验检测中心,山东 烟台 264000)
作为全球性问题,食源性疾病广泛威胁公众安全,由果蔬携带致病微生物引发疾病的现象也呈逐年增加趋势[1]。近几十年来,许多发达国家对新鲜农产品的需求日益增加[2],然而,生食蔬菜特别是绿叶蔬菜可以传播致病菌和病毒[3-5],且被致病菌污染的果蔬很难通过常规方法清洗干净[6],因此引起了各国对即食果蔬是否含有致病菌的高度重视。
目前,传统的检测方法费时费力且灵敏度低,不能满足快速检测需求[7. 8],同时增加了企业的储藏成本、质量控制成本及政府对食品安全的监管难度。环介导等温扩增技术(LAMP)是日本学者Notomi等[9]于2000年开发的一种新型恒温核酸扩增方法,该技术特点是针对靶基因的6个区域设计2对特异引物,引物在链置换DNA聚合酶(Bst DNA polymerase)的作用下,60~65℃恒温扩增。LAMP快速检测致病菌在临床、医药等行业已被广泛应用,但应用于农产品尤其即食蔬菜水果的相关研究报道较少。
本试验选取8种污染风险较高的即食生鲜果蔬为研究材料,利用 LAMP技术检测其中沙门氏菌、阪崎肠杆菌、金黄色葡萄球菌、大肠埃希氏菌O157、志贺氏菌和单增李斯特菌,并与国家标准方法进行比较,旨在为即食生鲜果蔬中致病菌的监测提供一种快速、准确的检测手段,为生鲜果蔬行业的健康发展提供技术支持。
1 材料与方法
1.1 试验材料
1.1.1 试验样品 苹果、草莓、番茄、香菜、苦菊、葡萄、结球生菜和黄瓜(购自济南七里堡蔬菜批发市场)。
1.1.2 试验菌株 沙门氏菌(ATCC14028)、阪崎肠杆菌(P5)、金黄色葡萄球菌(ATCC25923)、大肠埃希氏菌O157(NCTC12900)、志贺氏菌(10130)和单核细胞增生李斯特氏菌(CMCC4002),由北京良润生物科技有限公司提供。
1.1.3 试剂 生理盐水、致病菌(沙门氏菌、阪崎肠杆菌、金黄色葡萄球菌、大肠埃希氏菌O157、志贺氏菌和单增李斯特菌)相应的二次增菌液、脑浸液、无菌拭子、API试剂条、7.5%氯化钠肉汤培养基、缓冲蛋白胨水培养基、金黄色葡萄球菌显色培养基、血平板、营养琼脂、沙门氏菌显色培养基、胰酪胨大豆酵母浸膏琼脂培养基、葡萄球菌乳胶凝集试验试剂盒,购自广东环凯微生物科技有限公司。联合增菌液,由北京良润生物科技有限公司提供。
1.1.4 试剂盒 沙门氏菌核酸LAMP检测试剂盒、阪崎肠杆菌核酸LAMP检测试剂盒、金黄色葡萄球菌核酸LAMP检测试剂盒、大肠埃希氏菌O157核酸LAMP检测试剂盒、志贺氏菌核酸LAMP检测试剂盒、单核细胞增生李斯特氏菌LAMP检测试剂盒,均由北京勤邦生物技术有限公司提供。
1.1.5 仪器与设备 拍击式均质器,购自西班牙IUL公司;生化培养箱,购自上海新苗医疗器械制造有限公司;高压灭菌锅,购自山东省新华医疗器械股份有限公司;其它仪器有高速冷冻离心机;Mini离心机、金属浴、超净工作台。
1.2 试验方法
1.2.1 准确度及灵敏度试验 将8种蔬菜水果样品去掉表面泥土,各称量四份,每份称量25 g,其中一份作为阴性对照,三份分别对应加培养好的沙门氏菌、阪崎肠杆菌、金黄色葡萄球菌、大肠埃希氏菌 O157、志贺氏菌和单增李斯特菌菌液的低(L)、中(M)、高(H)浓度(见表2),然后加入225 mL联合增菌液,36℃培养18~24 h。同时采用国家标准方法进行检测[10-15]。
取过夜培养的菌液1 mL加到1.5 mL无菌离心管中,14 000 r/min离心2 min,吸弃上清液,加入80 μL DNA提取液,混匀后95℃孵育10 min;14 000 r/min离心2 min,上清液即为核酸模板;将上清液移至另一洁净1.5 mL无菌离心管于-20℃保存。
加入22.5 μL复溶液于反应管中,然后加30 μL石蜡油,最后按顺序分别加入阴性对照、待测模板、阳性对照各2.5 μL;利用Mini离心机瞬时离心,剪取相应数量显色管盖,盖紧,并置于金属浴中65℃恒温反应60 min。
反应结束,反应管颠倒约停留5 s,使反应液与显色液(显色液在盖中)充分混合,观察结果。在阴性对照反应管呈橙色、阳性对照反应管呈绿色前提下,若待检样本反应管呈绿色,则可报告为检测对象阳性;若待检样本反应管呈橙色,则可报告为检测对象阴性。
1.2.2 重复性试验 取同一污染的蔬菜,分别用3个批次试剂盒重复检测3次, 记录检测结果。
1.2.3 特异性试验 取蔬菜样品 6 份,分别加入培养的沙门氏菌、阪崎肠杆菌、金黄色葡萄球菌、大肠埃希氏菌O157、志贺氏菌、单增李斯特菌悬液,混匀后取样增菌,每个样品用6种核酸 LAMP检测试剂盒进行检测。
2 结果与分析
2.1 准确度试验
对于生鲜果蔬中6种致病菌,核酸 LAMP方法和国家标准方法检测结果一致,阳性结果和阴性结果符合率为100%(表1)。
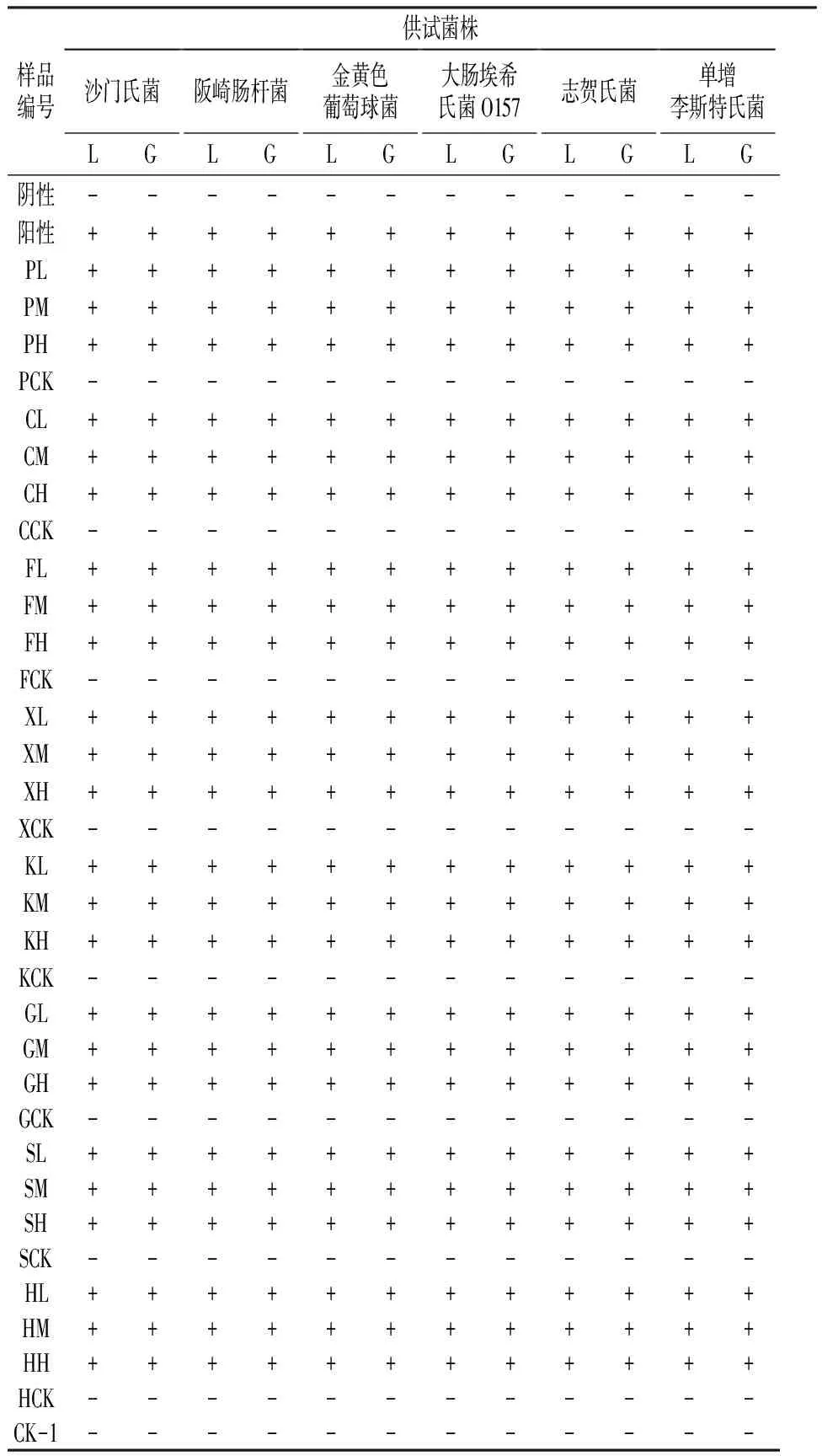
表1 核酸 LAMP 方法和国家标准检测方法比较
注: P:苹果;C:草莓;F:番茄;X:香菜;K:苦菊;G:葡萄;S:生菜;H:黄瓜;H、M、L分别为高、中、低三个浓度;CK为只添加联合培养液。未添加菌液的阴性对照;供试菌株L和G分别代表LAMP方法和国标方法。
2.2 灵敏度试验
添加致病菌不同菌落数,LAMP方法检测结果均为阳性(表2),因此 LAMP 方法检测金黄色葡萄球菌、沙门氏菌、阪崎肠杆菌、大肠埃希氏菌 O157、志贺氏菌、单增李斯特菌的灵敏度均为 5 CFU/g。
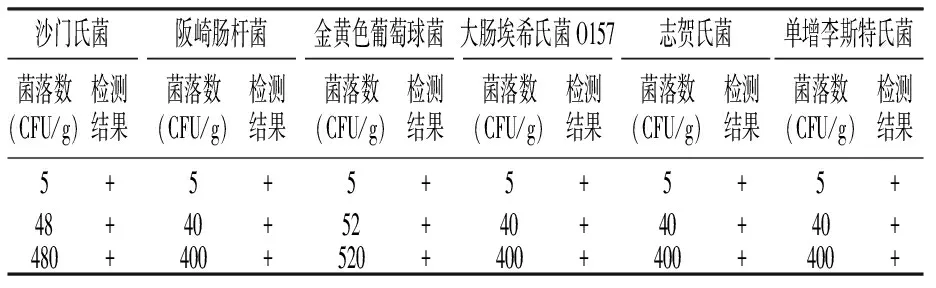
表2 LAMP 方法灵敏度试验结果
2.3 重复性试验
对生鲜果蔬中6种致病菌进行检测,核酸 LAMP 检测试剂盒 3 个批次的检测结果均为阳性,结果一致(表3)。
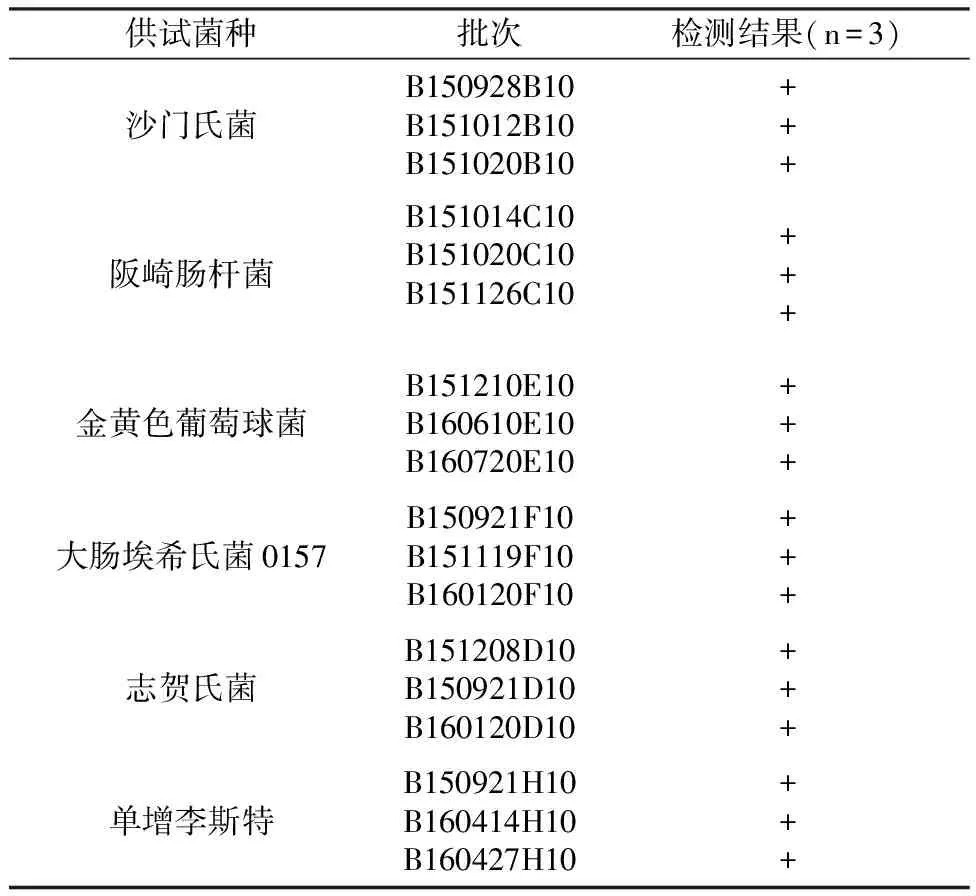
表3 不同批次LAMP检测试剂盒重复性试验结果
2.4 特异性试验
金黄色葡萄球菌 LAMP 方法只检测金黄色葡萄球菌为阳性,与其他供试致病菌无交叉反应,特异性强(表4)。其他5种菌的LAMP方法也是如此。
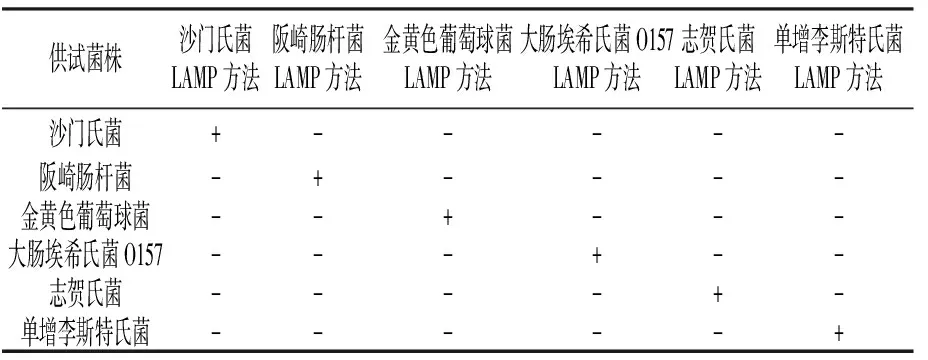
表4 LAMP 方法特异性试验结果
3 讨论与结论
据美国疾病预防控制中心(CDC)2013年报告显示,美国1998—2008年爆发的273120 次食源性疾病事件中71%与食源性致病微生物相关[1]。而导致染病并发病的相关食品中叶类蔬菜和水果/坚果分别达到13%和11%,其中诺瓦克病毒常见于叶类蔬菜,水果和根茎类蔬菜上的沙门氏菌以及牛肉和叶菜类蔬菜上的大肠杆菌导致最高的染病住院率;水果上的沙门氏菌及叶菜类蔬菜上的大肠杆菌均具有最高的致死率[16, 17]。对食源性致病微生物及时检测与鉴定,是降低危害的有力措施之一。传统的致病微生物检测鉴定方法耗时、繁琐,已不能满足快速检测的需求。
LAMP 检测方法只需恒温就能完成扩增反应,快速、高效、耗时短。张裕君等[18]建立了苜蓿疫霉根腐病菌LAMP检测方法,其可在恒温条件下40 min完成扩增,检出0.1 ng苜蓿疫霉根腐病菌基因组DNA的存在。此外,LAMP检测方法灵敏度较高,检测牛肉中大肠杆菌O157的灵敏度为9.8 CFU/mL,人工污染牛肉的检出限为68 CFU/g;而PCR检测牛肉中大肠杆菌O157的灵敏度为980 CFU/mL,人工污染牛肉的检出限为6.8×103CFU/g[19]。本试验中,LAMP 方法检测沙门氏菌、阪崎肠杆菌等致病菌的灵敏度为5 CFU/g,且与国标检测结果一致,准确度较高。
此外,LAMP检测方法因其简便、快速、高特异且不需要特殊试剂和仪器设备等优势,在多个行业均得到广泛应用。其中,LAMP检测方法在检测水果蔬菜方面也已得到应用[1],但多用于果蔬中病毒的检测[20-22],如朱林慧[23]建立了用于检测进境水果与种苗中冬生疫霉、下香疫霉和栗黑水疫霉的LAMP方法,其灵敏度远高出常规PCR与多重实时荧光PCR。关于食源性致病菌的检测报道较少,张体银等[24]应用LAMP方法对10个蔬菜样品中单增李斯特菌进行了检测。本试验对于生鲜蔬菜中6种致病菌的检测结果证明,LAMP检测方法重复性好且特异性高。
综上所述,生鲜果蔬中6 种致病菌 LAMP 检测方法具有准确度高、灵敏度高、重复性好、特异性强、快速等优点,可广泛应用于果蔬中致病菌的快速检测,为生鲜果蔬行业的健康发展提供技术支持。

