化学平衡状态的判断
■河南省郸城县第一高级中学 李永彬
【基本概念辨析】
1.可逆反应。
(1)概念:在相同条件下,既能向正反应方向进行,又能向逆反应方向进行的化学反应。
(2)特点——“二同一不能”。
①“二同”:同一条件下,正、逆反应同时进行。
②“一不能”:反应物和生成物同时存在,任意物质不能全转化为生成物,即反应物的转化率小于100%。
2.化学平衡状态。
(1)建立过程:一定条件下的可逆反应随着反应的进行,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的浓度保持不变的状态(如图1)。
(2)特点:①逆:化学平衡研究的对象是可逆反应。②等:达到平衡时正反应速率和逆反应速率相等。③定:达到平衡时反应体系中各组分的浓度保持恒定。④动:化学平衡是一种动态平衡。⑤变:当外界条件发生变化时,平衡可能发生移动。
【考点误区警示】
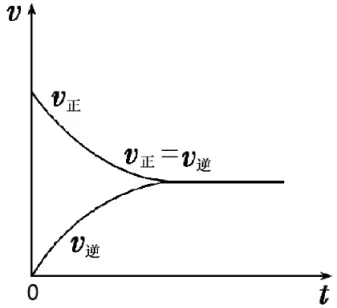
图1
(1)对于在不同条件下进行的反应物和生成物相反的反应不能认为是可逆反应。如不是可逆反应。(2)对于可逆反应,无论什么条件下,反应物都不可能完全转化为生成物。如H2+I2⇌2HI的反应体系中,加入1mol H2与1molI2充分反应后,生成HI的量一定小于2mol。(3)可逆反应达到化学平衡状态时,化学反应速率不等于零。(4)对于有特征现象的化学反应,可以通过观察现象来判断反应是否达到平衡,如Fe3++3SCN-⇌Fe(SCN)3的反应,当反应体系的颜色不再改变时,反应达到平衡。(5)外界条件发生变化,化学平衡状态不一定发生移动,如使用催化剂。
【平衡状态判据】
化学平衡状态的判断问题是常见的考题,要求考生正确理解化学平衡状态的本质(即正、逆反应速率相等)、化学平衡状态的表现(如各组分浓度和百分含量、反应物的转化率保持不变),以及从化学平衡状态的概念中延伸出平衡体系中气体的相对分子质量、密度等。
常用到的判断标志为:
1.直接判断依据。
v正(A)=v逆(A)>0
各物质浓度保持不变}⇒达到平衡状态
2.间接判断依据:反应达到平衡状态时,正、逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其他量不变,并由此进行判断。注意理解化学平衡状态的判断,选择的物理量应随反应进行发生变化,该物理量由变化到不变,说明到达平衡。具体方法如下:
(1)速率法:①同一物质的v正=v逆≠0,对于不同物质的速率要通过化学计量数转化为同一物质的速率;②同一物质化学键断裂速率与化学键生成速率相等。用速率描述时,一定要注意一“正”、一“逆”,且相等。
(2)压强法:对于反应前后气体计量数不等的可逆反应,在未达到平衡之前,等容密闭容器中气体的总的物质的量始终在改变,气体的压强也会随着改变,因此,体系内的总压强不变时说明达到平衡状态。对于等容条件下反应前后气体计量数相等的可逆反应,体系内的总压强始终是不变的,体系内的总压强不变不能作为判定是否达到平衡状态的依据。压强对平衡的影响实质是浓度的影响,因此要注意充入无关气体时的两种情况:恒容时,虽然总压增大,但有关气体的浓度不变,故平衡不移动;恒压时,虽然总压不变,但有关气体的浓度减小,平衡向着气体体积增大的方向移动。
(3)体积法:对于反应前后气体计量数不等的可逆反应,在未达到平衡之前,等压密闭容器中气体的总的物质的量始终在改变,气体体积也会随之改变,因此,体系内的总体积不变时说明达到平衡状态。对于等压条件下反应前后气体计量数相等的可逆反应,体系内的总体积始终是不变的,体系内的总体积不变不能作为判定是否达到平衡状态的依据。
(6)颜色法:有颜色物质参加或生成的可逆反应,体系的颜色不随时间的改变而改变时,可判断该可逆反应达到化学平衡状态;常见的有色气体有 NO2、Br2、I2。
(7)化学平衡常数法:一定温度下的可逆反应,如果生成物浓度的幂之积与反应物浓度的幂之积的比值(即浓度商),与该温度的化学平衡常数相等,可判断该反应处于化学平衡状态。浓度商大于Kc时,平衡向逆反应方向移动;浓度商等于Kc时,平衡不移动;浓度商小于Kc时,平衡向正反应方向移动。
(8)转化率法:可逆反应达到化学平衡状态,反应混合物各物质的含量保持不变,反应物的转化率不变。
恒容时改变反应物的用量对转化率(α)的影响:
①若反应物只有一种,如aA(g)⇌bB(g)+cC(g),增加A的量,若a=b+c,则α(A)不变;若a>b+c,则α(A)增大;若a<b+c,则α(A)减小。a≠b+c时,增大或减小反应物的浓度,平衡按加压或减压处理。
②若反应物不止一种,如mA(g)+nB(g)⇌pC(g)+qD(g),若只增加A的量,则平衡向正反应方向移动,α(A)减小而α(B)增大;若同倍数地同时增大或减小各反应物的浓度,平衡也按加压或减压处理。
【典型例题剖析】
例1反应N2(g)+3H2(g)⇌2NH3(g)ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )。
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开 H-H 键的数目和生成N-H键的数目相等
D.容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
解析:该反应在绝热容器中发生,正反应是放热反应,容器内的温度不再变化,反应一定达到平衡状态,A项正确;该反应在恒压容器中发生,压强始终相等,容器内的压强不能作为化学平衡状态的判据,B项错误;根据反应方程式可得,断开H—H键和生成N—H键的反应进行的方向相同,不能作为化学平衡状态的判据,C项错误;容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2,不能作为化学平衡状态的判据,D项错误。
答案:A
例2合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:
ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )。
A.增加压强 B.降低温度
C.增大CO的浓度 D.更换催化剂
解析:A项,增加压强平衡不移动,CO的转化率不变,错误;B项,降低温度平衡正向移动,正确;C项,增大CO的浓度,CO的转化率降低,错误;D项,催化剂对平衡无影响,错误。
答案:B
例3一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生反应NO2(g)+SO2(g)⇌SO3(g)+NO(g),下列能说明反应达到平衡状态的是( )。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1molNO2
解析:反应前后气体分子数不变,故体系的压强始终不变,不能确定是否平衡;随着反应的进行,NO2的浓度减小,颜色变浅,不变则达平衡;SO3和NO都是生成物,比例保持1∶1,不能确定是否平衡;D中所述的两个速率都是逆反应速率,不能确定是否平衡。
答案:B
例4在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的 ΔH____0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图2所示。在0~60s时段,反应速率v(N2O4)为____mol·L-1·s-1,反应的平衡常数K1为____。
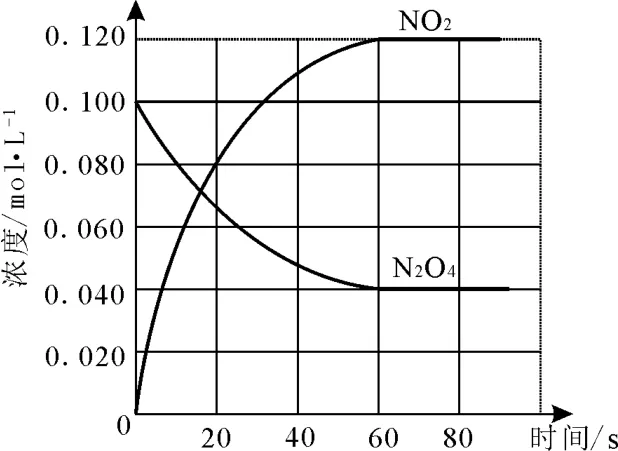
图2
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T____100℃(填“大于”或“小于”),判断理由是____。
②列式计算温度T时反应的平衡常数K2:___。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向____(填“正反应”或“逆反应”)方向移动,判断理由是____。
解析:(1)温度升高,体系的颜色加深,化学平衡正向移动,反应吸热,ΔH>0;v(N2O4)=
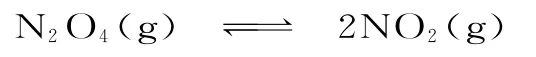
起始:0.1mol·L-10
转化:0.06mol·L-10.12mol·L-1
平衡:0.04mol·L-10.12mol·L-1

(2)①升高温度,化学平衡正向移动,T大于100℃。
②c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡,依据温度越高,反应速率越快,可列三段式:

起始:0.04mol·L-10.12mol·L-1
转化:0.02mol·L-10.04mol·L-1
平衡:0.02mol·L-10.16mol·L-1
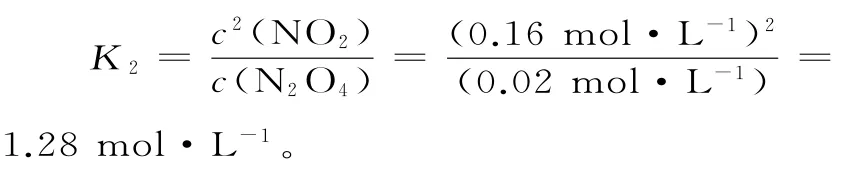
(3)该反应正向是气体体积增大的反应,容器体积减小,压强增大,平衡向逆反应方向移动。
答案:(1)大于 0.001 0.36mol·L-1
(2)①大于 反应正方向吸热,反应向吸热方向进行,故温度升高
(3)逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动

