热点剖析
———酸碱中和滴定
■河南省郸城县第一高级中学 周 娟
酸碱中和滴定是中学化学重要的定量测定实验,当然也是高考命题的热点,这类试题常从酸碱中和滴定原理入手,分别考查实验仪器的选择、实验操作步骤、指示剂的选择、实验误差分析及实验数据处理等。
【中和滴定考什么】
(1)考实验仪器。
酸式滴定管、碱式滴定管、滴定管夹(带铁架台)、锥形瓶。其中常考的是滴定管,如正确选择滴定管(包括量程),滴定管的检漏、洗涤和润洗,滴定管的正确读数方法等。
(2)考操作步骤。
①滴定前的准备:查漏、洗涤、润洗、充液(赶气泡)、调液面、读数;②滴定:移液、滴加指示剂、滴定至终点、读数;③计算。
(3)考指示剂的选择。
①强酸强碱相互滴定,可选用甲基橙或酚酞;②若反应生成的强酸弱碱盐溶液呈酸性,则选用酸性变色范围的指示剂(甲基橙),若反应生成强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞);③石蕊溶液因颜色变化不明显,且变色范围过宽,一般不作指示剂。
(4)考误差分析。
写出计算式,分析操作对V标的影响,由计算式得出对最终测定结果的影响,切忌死记硬背结论。此外对读数视线问题要学会画图分析。
(5)考数据处理。
正确取舍数据,计算平均体积,根据反应式确定标准液与待测液浓度和体积的关系,从而列出公式进行计算。
(6)考数形结合。
巧抓四个点突破滴定曲线:①抓反应“一半”点,判断是什么溶质的等量混合;②抓“恰好”反应点,生成什么溶质,溶液的酸碱性,是什么因素造成的;③抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足;④抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。
【中和滴定怎么考】
题型一:中和滴定的基本操作
例1 正误判断,正确的画“√”,错误的画“×”。
(1)从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁( )
(2)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁( )
(4)如图1,记录滴定终点读数为12.20mL( )
(5)酸式滴定管装标准溶液前,必须先用该溶液润洗( )
(6)酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差( )
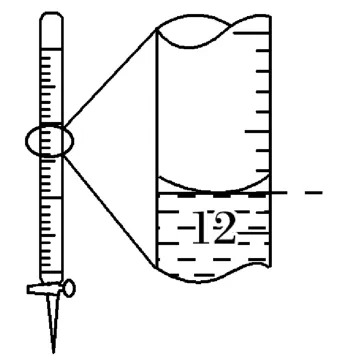
图1
(7)欲测定NaOH溶液浓度,可选用滴定管、锥形瓶、烧杯、NaOH 溶液、0.1000mol·L-1盐酸达到实验目的( )
(8)滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小( )
(9)中和滴定实验时,用待测液润洗锥形瓶( )
(10)中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用( )
(11)酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高( )
(12)如图2,量取15.00mLNaOH溶液( )

图2
(13)如图3,进行酸碱中和滴定( )
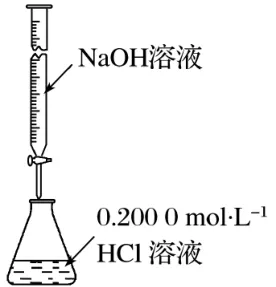
图3
(14)可用25mL碱式滴定管量取20.00mLKMnO4溶液( )
(15)读取滴定管内液体的体积,俯视读数导致读数偏小( )
答案:(1)× (2)√ (3)× (4)×(5)√ (6)× (7)× (8)√ (9)×(10)√ (11)√ (12)√ (13)× (14)× (15)√
题型二:滴定曲线的判定
例2298K时,在20.0mL0.10mol氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图4所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )。

图4
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH+4)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
解析:恰好反应生成NH4Cl溶液呈酸性,应选择在酸性范围内变色的指示剂,应用甲基橙,A项错误;若 M 点V(HCl)=20mL,则HCl和NH3·H2O恰好反应溶液呈酸性,B项错误;在M点溶液中:c(NH+4)+c(H+)=c(Cl-)+c(OH-),因pH=7,则c(H+)=c(OH-),得:c(NH+4)=c(Cl-),但c(NH+4)=c(Cl-)>c(H+)=c(OH-),C项错误;在0.1mol·L-1的 NH3·H2O中,c(OH-)=0.1mol·L-1×1.32%=1.32×7.6×10-12mol·L-1,pH<12,D项正确。
答案:D
题型三:滴定终点的描述
例3(1)用amol·L-1的盐酸滴定未知浓度的NaOH溶液,用酚酞作指示剂,达到滴定终点的现象是____;若用甲基橙作指示剂,滴定终点的现象是____。
(2)用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选用____作指示剂,达到滴定终点的现象是____。
(3)用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂____(填“是”或“否”),达到滴定终点的现象是____。
(4)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再用KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+,滴定Ti3+时发生反应的离子方程式为____,达到滴定终点时的现象是____。
答案:(1)滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色 当滴入最后一滴标准液,溶液由黄色变为橙色,且半分钟内不恢复黄色
(2)淀粉溶液当滴入最后一滴标准液,溶液由无色变为蓝色,且半分钟内不褪色
(3)否 当滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,且半分钟内不褪色
(4)Ti3++Fe3+==Ti4++Fe2+当滴入最后一滴标准液,溶液变成血红色,且半分钟内不褪色
题型四:“滴定法”的迁移应用
例4硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaS2O3)=4.1×10-5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验。
试剂:稀盐酸、稀硫酸、BaCl2溶液、Na2CO3溶液、H2O2溶液。

实验步骤 现象①取少量样品,加入除_氧蒸馏_________________水②固体完全溶解得无色澄清溶液③____④____,有刺激性气体产生___________________⑤静置________________,⑥____________________
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在____中溶解,完全溶解后,全部转移至100mL的____中,加蒸馏水至____。
②滴定:取0.0095mol·L-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:。加入淀粉溶液作为指示剂,继续滴定,当溶液____,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为____%(保留1位小数)。
解析:(1)检验样品中的硫酸根离子,应该先加入稀盐酸,再加入氯化钡溶液。但是本题中,硫代硫酸根离子和氢离子以及钡离子都反应,所以应该排除其干扰,具体过程应该为先将样品溶解,加入稀盐酸酸化(反应为,静置,取上层清液,滴加氯化钡溶液,观察到白色沉淀,证明存在硫酸根离子。
(2)①配制一定物质的量浓度的溶液,应该先称量质量,在烧杯中溶解,再转移至容量瓶,最后定容即可。
②淡黄绿色溶液中有单质碘,加入淀粉为指示剂,溶液显蓝色,用硫代硫酸钠溶液滴定溶液中的单质碘,滴定终点时溶液的蓝色应该褪去。根据题目的两个方程式得到如下关系式:。则配制的100mL样品溶液中硫代硫酸钠的浓度c=,含有的硫代硫酸钠为0.004597mol,所以样品纯度为
答案:(1)③加入过量稀盐酸 ④出现乳黄色浑浊 ⑤(吸)取上层清液,滴入BaCl2溶液 ⑥产生白色沉淀 (2)①烧杯 容量瓶 凹液面最低处与刻度线相平 ②蓝色褪去 95.0
——以“NaOH标准溶液的标定”微课教学为例
——硫代硫酸钠

