子宫内膜癌组织LAPTM4B-35和LRG1表达变化及其临床意义
梁栋,李维茹,钟沛文,徐礼江
(佛山市第一人民医院,广东佛山528000)
近年来子宫内膜癌的发病率呈明显上升趋势。目前认为,子宫内膜癌形成是一个多基因参与的复杂过程,其具体机制尚不完全清楚。溶酶体相关4次跨膜蛋白B(LAPTM4B)是一种癌基因,尤其LAPTM4B-35,在多种肿瘤组织中过表达[1]。富亮氨酸α2糖蛋白1(LRG1)属于富亮氨酸重复家族成员,可参与调节内皮细胞TGF-β通路活性,促进新生血管生成,尤其是肿瘤血管生成[2]。目前关于LAPTM4B-35、LRG1在子宫内膜癌发生、发展中作用的研究甚少。本研究观察了子宫内膜癌组织LAPTM4B-35、LRG1表达变化,并分析其与患者临床病理参数和预后的关系,旨在探讨二者在子宫内膜癌发生、发展中的作用。
1 临床资料
选择2010年1月~2012年12月佛山市第一人民医院收治的子宫内膜癌患者86例。纳入标准:①均行手术治疗,术后组织病理检查明确诊断为子宫浆液性癌或内膜样癌;②首次发病;③术前未行任何抗肿瘤治疗;④临床病理资料完整。排除标准:①子宫和卵巢双发癌且不能确定原发灶;②合并全身感染、其他恶性肿瘤以及严重肝肾功能不全;③术前行抗肿瘤治疗。患者年龄34~76(54.39±14.32)岁,其中≤50岁35例、>50岁51例;病理类型:腺癌65例,其他类型21例;临床分期(FIGO分期):Ⅰ期59例,Ⅱ、Ⅲ期27例;组织分化程度:高分化32例,中分化27例,低分化27例;浸润深度:≤1/2肌层61例,>1/2肌层患者25例;有淋巴结转移24例,无淋巴结转移62例。本研究经佛山市第一人民医院医学伦理委员会批准,患者或其家属均知情同意。
2 方法与结果

2.2 子宫内膜癌组织及其配对的癌旁正常组织LAPTM4B-35、LRG1 mRNA表达检测 取手术切除的子宫内膜癌组织及其配对的癌旁组织(距肿瘤组织边缘>2.0 cm,经组织病理检查证实为正常子宫内膜组织)各86例份,按TRIzol法提取组织总RNA,经超微量紫外分光光度计鉴定,OD260/OD280为1.8~2.1,满足实验要求。取总RNA 0.5 μg,按反转录试剂盒说明反转录为cDNA,置于-80 ℃冰箱保存。引物序列:LAPTM4B-35上游引物5′-GCCCGGAGCGATGAAGATG-3′,下游引物5′-CAACAGTACCACAGCATTGATGA-3′;LRG1上游引物5′-AGAACCTGAGCGACCTCTATC-3′,下游引物5′-CACAGCGCGTGTCATTCTG-3′;GAPDH上游引物5′-TCACCATCTTCCAGGAGCGA-3′,下游引物5′-CACAATGCCGAAGTGGTCGT-3′。PCR反应体系共10 μL:2×SYBR Mixture 5 μL,上下游引物各0.25 μL,cDNA 0.4 μL,ddH2O 4.1 μL;反应条件:50 ℃预热2 min,95 ℃ 3 min,然后95 ℃ 5 s、60 ℃ 34 s、95 ℃ 15 s共40个循环。以GAPDH为内参,采用2-ΔΔCT法计算目的基因mRNA相对表达量。结果显示,子宫内膜癌组织与癌旁正常组织LAPTM4B-35 mRNA相对表达量分别为3.42±1.32、1.21±0.43,LRG1 mRNA相对表达量分别为4.18±1.65、1.18±0.21。子宫内膜癌组织LAPTM4B-35、LRG1 mRNA相对表达量均明显高于癌旁正常组织(t分别为12.216、13.323,P均<0.05)。以LAPTM4B-35、LRG1 mRNA相对表达量的均数(3.42、4.18)为界值,将患者分为LAPTM4B-35、LRG1高表达者与低表达者。其中,LAPTM4B-35高表达者45例、低表达者41例,LRG1高表达者43例、低表达者43例。
2.3 子宫内膜癌组织LAPTM4B-35、LRG1 mRNA表达与患者临床病理参数的关系 子宫内膜癌组织LAPTM4B-35 mRNA表达与临床分期、组织病理分级、浸润深度有关(P均<0.05),与患者年龄、病理类型、淋巴结转移无关(P均>0.05);子宫内膜癌组织LRG1 mRNA表达与临床分期、淋巴结转移有关(P均<0.05),与患者年龄、病理类型、组织病理分级和浸润深度无关(P均>0.05)。见表1。

表1 子宫内膜癌组织LAPTM4B-35、LRG1 mRNA表达与患者临床病理参数的关系
2.4 子宫内膜癌组织LAPTM4B-35、LRG1 mRNA表达与患者预后的关系 术后采用电话或门诊复查方式随访,随访时间以术后出院为起点,随访60个月,以患者死亡或随访时间结束为终点。随访时间1~60个月,中位随访时间为46个月。LAPTM4B-35低表达者与高表达者术后5年生存率分别为90.24%(37/41)、66.67%(30/45),术后生存时间分别为(49.20±9.46)、(30.60±17.21)个月,二者比较P均<0.05。LRG1低表达者与高表达者术后5年生存率分别为88.37%(38/43)、67.44%(29/43),术后生存时间分别为(50.21±7.44)、(28.28±18.05)个月,二者比较P均<0.05。见图1。
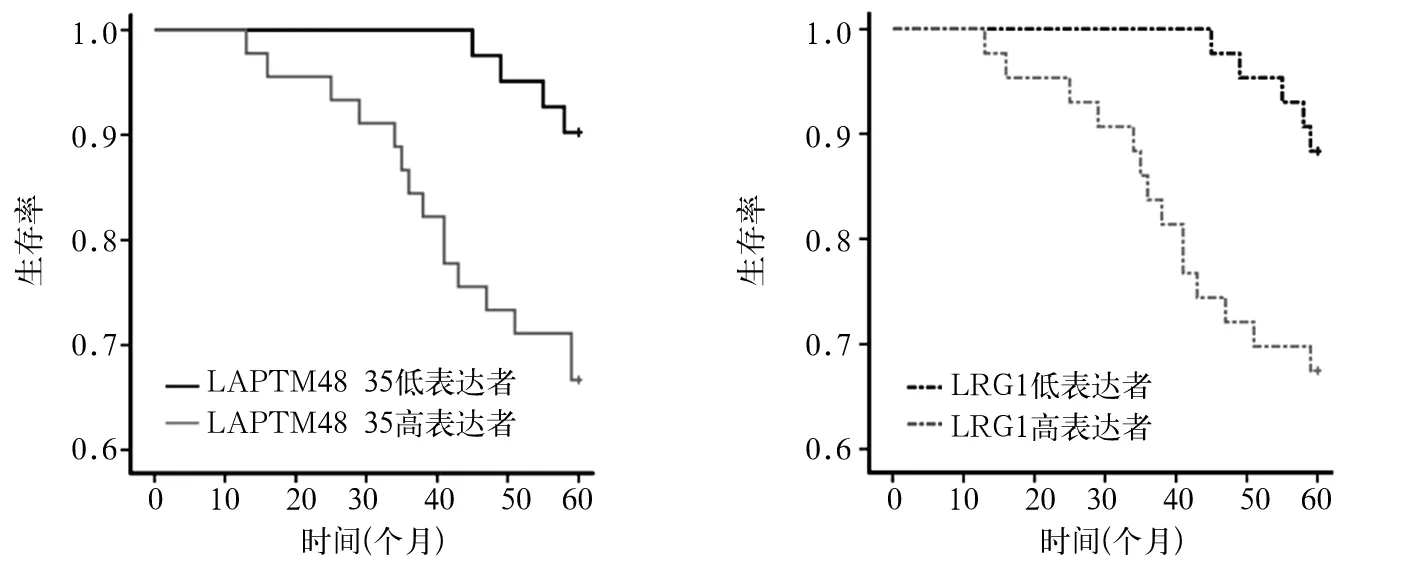
图1 子宫内膜癌组织LAPTM4B-35、LRG1 mRNA表达与患者预后的关系
3 讨论
LAPTM4B基因是一种与肝细胞癌相关的癌基因,定位于人染色体8q22.1,含有2个等位基因,可编码2种蛋白质,相对分子质量分别为35、24 kDa。研究发现,LAPTM4B基因多态性与胃癌、子宫内膜癌等易感性有关[3,4]。LAPTM4B能激活PI3K/Akt信号通路,通过调节下游信号分子活性而发挥促进肿瘤细胞增殖、抗肿瘤细胞凋亡等作用[5]。LAPTM4B还可参与细胞周期蛋白基因、p53基因的表达和功能调控,发挥促癌基因作用。LAPTM4B-35(NP 060877)蛋白是由LAPTM4B(NM 018407)基因编码、由317个氨基酸残基组成的、相对分子质量约为35 kDa的跨膜蛋白[6,7]。研究发现,在肝细胞癌等恶性肿瘤中LAPTM4B-35表达与肿瘤淋巴结转移、远处转移呈正相关关系,而与肿瘤组织分化程度、患者预后呈负相关关系[8,9];LAPTM4B-35可能通过调控MMP-9基因表达,促进胃癌细胞侵袭和迁移,诱导肿瘤恶性进展[10]。本研究结果显示,子宫内膜癌组织LAPTM4B-35 mRNA表达增加,提示在子宫内膜癌形成过程中LAPTM4B-35可能发挥癌基因作用,与其在其他恶性肿瘤形成中的作用类似。LAPTM4B-35 mRNA表达与肿瘤病理类型、临床分期、浸润深度、淋巴结转移有关,说明LAPTM4B-35可能参与子宫内膜癌的发生、发展。本研究结果显示,LAPTM4B-35高表达者术后5年生存率明显低于LAPTM4B-35低表达者,提示LAPTM4B-35高表达者预后较差,与其在前列腺癌、胃癌、胶质母细胞瘤等恶性肿瘤中一致[11,12]。
LRG1于1977年从人类血清中首次分离出来,其基因定位于人染色体19p13.3,由312个氨基酸残基组成的多肽链,相对分子质量约45 kDa。LRG1蛋白又称富亮氨酸α2糖蛋白1,属于富亮氨酸重复家族蛋白类的高度保守因子,可参与蛋白间相互作用,在多种信号传导等生理过程中发挥重要作用,如LRG1可通过TGF-β信号通路促进上皮细胞增殖和肿瘤新生血管形成。研究证实,LRG1能够促进血管生成,其较少参与正常血管生成,主要是对异常血管生长起作用,并在免疫应答、粒细胞分化、细胞增殖或凋亡、细胞黏附等生理过程中发挥重要作用。LRG1在毛细血管静脉中异常表达,并趋向与细胞外基质蛋白结合,与多种恶性肿瘤的形成密切相关,如消化系统、生殖系统等恶性肿瘤[13,14]。LRG1高表达可显著促进肿瘤血管生成,其分子机制主要为通过调节TGF-β信号通路来发挥作用,在肿瘤侵袭、转移和复发中均具有重要作用[15]。本研究发现,子宫内膜癌组织LRG1 mRNA相对表达量明显高于癌旁正常组织。说明LRG1可参与子宫内膜癌的发生、发展。本研究还发现,LRG1 mRNA表达与临床分期、淋巴结转移有关,并且LRG1高表达者术后5年总生存率明显低于LRG1低表达者。因此推测,LRG1可能通过促进肿瘤血管形成,促进子宫内膜癌的发生、发展。
综上所述,子宫内膜癌组织LAPTM4B-35、LRG1过表达,二者表达变化可能与患者病情进展和预后有关。LAPTM4B-35、LRG1有可能成为子宫内膜癌患者病情判断和预后预测的肿瘤分子标志物。

