青藏高原地区Arctic-like狂犬病病毒的分子流行病学研究
, , , , , , , , , ,
目前,在国内研究狂犬病的主要对象是狗和人类,而较少对野生动物进行研究。然而,近年来,狂犬病病毒(RABV)也已从其他野生动物中分离出来,包括猫、狼、狐狸、大鼠、蝙蝠和家畜,牛、猪、羊和梅花鹿等[1-3]。早在1991年初,在我国内蒙古突泉县[4],狼突然袭击了一个村子,咬伤了人,牛和马。与此同时,在村里发现许多不明原因的狐狸死亡。在2002和2008,许多类似的案件也发生在我国浙江省淳安县和周边地区,随后研究人员从被鼬獾咬伤后死亡的家养动物(狗、猫、猪)中得到狂犬病病毒的全序列[5-6],同时,在2007,研究人员从内蒙古浣熊狗和红狐身上分离出狂犬病病毒[7],2012,韩国科学家在家养的动物(狗和猫)和野生动物(浣熊狗)中检测到狂犬病病毒[8]。自1986以来,我省根据流行病学调查资料和临床诊断结果,20余只家畜在被感染犬或狼咬伤后感染了狂犬病,但是由于实验条件有限,研究人员没有得到实验室资料直到2012和2014年,我们发现在青海省果洛藏族自治州和玉树藏族族自治州发生了类似狼伤人和家畜事件,因此,我们开始收集狗、牦牛脊髓和人类血清和唾液标本的脑组织。对核酸片段进行测序并比较和分析,建立分子进化树,以确定感染的来源和传播途径。
1 材料与方法
1.1收集不同来源的组织样本 2012—2016年我们从青海省不同地区共收集了194个样本,包括果洛州、玉树州、黄南州、海北州、海西州、海南州、海东市。样本包括1例患者血清标本,5人唾液,3只牦牛骨髓,和8只狼和其他动物样本的脑组织(2只猫,1只蝙蝠和3只狐狸),其余142个样本由3种犬的脑组织组成(见表1),第1种是有狂犬病的病犬,有咬伤的人和牦牛,第2种是犬被野狼或狂犬病咬伤,第3种犬是流浪犬或垂死的犬(活的动物是以安乐死的方式处死,死去的动物是取尸体)。
1.2直接免疫荧光法检测狂犬病病毒 取脑组织或脊髓,均匀的涂印在载玻片上(使用前,将玻璃浸泡在无水酒精中30 min)制成组织压印片,用丙酮固定10 min,加入狂犬病病毒荧光素标记的抗RABV-N单克隆(Japanese,Chemicon company)和伊文斯蓝染料在压片上,在37 ℃下孵育30 min后,用PBS液洗涤3次,吹干。用90%甘油封闭片,在荧光显微镜下,可见针尖大小,点状,发绿色荧光的颗粒,疑似高尔基体体(Negri小体)和病毒颗粒[9]。
表1 不同动物样品的组成
Tab.1 The composition of different animals sample
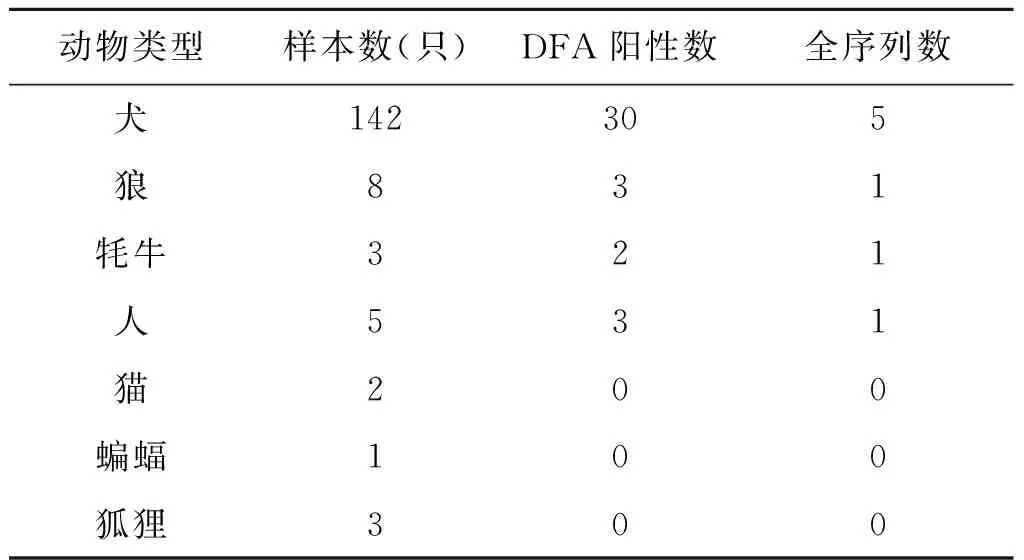
动物类型样本数(只)DFA阳性数全序列数犬142305狼831牦牛321人531猫200蝙蝠100狐狸300
1.3核酸提取与逆转录反应 用TRIzol 法(Ambion, USA)[10-11]从脑组织和脊髓中提取总RNA。Oligo-dT (TaKaRa, Japan)作为一个随机引物,用Ready-To-GoTMYou-Prime First-Strand Beads kit (GE Healthcare, UK)为逆转录反应试剂,根据试剂盒说明书对mRNA进行第一链cDNA的合成。
1.4PCR引物 通过参照NCBI库中8个毒株(AY956319.1, AF499686.2, EF437215.1, HE802676.1, HQ450386.1, KC171645.1, KF155000.1, NC001542.1)的基因组保守区序列设计了7对外引物和7对内引物(见表2),由上海生物工程有限公司合成。
1.5PCR 扩增 用合成的cDNA为模板,用GoTaq Green Master Mix Kit (Promega, USA)对7对外引物和7对内引物片段进行扩增,巢式PCR条件[12]如下:第1次扩增:94 ℃,预变性3 min,94 ℃ 30 s,56℃ 30 s,72℃ 1 min 40 s,共34个循环。第2次扩增为94 ℃,预变性3 min,94 ℃ 30 ℃,56 ℃ 40秒,72 ℃ 30 ℃,35次循环,72 ℃ 10 min,用1.5%琼脂糖凝胶120 V,30 min电泳,用TaKaRa (100 bp-2 000 bpDNA)Markers进行鉴定扩增产物。如果样本显示阳性条带,将其切下用于下一步的实验。
表2 本文中使用的引物序列
Tab.2 Primer reference sequences used in this study
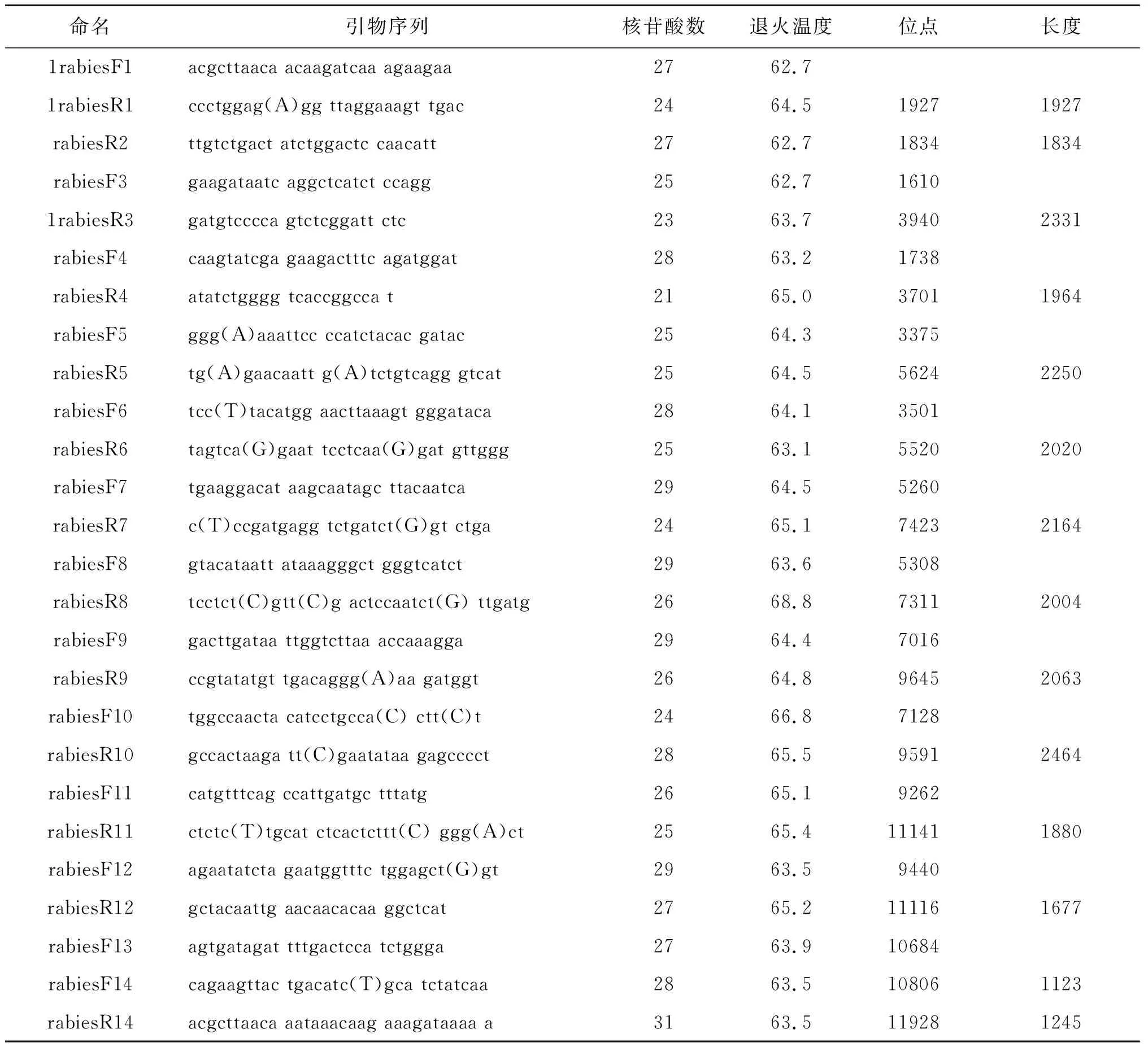
命名引物序列核苷酸数退火温度位点长度1rabiesF1acgcttaaca acaagatcaa agaagaa2762.71rabiesR1ccctggag(A)gg ttaggaaagt tgac2464.519271927rabiesR2ttgtctgact atctggactc caacatt2762.718341834rabiesF3gaagataatc aggctcatct ccagg2562.716101rabiesR3gatgtcccca gtctcggatt ctc2363.739402331rabiesF4caagtatcga gaagactttc agatggat2863.21738rabiesR4atatctgggg tcaccggcca t2165.037011964rabiesF5ggg(A)aaattcc ccatctacac gatac2564.33375rabiesR5tg(A)gaacaatt g(A)tctgtcagg gtcat2564.556242250rabiesF6tcc(T)tacatgg aacttaaagt gggataca2864.13501rabiesR6tagtca(G)gaat tcctcaa(G)gat gttggg2563.155202020rabiesF7tgaaggacat aagcaatagc ttacaatca2964.55260rabiesR7c(T)ccgatgagg tctgatct(G)gt ctga2465.174232164rabiesF8gtacataatt ataaagggct gggtcatct2963.65308rabiesR8tcctct(C)gtt(C)g actccaatct(G) ttgatg2668.873112004rabiesF9gacttgataa ttggtcttaa accaaagga2964.47016rabiesR9ccgtatatgt tgacaggg(A)aa gatggt2664.896452063rabiesF10tggccaacta catcctgcca(C) ctt(C)t2466.87128rabiesR10gccactaaga tt(C)gaatataa gagcccct2865.595912464rabiesF11catgtttcag ccattgatgc tttatg2665.19262rabiesR11ctctc(T)tgcat ctcactcttt(C) ggg(A)ct2565.4111411880rabiesF12agaatatcta gaatggtttc tggagct(G)gt2963.59440rabiesR12gctacaattg aacaacacaa ggctcat2765.2111161677rabiesF13agtgatagat tttgactcca tctggga2763.910684rabiesF14cagaagttac tgacatc(T)gca tctatcaa2863.5108061123rabiesR14acgcttaaca aataaacaag aaagataaaa a3163.5119281245
1.6cDNA测序 MiniBEST Agarose Gel DNA Extraction Kit Ver. 4.0 (TaKaRa) 试剂用于熔化和纯化切下的含DNA片段的琼脂糖,用得到纯化DNA作为模板,用BigDye Terminator v. 3.1 kit (Applied Biosystems, USA)进行了测序反应扩增,扩增的片段通过Performa DTR Gel Filtration Cartridges kit (EdgeBio, USA)进行纯化,(上述实验参照试剂盒说明书),用ABI 3500基因分析仪进行序列测序。
1.7序列分析与系统发育树的构建 用ATGC软件 (GenetyxCo. Tokyo, Japan)校准测序的序列片段,用DNAstar (5.01 version, Laser gene,USA)软件用来拼接序列,The Clustal X 软件[13]用来进行全序列比对,用Mega 2软件包中的The Neighbor Joining(NJ)法[14]构建系统发育树,并用1000个Bootstrap(BP)复制方法估计bootstrap neighbor-joinin tree 的可靠性。
2 结 果
2.1狂犬病病毒抗原检测 在2012—2016年间,我们从青海省玉树、黄南、果洛、海北、海西、海东市等地获得了194个动物脑组织标本,其中有牦牛骨髓、家犬脑组织和自然死亡狼脑组织标本等均用于制成组织压印片。在荧光显微镜下,我们观察到不同大小带荧光的点和点状物,见(图1),从这194种不同的动物获得38个DFA阳性结果。
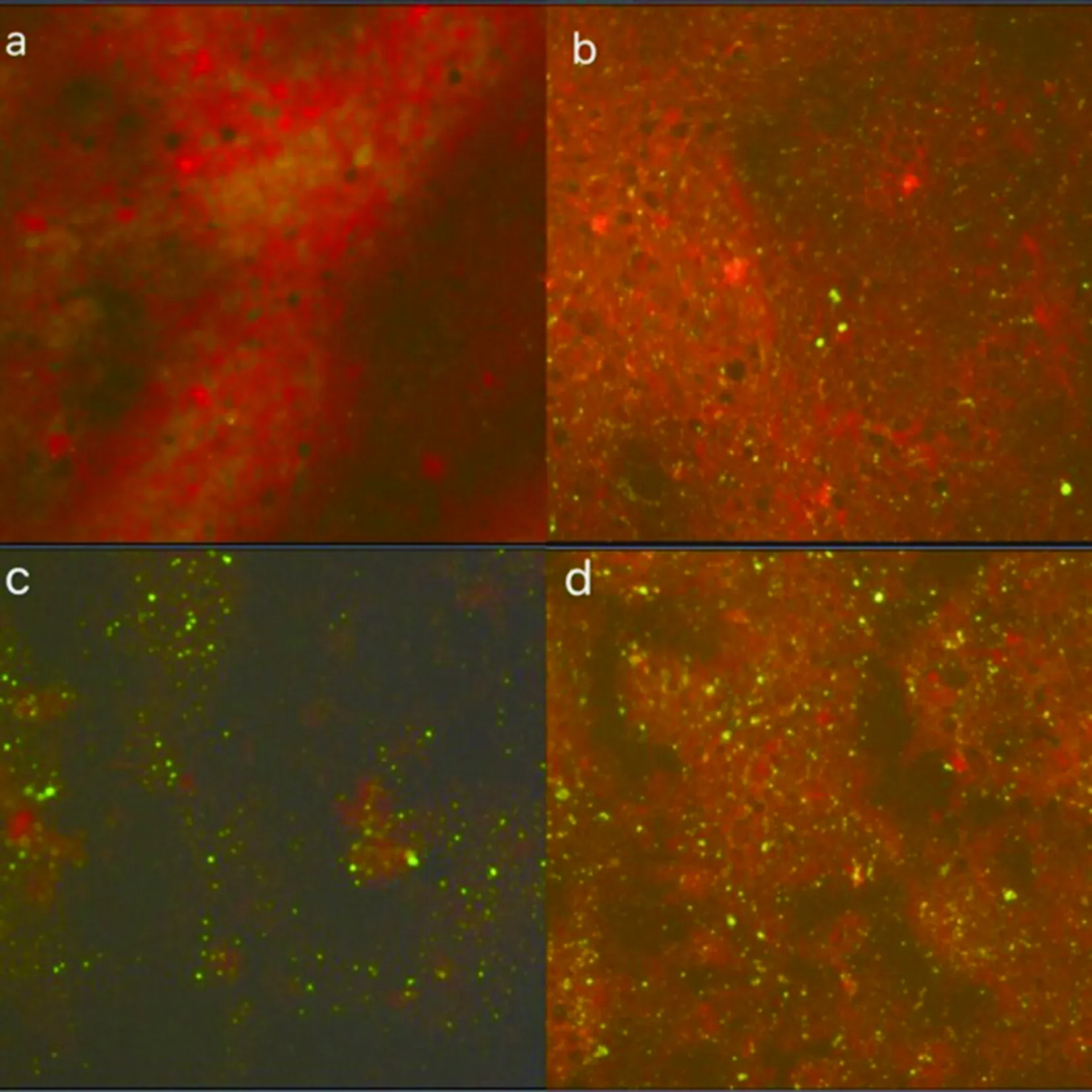
(a)狂犬病病毒抗原阴性犬脑组织;(b)狂犬病病毒抗原阳性的2014狼脑组织;(c)狂犬病病毒抗原阳性2014年牦牛脊髓;(d)狂犬病病毒抗原阳性2014犬脑组织图1 直接免疫荧光法(抗狂犬病病毒N单克隆抗体)检测狂犬病毒核蛋白抗原Fig.1 Detection of rabies virus nucleoprotein antigens by direct immunofluorescent assay with anti-rabies virus N monclonal antibody
2.2流行病学分析 在2012和2016年间,分别在青海省果洛藏族自治州玛多县扎陵湖和鄂陵湖附近,家犬和羊群被狼咬伤后不明原因死亡,同时,两主人被自家的犬咬伤继而感染了狂犬病而死亡,2014年,青海玉树藏族自治州称多县仲达乡和拉卜乡,发生了许多类似的疫情,因为狼咬犬,犬感染狂犬病后咬伤牦牛和羊,同时,人们在村里发现了野狼的尸体。在4年的时间里,我们得到了38个阳性样本,它们主要分布在玉树和果洛藏族自治州(见图2),在海北州或西宁地区没有发现阳性样本,大部分DFA阳性标本分布在青海省西部和南部,而且DFA阳性样品的分布趋势是由西向东递减。在相邻的省份西藏和甘肃,在2012年和2013年,也有狂犬病发生的报告,但是对于2013年来自甘肃的CGS1301D.GS株,属于 China I 型[15],它与青海得到的序列不是相同的基因型别。根据流行病学区域分布数据,青海省狂犬病病毒的传播途径为西向东。在时间分布上,阳性率主要在2014和2015年,阳性样品26个,占总阳性样品的68.42%,2016年开始的阳性病例在减少,主要是因为我省牧区开展家养犬定期接种疫苗和对疯狗捕杀的工作。
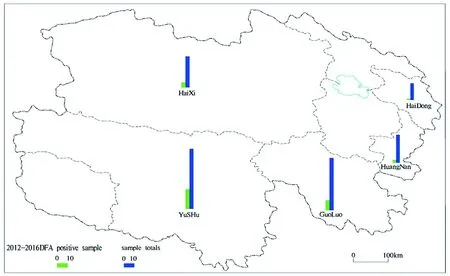
图2 青海地区DFA阳性数和样本的区域分布图Fig.2 The regional distribution of DFA-positive case and samples in Qinghai province
2.3核酸序列分析 通过对38个DFA阳性标本进行核酸序列片段的扩增和测序,通过生物信息学软件将序列直接连接在一起,最终获得8个全长基因组的核酸序列,(其余的样品由于核酸浓度较低,未测序成功)。这8个核苷酸序列提交到GenBank后得到的登录号为:(KY982923、KY99752、KY982922、KY912036、KY952220、KY952219、KY964 323和KY964 322)。狂犬病病毒的基因是典型基因组结构,它由N-P- G-G-L片段组成,第一个开放阅读框(ORF)编码核蛋白(NP)开始于75(CQHY2014W),76(CQHM2016D,CQHY2014D150,CQHY2016D),78(CQHY2014Y)和79(CQHM2012-,CQHY2014D-Y,CQHM2016H)位氨基酸,长度为1 350 bp,编码区起始于ATG密码,终止于TAA或TGA;PP143-148具有高度保守的DKSTQT结构域,保证和Dynin相互作用。在细胞质中,在含有结构脯氨酸PPEY的MP 45-48中,确保功能基的结构不改变;55-58 NLS的GP糖基化位点,265-267的DET,33 3-335 KVS,35-340的NKT,通过分析,我们发现这8个核苷酸序列中相似性和我们实验室在2012年提交的序列CQH2012D(KM27 2192.1)的相似性在95%-100%,在序列结构上没有差异(见表3)。
表3 狂犬病全序列标本基本情况
Tab.3 The basic situation of whole sequence rabies specimen
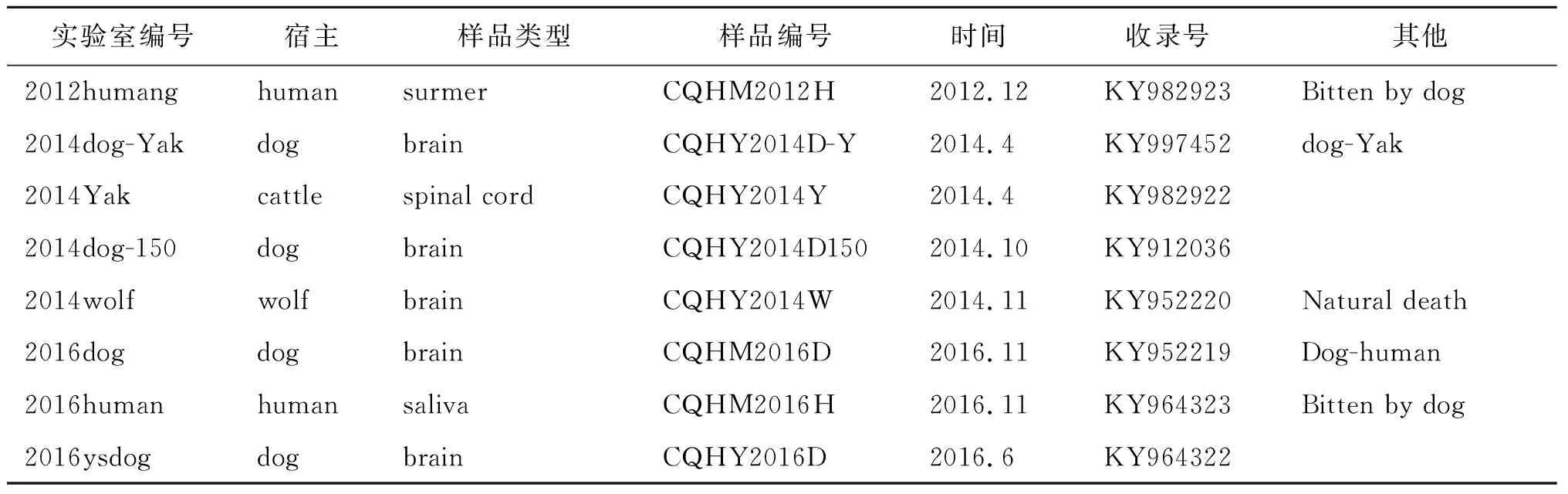
实验室编号宿主样品类型样品编号时间收录号其他2012humanghumansurmerCQHM2012H2012.12KY982923Bitten by dog2014dog-YakdogbrainCQHY2014D-Y2014.4KY997452dog-Yak2014Yakcattlespinal cordCQHY2014Y2014.4KY9829222014dog-150dogbrainCQHY2014D1502014.10KY9120362014wolfwolfbrainCQHY2014W2014.11KY952220Natural death2016dogdogbrainCQHM2016D2016.11KY952219Dog-human2016humanhumansalivaCQHM2016H2016.11KY964323Bitten by dog2016ysdogdogbrainCQHY2016D2016.6KY964322
2.4核苷酸序列的进化分析 我们比较了8株狂犬病病毒开放阅读框(ORF)的G基因和N基因核苷酸序列与来自GenBank中的中国和世界各地35株N基因和38株G基因序列,构建NJ(NJ,复制= 1000)进化树,但N基因和G基因的结果相同。本研究以8个N基因序列和分别来自我省2012年的CQH2012D株(KM27 2192.1)和来自西藏的2012年的CXZ1201D犬(KC46352)株,它们形成一个独立的分支(图3)。按照中国狂犬病病毒分成6个主要基因型(China I-China VI)[15-16]作为参考,我们得到的8个核苷酸序列属于China Ⅳ,与Arctic-like2类病毒高度相关,其中包括2008年在内蒙古分离的neimeng925(FJ415313)和neimeng1025b(EU652445),这些分离株具有非常密切的亲缘关系,他们和在中国其他流行地区分离到的基因型别(Ⅰ-Ⅱ)[9]有很大的区别,(见图3)。虽然我们没有足够的证据发现我国有独立持续存在野生动物中的狂犬病,以前的研究表明所有的结果都是狼的狂犬病是从狗溢出引起的[7]。然而,根据序列的相似性和流行病学的数据分析,表明狂犬病毒在中国青藏高原地区的传播途径是家养动物和人被野生狼或疯犬咬伤后发病。
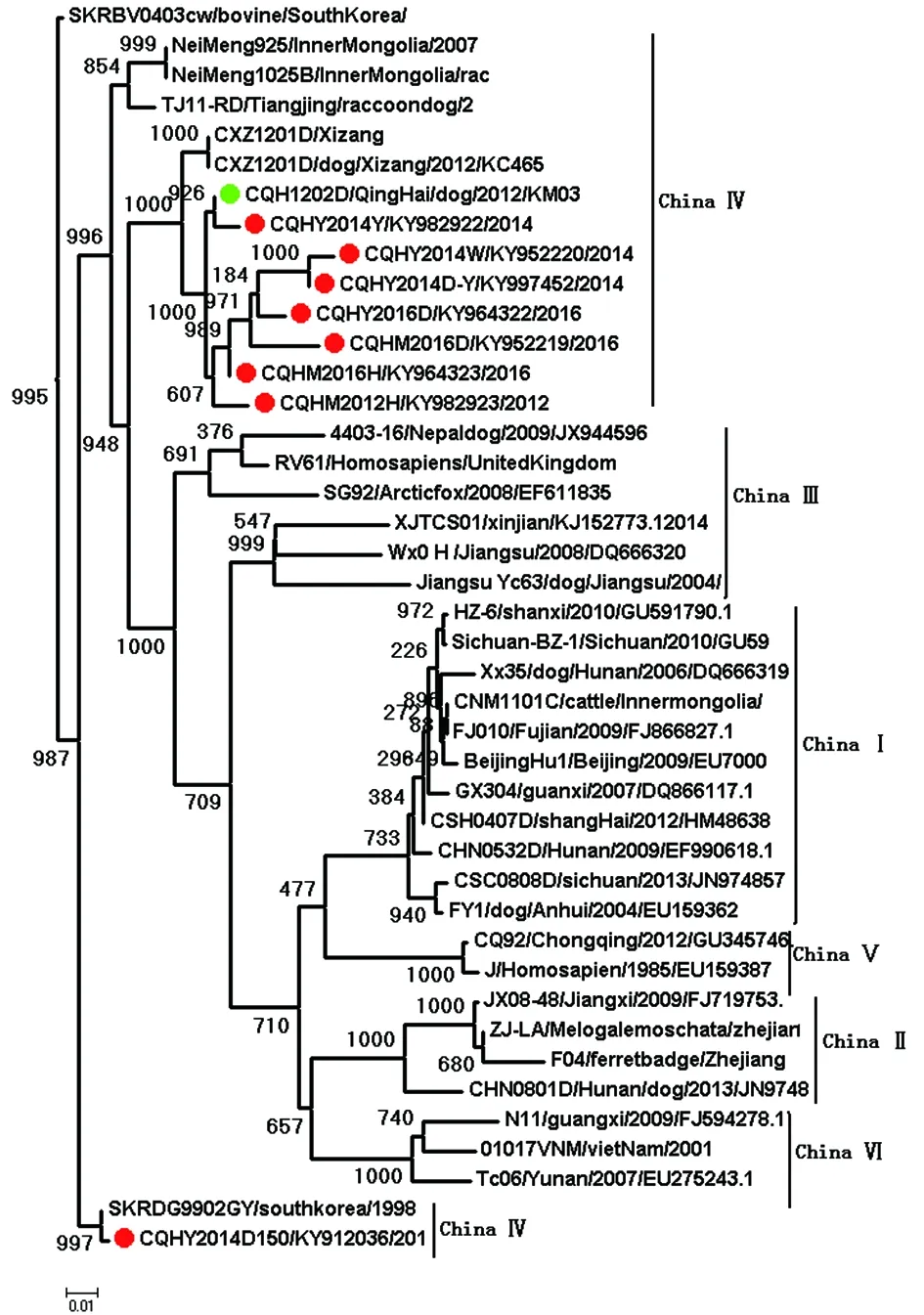
“红点”是青海省疾病预防控制中心提交序列,“绿点”是中国疾病预防控制中心提交序列。图3 基于中国狂犬病病毒和世界其他国家狂犬病病毒N基因开放阅读框(ORF)核苷酸序列的系统发生树Fig.3 Phylogenetic tree base on the open reading frame(ORF) nucleotide sequences of the N geneof Chinese rabies viruses and those from other countrie in the world
3 讨 论
在我国狂犬病病例的报道中大多数是犬类,相对较少发生在牛中[17]。然而,在我国牛的狂犬病也有少量报道,曾发生在新疆和河南省[18-19]。近年来,韩国和其他地方有狂犬病发生在家养动物和野生动物上的报道[20-22],在我们的研究中,在青海省的人和不同动物组织样品(牦牛、狼、狗)中检测到狂犬病病毒。在我们此次的调查中表明狂犬病可以从被野狼咬伤的家养狗传播给家养的牦牛和人,通过青海狂犬病最近流行趋势表明,野生的狼可以在中国西北传播狂犬病。
在中国狂犬病的基因型中,目前ChinaⅠ型为优势型别,其中80%分布在19个省(自治区、直辖市),ChinaⅡ型遍及全国7个省(自治区、直辖市)。然而,中国的Ⅲ,Ⅳ,Ⅴ和Ⅵ组相对发生率较低,其分布区域相对有限[9],我们对本研究获得的8个核酸序列进行了G、N基因核苷酸序列的同源性和进化分析,比较他们与西藏犬XZ1(2012)与和蒙古野生动物的亲缘关系,发现了同属于Arctic-like 群,该群主要分布在世界的北极地区,以及亚洲西部、俄罗斯、内蒙古、韩国等国家和地区,并在野生动物中发现[18],我们此次从青藏高原地区的家畜和野生动物中分离出 Arctic-like2病毒。他们都属于中国Ⅳ组。I. V. Kuzmin在他的研究[23]表明喜马拉雅山脉和西藏的山区可能是野生动物中病毒种群的自然屏障,但我们在研究中发现的证据表明狂犬病可以打破这种自然屏障。我们所获得的序列和2012年从CXZ1201d(KC465372)序列高度相似,这一结果表明Arctic-like2病毒分布在中国的西北部青藏高原地区。此外,由青海病毒阳性的地区分布表明,提示青海由西向东传播狂犬病的趋势与野生动物由西向东的迁移可能有一定关系。
青海位于中国西北部的青海西藏高原、果洛藏族自治州和玉树藏族自治州位于青海省南部,与玉树与西藏、四川、新疆和其他省份接壤。本研究中,38个阳性样品主要分布在玉树州称多县和果洛州玛多县扎陵湖和岭湖,牦牛是青海-西藏高原上较为常见和优质的家畜,由于其对青海恶劣生态条件的适应性强,高山草场和雪地是这些草畜不可缺少的,牦牛在天然草地上放养,使它们易受野生动物伤害。牧民靠放牧牦牛和羊群为生,犬被用来保护主人和家畜。当狼携带狂犬病并咬伤家畜,如犬时,犬会携带狂犬病,那么主人也会被狗咬伤后死于狂犬病。在青藏高原上有许多野生动物,主要包括狼、红狐、棕熊、雪豹、土拨鼠等。2009年,约翰逊[24]在土耳其发现狐狸、牛、猫、松鼠和其他野生动物的狂犬病。2015年中国畜牧业发表的一项研究指出,在我国北方浣熊狗可以传播Arctic-like狂犬病病毒给人和动物。最近的研究表明,其他野生动物(田鼠、狐狸和蝙蝠)也能传播狂犬病病毒[25],在我们的研究中,我们收集了猫、狐狸和蝙蝠的样本,但没有发现阳性标本。这些结果表明,我们应该加强在中国西北地区狂犬病的研究和密切关注其他病毒基因型的传播。
(致谢:作者在卢茁壮博士的指导和帮助下完成了所有的实验室工作和引物设计。卢茁壮博士来自中国疾病预防控制中心,担任青海项目官员的国家顾问。他在我们实验室工作了一年,参与和指导我们的实验市工作。此外,我们还得到了我省的州、县疾病预防控制中心在样本采样和流行病调查工作的支持,在此一并致谢!)

