热处理对14种抗菌药物抗菌活性的影响
孙德祥,张子涵,陶敏慧,马倩倩,鲁子怡,吴 敏,魏泽能,蒋 军*,彭开松*
(1.安徽省水产技术推广总站,安徽合肥 230601;2.安徽农业大学动物科技学院水生健康与公共卫生实验室,安徽合肥 230036)
内服抗菌药物是当前控制水产动物细菌性疾病的主要方式。目前散养户或小型养殖场主要将抗菌药物包裹在颗粒饲料表面后进行投喂。但是,这种方式制作的药饵进入水中后,抗菌药物会很快溶出。抗菌药物的溶出不仅会导致水产动物摄入药饵中的药物浓度降低、疗效减弱甚至无效,而且溶出的药物会释放入水环境中,造成抗菌药物的环境残留和诱导环境细菌的耐药性产生。水环境是重要的耐药基因库,这些被诱导的耐药菌具备经食物链水平传播给人类的风险[1]。将抗菌药物制剂与粉状的饲料原料混合均匀后制粒,不仅可以减少药饵被水产动物摄入前的抗菌药物溶出,而且能减少人工拌药的工作强度,避免出现伴药不均匀的现象[2]。
随着水产饲料加工工艺的进步,特别是调质工艺和膨化工艺发展,饲料物料在加工过程中经历的温度越来越高[3]。一般水产饲料的蒸汽(100 ℃)调质时间为0.5~2.0 min。传统硬颗粒饲料从制粒机出来(物料温度92 ℃)降至环境温度约需10 min。膨化饲料加工中,一般调质腔内温度为73~100 ℃,时间110 s;挤压腔温度一般为85~125 ℃,时间约需数秒。一般认为,由于制粒和膨化的温度均超过80 ℃以上,会对热敏感成分产生较大影响[4]。因此,通过模拟试验来初步评估水产常用抗菌药物对热处理(温度-时间)的稳定性,对于选择药饵制作方法具有重要指导意义。
气单胞菌科气单胞菌属成员是淡水养殖中最常见的致病菌,也是对淡水养殖危害最为严重的一类细菌[5]。笔者以近年来承担的农业部水产动物病原菌耐药性普查项目中使用的14种抗菌药物为测试药物,以临床分离的气单胞菌为测试菌,通过测定药物存储液在热处理前后最小抑菌浓度的变化,来评价热处理对抗菌药物的降解率,以期为渔用药饵制作中能耐受的热处理强度提供参考。
1 材料与方法
1.1抗菌药物恩诺沙星(Enrofloxacin,ENR,批号20171226,含量98.0%)、盐酸环丙沙星(Ciprofloxacin hydrochloride,CIP,批号20171123,含量98.0%)、氨苄西林钠(Ampicillin sodium,AMP,批号20171212,含量98.6%)、氟苯尼考(Florfenicol,FFC,批号20170912,含量98.6%)、硫酸新霉素(Neomycin sulfate,NEO,批号20170920,含量98.5%)、磺胺间甲氧嘧啶(Sulfamonomethoxine,SMM,批号20171107,含量98.5%)、磺胺嘧啶(Sulfadiazine,SD,批号20170927,含量98.6%)、磺胺甲噁唑(Sulfamethoxazole,SMZ,批号20171220,含量95.5%)、磺胺二甲嘧啶(Sulfadimidine,SMD,批号20171022,含量96.8%)由华北制药集团有限责任公司生产。硫氰酸红霉素(Erythromycin thiocyanate,ERT,批号20171125,含量98.0%)、交沙霉素(Josamycin,JOS,批号20170923,含量96.5%)、盐酸多西环素(Doxycycline hydrochloride,DOX,批号20171125,含量98.5%)、盐酸土霉素(Oxytetracycline,OTC,批号20171224,含量98.8%)、甲砜霉素(Thiamphenicol,TPC,批号20171125,含量98.8%)均由浙江国邦药业有限公司生产。
1.2测试菌株大肠杆菌(Escherichiacoli)ATCC 25922、嗜水气单胞菌(Aeromonashydrophila)18J008、凡隆气单胞菌凡隆生物型(Aeromonasveroniissp.Veronii)18J022、凡隆气单胞菌温和生物型(Aeromonasveroniissp.Sobria)18J075、豚鼠气单胞菌(Aeromonascaviae)18J085、杀鲑气单胞菌(Aeromonassalmonicida)18J001均由安徽农业大学水生健康与公共卫生实验室保存。
1.3抗菌药物储备液的配制按照欧盟标准配制上述14种抗菌药物的存储溶液[6],经0.22 μm过滤除菌,分装到细胞冻存管中。氨苄西林钠用0.1 mol/L磷酸缓冲液(pH 8.0)溶解。磺胺嘧啶、磺胺甲噁唑、磺胺二甲嘧啶,先加1/2体积水,然后加入1.0 mol /L NaOH至溶解,补蒸馏水到所需体积。磺胺间甲氧嘧啶、盐酸土霉素、恩诺沙星、盐酸环丙沙星,先加1/2体积水,然后加入2.5 mol /L NaOH至溶解,补蒸馏水到所需体积。硫酸新霉素、强力霉素,用水溶解。氟苯尼考、甲砜霉素、硫氰酸红霉素、交沙霉素用95.0%乙醇溶解。
1.4药物的热降解率测定根据试验目的,分别在90 ℃水浴锅中处理10和30 min;在沸水浴(100 ℃)中分别处理10和30 min;在高压蒸汽灭菌锅中,分别在115 ℃、20 min或121 ℃、15 min下处理。
药物存储液按上述处理后,按照欧盟标准方法[6],测定药物对上述细菌的最小抑菌浓度(MIC)。细菌本身对某种抗菌药物的敏感性未发生变化,药物对某种细菌MIC测定值的升高倍数,代表药物热降解的倍数[6]。未经过热处理的某药物溶液对某细菌的最小抑菌浓度(MIC实际值)是该药对该菌的实际敏感性。MIC实际值>64 μg/mL的菌药组合数据,由于该菌对该药物具有耐药性,故不能用于后续热稳定评价,视为无效数据。经热处理后,部分药物发生热降解,导致MIC测定值增加。根据药物在热处理前后对某种细菌的MIC测定值的变化,按照以下公式计算药物热降解率(%):药物热降解率=[1-(MIC实际值/MIC测定值)]×100%。
鉴于该方法允许一定误差,若热降解率为0或50%,则视为热稳定或能耐受该温度-时间处理,记为A;若热降解率为75%或87.5%,则视为比较稳定或者基本能耐受此温度-时间处理,记为B;若热降解率大于等于93.8%,则视为不稳定或者不能耐受此温度-时间处理,记为C。
2 结果与分析
2.1测试菌株对抗菌药物的敏感性由表1可知,未经热处理抗菌药物对测试菌的MIC值中,除氨苄西林钠对凡隆气单胞菌温和生物型和豚鼠气单胞菌、磺胺嘧啶对大肠杆菌、磺胺间甲氧嘧啶对凡隆气单胞菌温和生物型和凡隆气单胞菌凡隆生物型及豚鼠气单胞菌、硫酸新霉素对凡隆气单胞菌温和生物型、硫氰酸红霉素对豚鼠气单胞菌的MIC值大于64 μg/mL外,其余均可用于后续热处理对药物稳定性的评价。
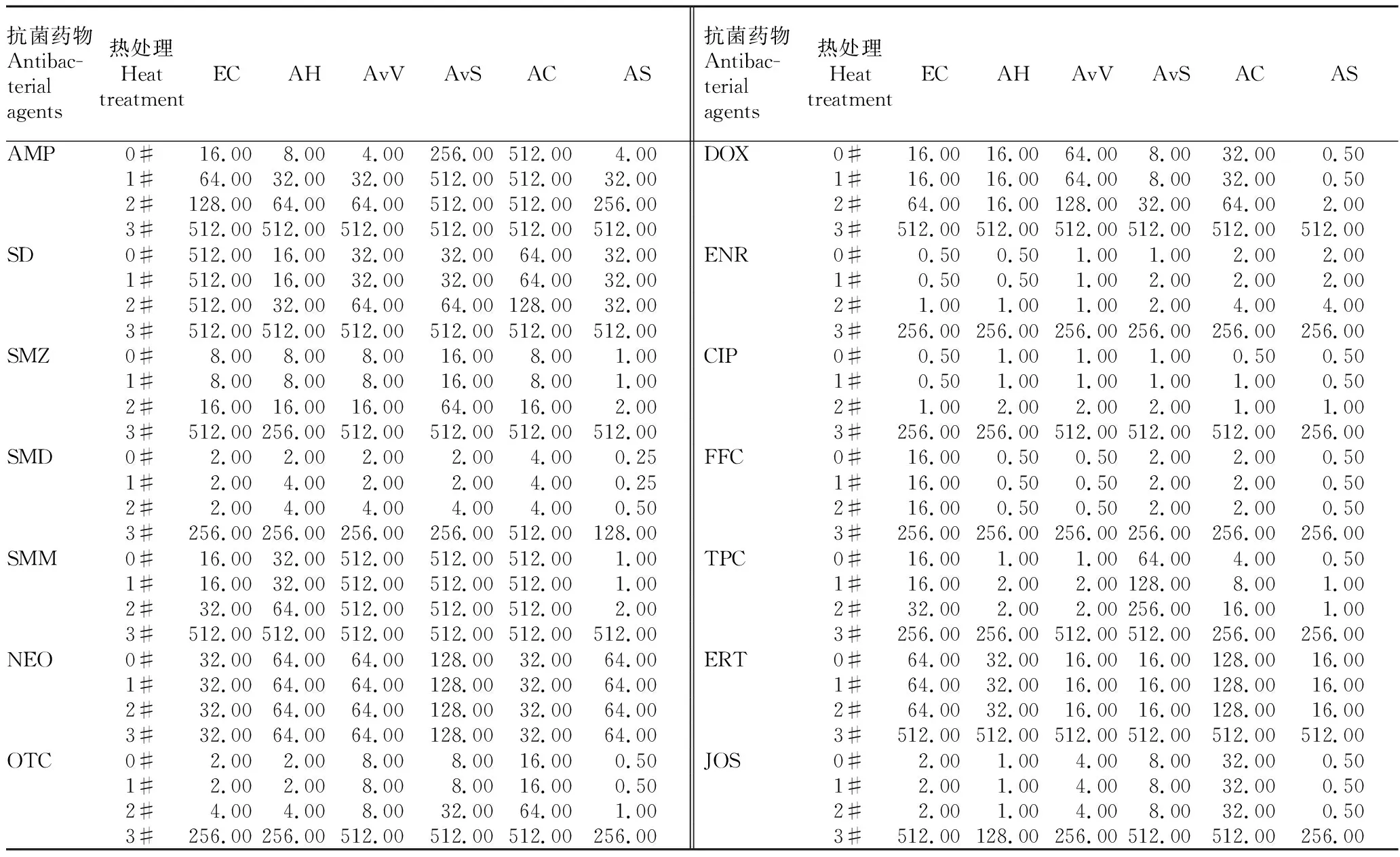
表1 热处理对14种抗菌药物MIC值的影响
注:0#,未经热处理药物的MIC实际值; 1#,90 ℃10 min热处理后的MIC测定值; 2#,90 ℃30 min处理后的MIC测定值; 3#;100 ℃10 min处理后的MIC测定值。EC,大肠杆菌ATCC 25922;AH,嗜水气单胞菌18J008;AvV,凡隆气单胞菌凡隆生物型18J022;AvS,凡隆气单胞菌温和生物型18J075;AC,豚鼠气单胞菌18J085;AS,杀鲑气单胞菌18J001
Note:0#,actual value of MIC of antibacterial agents without heat treatment;1#,measured value of MIC of antibacterial agents after heat treatment 10 min at 90 ℃;2#,measured value of MIC of antibacterial agents after heat treatment 30 min at 90 ℃; 3#,measured value of MIC of antibacterial agents after heat treatment 10 min at 100 ℃.EC,E.coliATCC 25922;AH,A.hydrophila18J008;AvV,A.veroniissp.Veronii18J022;AvS,,A.veroniissp.Sobria18J075;AC,A.caviae18J085;AS,A.salmonicida18J001
2.2热处理降解抗菌药物对MIC测定值的影响由表1可知, 90 ℃10 min热处理对氨苄西林钠的MIC测定值有明显的影响(MIC测定值降低4或8倍),对磺胺二甲嘧啶、恩诺沙星/盐酸环丙沙星少部分菌升高2倍外;其余均无影响。90 ℃30 min热处理除对甲砜霉素、硫氰酸红霉素、交沙霉素无影响外,对其他药物的MIC测定值增加了2倍或4倍。100 ℃10 min处理对该试验中测试的14种抗菌药物的MIC测定值增加了8倍到1 024倍不等。
2.3药物热稳定性的综合评价由表2可知,90 ℃处理10 min或30 min,试验所用14种抗菌药物的热降解率较低,对其MIC测定值影响较小。但是,100 ℃10 min处理中,抗菌药物的热降解率很高,对其MIC测定值的影响很大。该研究中同时测定了100 ℃30 min、115 ℃20 min、121 ℃15 min处理对抗菌药物MIC测定值的影响,在这些处理条件下各药物的抗菌活性均遭到破坏。
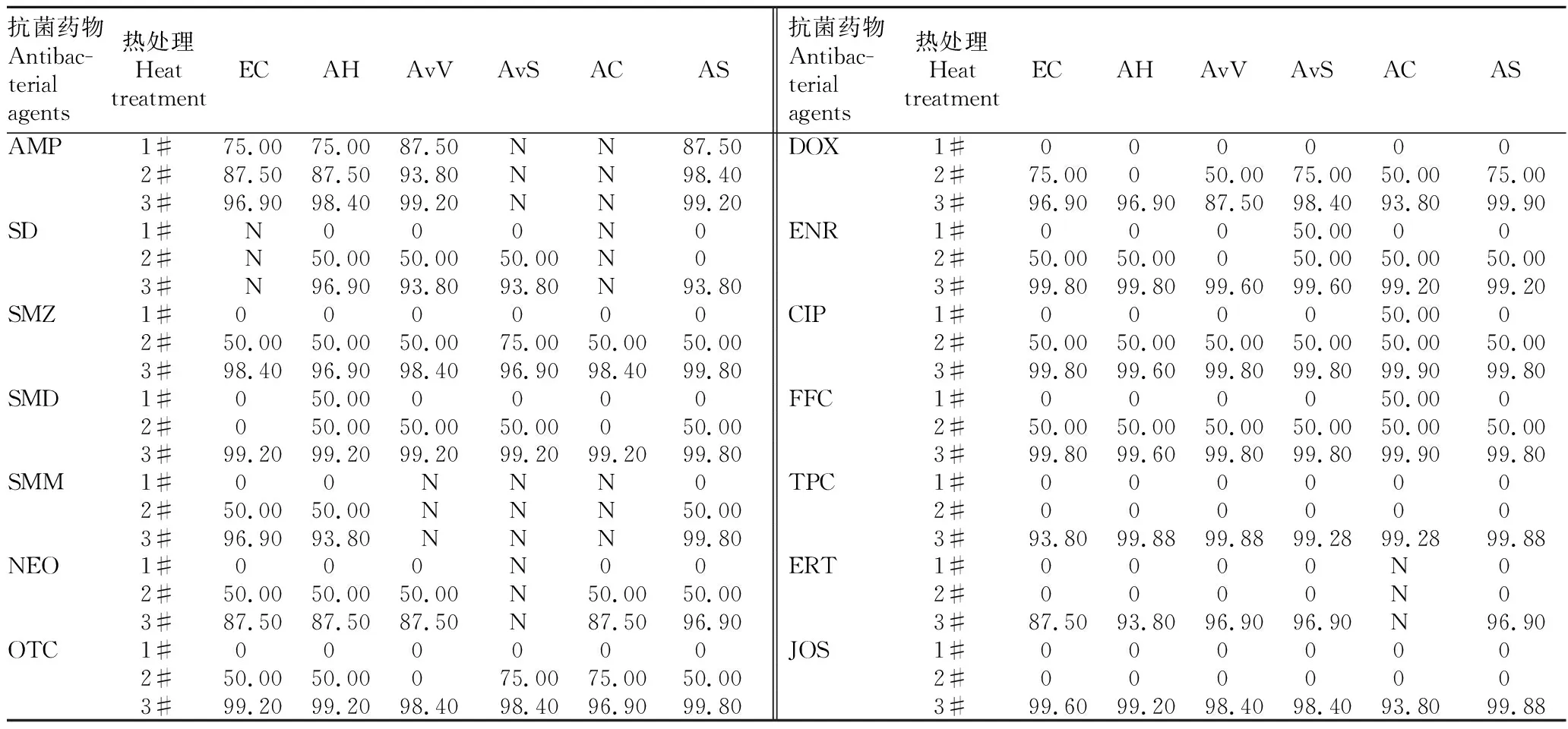
表2 微生物法测定的14种抗菌药物的热降解率比较
注:1#,90 ℃10 min; 2#,90 ℃30 min; 3#,100 ℃10 min。EC,大肠杆菌ATCC 25922;AH,嗜水气单胞菌18J008;AvV,凡隆气单胞菌凡隆生物型18J022;AvS,凡隆气单胞菌温和生物型18J075;AC,豚鼠气单胞菌18J085;AS,杀鲑气单胞菌18J001。N代表无效数据
Note:1#,90 ℃10 min;2#, 90 ℃30 min;3#;100 ℃10 min;EC,E.coliATCC 25922;AH,A.hydrophila18J008;AvV,A.veroniissp.Veronii18J022;AvS,,A.veroniissp.Sobria18J075;AC,A.caviae18J085;AS,A.salmonicida18J001;N stands for non-effective data
根据综合评价标准,由表3可知,此次评价的14种抗菌药物中热稳定性最差的抗菌药有氨苄西林钠(AMP),热稳定较差的抗菌药有盐酸土霉素(OTC)。热稳定性最好的抗菌药物有硫酸新霉素和硫氰酸红霉素;其他抗菌药物的热稳定性中等。
表3微生物法测定的14种抗菌药物的热稳定性综合评分
Table3Thecomprehensivescoreofthermalstabilityof14kindsofantibacterialagentsdeterminedbymicrobialmethod
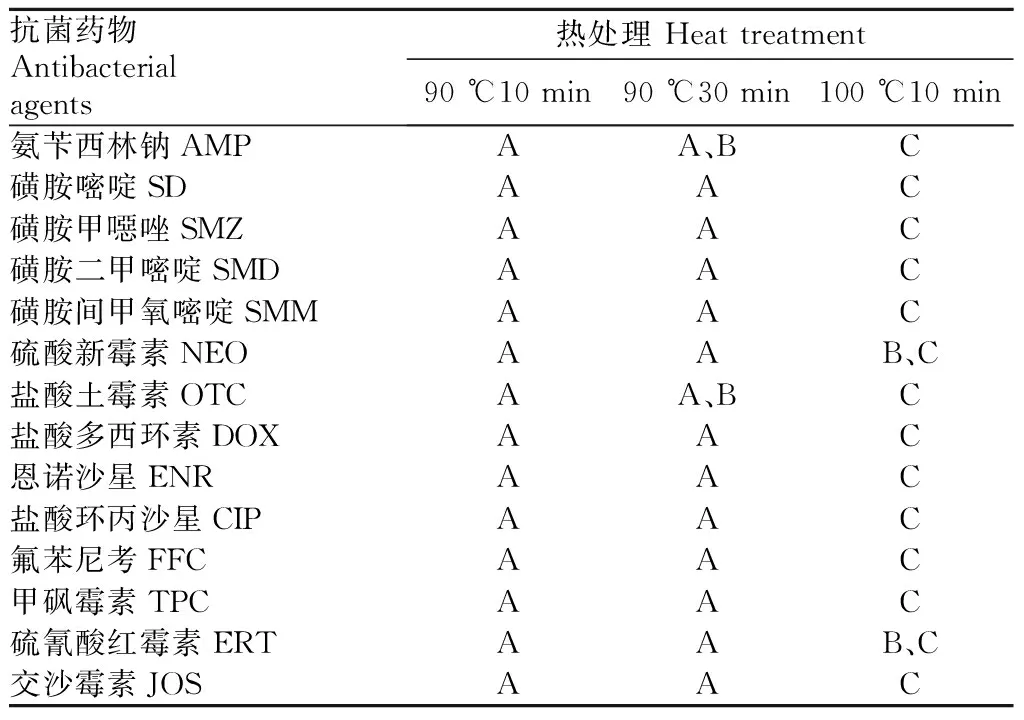
抗菌药物Antibacterialagents热处理 Heat treatment90 ℃10 min90 ℃30 min100 ℃10 min氨苄西林钠AMPAA、BC磺胺嘧啶SDAAC磺胺甲噁唑SMZAAC磺胺二甲嘧啶SMDAAC磺胺间甲氧嘧啶SMMAAC硫酸新霉素NEOAAB、C盐酸土霉素OTCAA、BC盐酸多西环素DOXAAC恩诺沙星ENRAAC盐酸环丙沙星CIPAAC氟苯尼考FFCAAC甲砜霉素TPCAAC硫氰酸红霉素ERTAAB、C交沙霉素JOSAAC
3 结论与讨论
该研究中对14种抗菌药物的热耐受能力测定结果表明,这些药物基本能耐受传统环模硬颗粒饲料制粒中所需要承受的温度[3-4]。因此,可以将药物与粉末状饲料原料混合均匀后制粒,提高水产动物口服给药的精准性,减少抗菌药物浪费和抗菌药物残留的生态风险[1]。
Hsieh等[7]研究表明,氨苄西林在100 ℃15 min水浴处理后,其MIC值没有变化;在121 ℃15 min水浴处理后,药峰面积下降70%,但MIC值仅仅降低2倍。强力霉素水溶液在100 ℃水浴中15 min,对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌的MIC值没有变化;但药物浓度(色谱峰值)降低了30%。但土霉素在100 ℃15 min处理对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌的MIC值分别增加32或64倍以上[7],与该研究结果相似。由此可见,土霉素的热稳定性比强力霉素差。Lolo等[8]研究显示,恩诺沙星水溶液在100 ℃水浴中能维持稳定长达3 h。Franje等[9]研究表明氟苯尼考和甲砜霉素在100 ℃热水浴中加热2 h,降解率低于20%,且对大肠杆菌和金黄色葡萄菌MIC没有变化。
总体来看,该研究测定的14种抗菌药物原粉的热稳定性要比国外研究文献报道的差一些[7-9]。该差异可能与此次使用是国产原粉,而不是标准品有关;也可能与试验中采用的菌株或方法有关[6-8]。该研究结果表明,除氨苄西林外,90 ℃ 30 min处理基本不影响其他抗菌药物的活性。

