不同诱变处理对紫花苜蓿生理生化指标的影响
申晓慧,冯 鹏,李如来,姜 成,李增杰,李志民,王 强
(1黑龙江省农业科学院佳木斯分院,黑龙江佳木斯154007;2佳木斯大学生命科学学院,黑龙江佳木斯154007;3黑龙江省农业科学院作物育种研究所,哈尔滨150001)
0 引言
引起作物诱变变异的外界因素主要有两个方面,一是物理因素,二是化学因素。作物诱发变异与自然变异相比较,具有如下特点:诱发变异能够增加突变频率、扩展变异类型、加大基因重组几率、拓宽突变谱等特征,缩短筛选出具有利用价值的突变单株,减少育种年限[1-4]。当前,国内植物诱变技术已经很成熟,技术方法多样化,在物理诱变、化学诱变乃至航天诱变研究方面均取得了良好效果,并在诱变机理分析方面进行了详细研究,同时针对植物特异性目标进行不断改良、优化,极大地提高了作物诱变效率。然而不同诱变处理方式影响着植物生长发育的不同方面,生理生化研究是诱变育种选择的重要辅助手段之一。任卫波等[5]利用实践八号搭载苜蓿种子研究表明,苜蓿诱变后糖类与脂类含量较诱变前下降。尹淑霞等[6]采用60Co-γ射线辐照黑麦草种子,研究结果发现黑麦草经60Co-γ射线辐照后,其过氧化物同工酶发生变化,后代材料中POD同工酶酶谱特征也因辐照剂量不同而变化。韩微波等[7]利用卫星搭载苜蓿种子研究其生理特性,结果表明,搭载后不同苜蓿品种苜蓿过氧化氢酶(POD)活性呈现增加趋势,可溶性蛋白含量有升高,但超氧物歧化酶(SOD)活性则下降。李秀贞等[8]采用不同射线辐射如60Co-γ射线、激光、快中子辐射小麦种子,结果表明小麦可溶性蛋白质含量明显增加,增加幅度最大的比对照材料高出9.09%。
紫花苜蓿(Medicago sativaL.)作为多年生豆科牧草在世界范围内被广泛种植。紫花苜蓿是中国牧草栽培面积最大,经济、社会效益最好的豆科牧草[9-11]。目前,随着中国种植业结构不断调整和草地生态建设逐步壮大,苜蓿产业发展空间上升,种植面积尤其是紫花苜蓿种植数量呈逐年增加趋势[12]。作为产粮和畜牧业大省的黑龙江省,地理位置特殊,具有纬度高、气候寒冷的特性,但是其独特的气候条件特点,使一些高产高效紫花苜蓿品种的生产收到了极大限制。本试验通过开展植物诱变技术对当地主栽品种进行不同诱变处理,通过分析其对生理生化指标的影响,以期筛选出适宜的诱变处理方法,为提高中国北方苜蓿抗性研究及苜蓿诱变育种提供技术参考。
1 材料与方法
1.1 试验试材
供试苜蓿品种为‘ 公农 1号 ’、‘Wega7F’、‘WL319HQ’、‘敖汉苜蓿’,‘WL319HQ’苜蓿种子由北京正道生态科技有限公司提供,‘Wega7F’、‘公农1号’、‘敖汉苜蓿’种子,由黑龙江省畜牧研究所提供。
1.2 试验设计
试验于2015年12月对4种紫花苜蓿干种子进行诱变处理,方法如下:
60Co-γ射线:4个苜蓿品种种子进行60Co-γ射线辐照处理,设计剂量为150、300、450 Gy,以0剂量为对照处理,3次重复,处理时间为7天。
紫外线:选取筛选过苜蓿干种子将其包于纱布中,用45℃的蒸馏水浸泡1 h,之后0.1%的氯化汞溶液将处理好的种子进行消毒8~10 min。最后用无菌蒸馏水反复清洗3~5次,紫外灯瓦数为40 W,照射距离为距离种子同水平位置40 cm处,照射时间分别为30、60、90 min。3次试验重复。
甲基磺酸乙酯(EMS):选取筛选过苜蓿干种子,用浓硫酸浸泡4~5 min后蒸馏水反复冲洗5~6次。再用事先配置好的4℃磷酸缓冲液(100 mmol/L,pH 7.0)浸泡15 h使种子完全吸水膨胀。最后将种子浸泡在EMS浓度为0.1%、0.2%、0.4%(v/v)的溶液(磷酸缓冲液配制)再放置在室温黑暗条件15 h,期间对种子进行摇动使其充分吸收药液,之后蒸馏水反复冲洗,去除残留种子表面的EMS溶液。试验设3次重复。
不同诱变处理后种子盆栽,幼苗长至成苗时移栽至佳木斯分院苜蓿试验田,苜蓿移栽株距30 cm,行距45 cm。期间正常苜蓿大田管理。
1.3 测定项目及方法
于紫花苜蓿盛花期(7月末)随机采取10株新鲜功能叶片混匀用于各生理指标测定。氮蓝四唑法[13]测定SOD活性,愈创木酚法[13]测定POD活性,紫外分光光度法测定过氧化氢酶(CAT)活性[14]。硫代巴比妥酸法[15]测定MDA浓度。考马斯亮蓝法[15]测定可溶性蛋白含量。蒽酮比色法[15]测定可溶性糖含量,磺基水杨酸法[15]测定脯氨酸含量。
1.4 统计分析
所采集试验数据处理用Microsoft Excel 2007和SAS8.0(SASInstituteInc.,2006)软件进行数据统计分析。
2 结果与分析
2.1 不同诱变处理对紫花苜蓿SOD活性的影响
由表1可以看出,不同诱变处理对紫花苜蓿叶片SOD活性影响不同。其中60Co-γ辐射处理促进了苜蓿SOD的积累,且均高于对照,150 Gy剂量下,除‘敖汉’苜蓿外,其他品种的SOD活性显著高于对照,而450 Gy高剂量下,‘敖汉’的SOD活性显著高于对照。除‘敖汉’外其他品种的SOD活性随处理剂量的增加呈现下降的趋势,而‘敖汉’苜蓿SOD活性变化与之相反;紫外线处理对苜蓿SOD活性变化表现为低剂量促进髙剂量抑制,且随着处理紫外线照射时间的延长,除‘Wega7F’SOD活性呈现上升趋势外,其他品种SOD活性均呈下降趋势;EMS处理对4种苜蓿SOD活性的影响不显著,SOD活性变化均随处理剂量的增加而提高,低剂量处理下对SOD活性起抑制作用,高剂量下起促进作用。
2.2 不同诱变处理对紫花苜蓿POD活性的影响
由表2可以看出,60Co-γ、紫外线和EMS处理对苜蓿POD活性的影响总体上表现为促进作用,不同诱变处理之间的促进程度不同,60Co-γ辐射对苜蓿影响为随处理剂量的增加促进程度下降,紫外线处理则是随着照射时间的延长POD活性增强,而EMS对苜蓿POD活性影响因品种不同而不同,对‘公农1号’和‘WL319HQ’POD活性影响为随EMS浓度的增加而增强,对另外2个品种的影响则是随EMS浓度的增加而下降。整体来说,150 Gy60Co-γ、90 min紫外线处理对苜蓿POD活性提高较大。

表2 诱变处理对苜蓿过氧化物酶(POD)活性的影响 U/(g FW·min)
2.3 不同诱变处理对紫花苜蓿CAT活性的影响
从表3中可知,苜蓿CAT活性在不同种类诱变处理下总体上表现为促进作用大于抑制作用,苜蓿CAT活性变化随60Co-γ处理剂量的提高呈下降趋势,除对‘敖汉’苜蓿CAT活性表现低剂量促进,高剂量(450 Gy)抑制外,对其他品种均表现为促进作用,‘公农1号’、‘Wega7F’和‘WL319HQ’CAT的活性在紫外线处理下表现为随照射时间的延长而提高,其中‘WL319HQ’的CAT活性提高最大,最大值为731.73 U/(g FW·min),是对照的2.57倍,紫外线处理想‘敖汉’苜蓿的CAT活性呈现出高-低-高的变化趋势,30、60 min紫外线处理抑制了‘敖汉’。‘公农1号’、‘Wega7F’和‘WL319HQ’的CAT活性在EMS处理下呈现增加趋势,‘敖汉’苜蓿的CAT活性在0.1%和0.4%的EMS浓度下呈增加趋势,且与对照达到差异显著(P<0.05)水平。
2.4 不同诱变处理对紫花苜蓿MDA浓度的影响
从表4中可知,不同诱变处理下供试苜蓿品种细胞MDA浓度变化不显著,多数诱变处理对MDA浓度的影响以增加为主。60Co-γ辐射处理提高了‘公农1号’和‘Wega7F’的MDA浓度,150 Gy的60Co-γ辐射降低了‘WL319HQ’和‘敖汉’苜蓿的MDA浓度,低剂量紫外线处理下各品种MDA浓度下降,90 min紫外线处理下MDA浓度略有增加,除‘敖汉’苜蓿外,各品种在0.1%的EMS处理下MDA浓度均高于对照,且随着EMS浓度增加MDA浓度呈下降趋势,0.4%EMS处理下各品种的MDA浓度均下降。
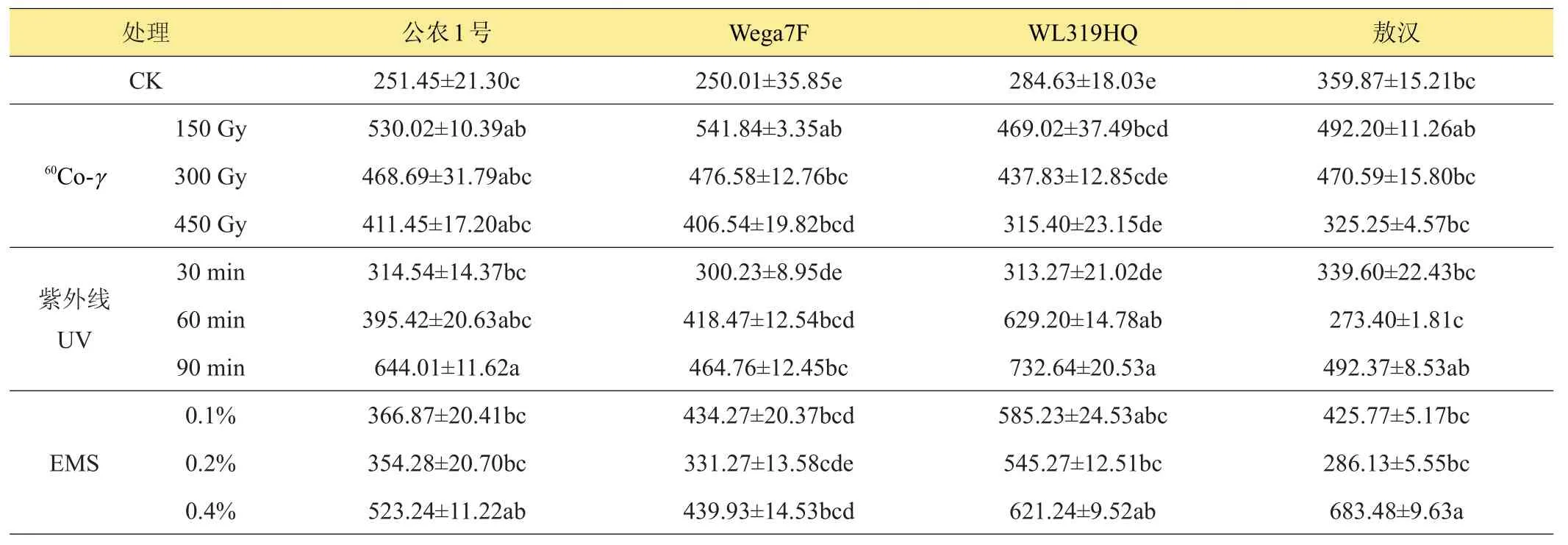
表3 诱变处理对苜蓿过氧化氢酶(CAT)活性的影响 U/(g FW·min)

表4 诱变处理对苜蓿丙二醛含量(MDA)的影响 μmol/g
2.5 不同诱变处理对紫花苜蓿可溶性蛋白含量的影响
由表5可以看出,60Co-γ、紫外线和EMS处理后苜蓿植株叶片可溶性蛋白含量的影响不明显,60Co-γ处理对各品种可溶性蛋白含量影响不同,‘公农1号’在60Co-γ辐射处理下可溶性蛋白含量变化趋势表现为低促高抑,均达到显著水平(P<0.05),在中、低浓度时,显著促进了敖汉可溶性蛋白含量的提高‘,Wega7F’和‘WL319HQ’可溶性蛋白含量受60Co-γ辐射影响较小;‘公农1号’的可溶性蛋白含量在紫外线诱变处理下低于对照‘,Wega7F’‘、WL319HQ’和‘敖汉’在紫外线处理下可溶性蛋白含量表现为低浓度下降和高浓度提升;低浓度EMS处理抑制‘公农1号’和‘Wega7F’可溶性蛋白含量,高浓度EMS处理促其含量增加,EMS处理提高了‘WL319HQ’可溶性蛋白含量,对‘敖汉’可溶性蛋白含量影响呈现为低促髙抑的变化趋势。
2.6 不同诱变剂处理对苜蓿可溶性糖含量的影响
由表6可以看出,60Co-γ、紫外线和EMS对苜蓿植株叶片可溶性糖含量促进作用大于抑制作用,‘公农1号’和‘Wega7F’在60Co-γ处理下可溶性糖含量略低于对照,而‘WL319HQ’可溶性糖含量略高于对照,表明60Co-γ诱变处理对其有一定的促进作用,而对‘敖汉’可溶性糖含量的影响表现为低浓度的抑制和高浓度的促进;紫外线处理对‘公农1号’、‘WL319HQ’和‘敖汉’可溶性糖含量的影响表现为低剂量促进而高剂量抑制,但紫外线处理对‘Wega7F’可溶性糖含量的表现为促进作用;EMS处理对各品种可溶性糖含量影响各不相同。
2.7 不同诱变剂处理对苜蓿脯胺酸含量的影响
由表7可以看出,3种诱变处理对各品种苜蓿脯胺酸含量的影响不同,60Co-γ和紫外线处理对各品种苜蓿游离脯氨酸影响整体上表现为抑制程度高于促进程度,450 Gy60Co-γ辐照下,苜蓿脯氨酸含量高于对照,‘公农1号’和‘Wega7F’在紫外线处理下,游离脯胺酸含量明显下降,‘WL319HQ’和‘敖汉’在紫外线处理下,低剂量下游离脯氨酸含量受到抑制作用,高剂量下受到促进作用,EMS处理下‘公农1号’和‘Wega7F’脯胺酸含量下降明显,‘WL319HQ’和‘敖汉’脯胺酸含量提高,且随浓度变化提高幅度不同。

表5 不同诱变处理对苜蓿可溶性蛋白含量的影响 mg/g
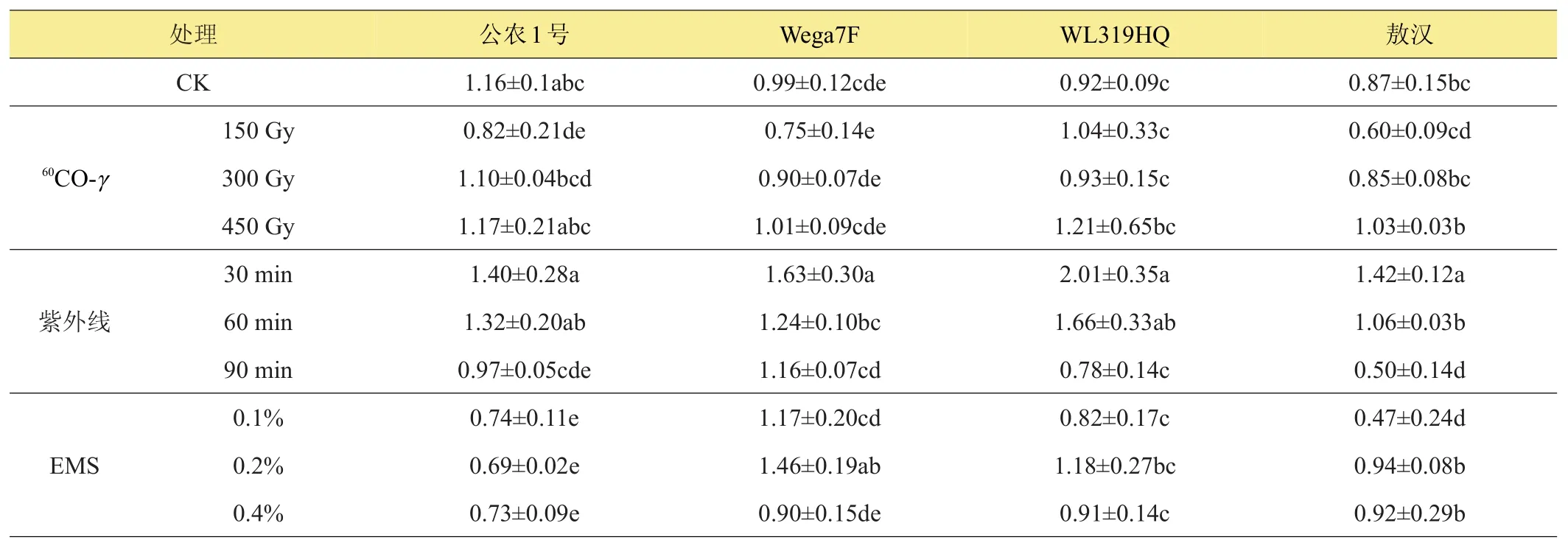
表6 不同诱变处理对苜蓿可溶性糖含量的影响 %
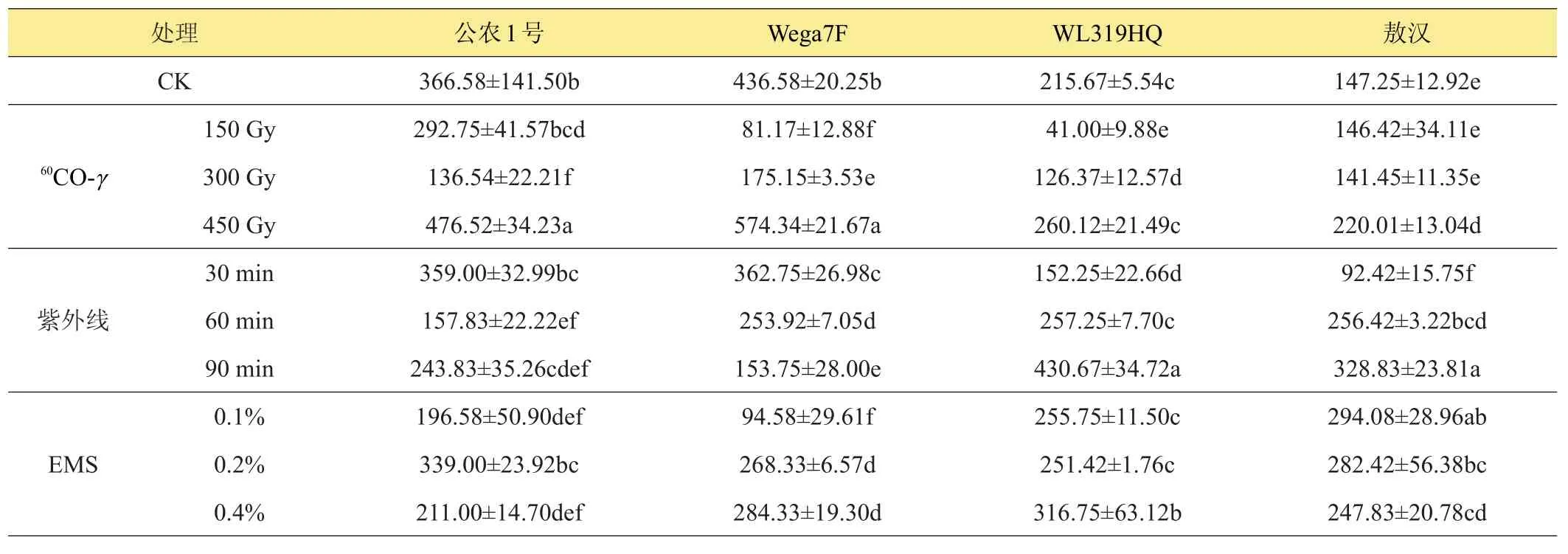
表7 不同诱变处理对苜蓿脯胺酸含量的影响 μg/g
3 讨论
植物体内的活性氧自由基清除剂含量的高低对植物抗逆性具有十分重要的意义,超氧化物歧化酶(SOD)、过化物酶(POD)和过氧化氢化酶(CAT)三者在机体抵御胁迫损伤时相辅相成,共同发挥着保护作用[16],为防止自由基伤害,使生物体内自由基保持在一个低水平状态下[17-19]。苜蓿在受到外界环境条件诱变刺激时,细胞内自由基数量增加,这些自由基的产生会破坏正常的细胞代谢平衡及膜系统结构与功能的稳定性,加剧了膜脂过氧化作用,而细胞中的3种抗氧化酶系统如超氧化物歧化酶、过化物酶和过氧化氢化酶能够在机体抵御胁迫损伤时相辅相成,对细胞共同发挥保护作用[20-21]。本试验中,苜蓿SOD、POD和CAT活性在各诱变处理下总体上呈现出升高的趋势,说明通过诱变可以提高苜蓿体内3种抗氧化酶活性,抗氧化酶活性的增加有利于清除氧自由基,防御诱变损伤。诱变后各品种MDA的含量表现为,除个别诱变处理略有升高外,其他处理均低于对照,也进一步说明抗氧化酶活性提高对苜蓿细胞代谢平衡起到协调和保护作用,避免了苜蓿受诱变胁迫的伤害。
可溶性蛋白和可溶性糖都可以通过调节渗透压来抵抗胁迫损伤,进而对细胞的生命物质及生物膜起到保护作用。本试验中苜蓿植株叶片中可溶性蛋白和可溶性糖含量,既有显著高于CK的,也有显著低于CK的,其原因可能是:对于含量升高的苜蓿品种,可能是诱变处理造成苜蓿植株一定程度上的损伤,但其损伤仍在可调节范围内,对于含量降低的苜蓿品种,可能是诱变处理对细胞产生了毒害作用,造成苜蓿体内可溶性蛋白和可溶性糖的部分降解,导致含量降低,形成不可修复的损伤。在正常生长条件下,植物细胞内游离脯氨酸含量一般较低,而在受到外界环境条件逆境胁迫时,为了能够维持细胞正常代谢和生理活动,游离脯氨酸含量会大量积累,以抵御逆境的影响,为此,植物通过提高体细胞内游离脯氨酸含量来防御逆境胁迫[17]。本实验中,高剂量的60Co-γ处理下,供试的各苜蓿品种的脯胺酸含量均高于对照处理,说明苜蓿在遭受60Co-γ诱变辐射时,可以通过提高其体内游离脯氨酸的积累,增强抵御逆境的能力;其他几种诱变处理下,游离脯氨酸含量增减不一,说明诱变对苜蓿游离脯氨酸的影响因处理剂量和品种不同而不同。
4 结论
本研究采用3种诱变处理对4个苜蓿品种进行了诱变,通过分析当代苜蓿诱变植株生理指标可知,3种抗氧化酶活性增强,不同诱变处理对3种抗氧化酶活性的影响程度为POD提高最明显,其次是CAT和SOD。丙二醛浓度受诱变处理影响不显著,总体来说,可溶性糖含量、可溶性蛋白含量和游离脯氨酸含量在各诱变处理下均有不同程度增加,但对各指标含量影响因诱变处理剂量和苜蓿品种不同而不同。综合分析酶活性及各渗透调节物质含量,可知150 Gy60Co-γ、90 min紫外线和0.4%EMS处理对苜蓿生理活性具有明显提高作用。

