血压变异性与急性后循环梗死患者预后的相关性
刘重次 蒋波
中南大学湘雅二医院神经内科,湖南长沙 410000
根据供血动脉不同,急性脑梗死可分为前循环梗死、后循环梗死两种类型,其中,急性后循环梗死约占急性脑梗死的20%,但患者病情更重,残疾率及死亡率均更高,其原因与呼吸、心血管中枢均位于后循环有关[1]。既往研究显示,急性脑梗死早期常伴随着血压升高及血压大幅波动,同时,中枢交感神经和迷走神经张力平衡紊乱也可造成血压变异性上升,而血压变异性上升已被证实可增加重要靶器官损害及心血管事件风险[2-3]。因此,了解血压变异性与急性后循环梗死患者预后的相关性,有望为临床预后评估工作提供新的思路。本研究对160例患者开展了前瞻性对照分析,现将研究方法与结果予以总结。
1 资料与方法
1.1 一般资料
研究时间2015年8月至2017年10月,患者影像学检查提示大脑后动脉、椎动脉或基底动脉供血区梗死[4-5]。排除发病至入院时间超过24 h者,发病前改良Rakin评分(mRS)>2分者,合并蛛网膜下腔出血、脑出血、短暂性脑缺血发作者,以及合并急性前循环梗死者。160例患者中,男111例,女49例,年龄45~83岁,平均(61.39±12.55)岁,并发症:高血压102例,糖尿病57例,房颤9例。本研究符合医学伦理学要求,患者家属自愿参与研究并已签署相关协议。
1.2 监测方法
患者均于入院后接受动态血压监测,使用TM-2430无创便携动态血压监测仪(日本A&D公司),将袖带固定于左上臂,6:00~22:00每15 min自动测量并记录1次血压,22:00~次日6:00每30 min自动测量并记录1次血压,有效测定值>80%判定为结果有效[6]。记录动态血压指标,包括24 h平均收缩压(SBP)、24 h平均舒张压(DBP)、日间收缩压(dSBP)、日间舒张压(dDBP)、夜间收缩压(nSBP)及夜间舒张压(nDBP)。计算机自动计算血压变异性,包括24 h收缩压变异(SSD)、24 h舒张压变异(DSD)、日间收缩压变异(dSSD)、日间舒张压变异(dDSD)、夜间收缩压变异(nSSD)及夜间舒张压变异(nDSD)。
1.3 分析方法
所有患者后续康复训练指导由我院完成,研究终点为发病后3个月,使用mRS评分评价其预后质量[7],0分:无症状;1分:尽管有症状但无明显残疾,可进行所有日常工作和生活活动;2分:轻微残疾,无法进行所有病前能从事的活动,但生活可自理;3分:中度残疾:活动需他人帮助,但步行不受限;4分:中度严重残疾,步行需他人帮助,生活无法自理;5分:严重残疾,卧床不起,失禁,需持续照料;6分:死亡。将mRS评分0~2分者纳入预后良好组,将mRS评分3~6分者纳入预后不良组。比较两组患者入院时动态血压、血压变异性差异,并运用受试者工作特征曲线(ROC),分析血压变异性预测患者预后不良的临床价值。
1.4 统计学方法
对本临床研究的所有数据采用SPSS 22.0进行分析,动态血压、血压变异性指标以()表示,并采用t检验,绘制ROC并计算曲线下面积(AUC)以分析血压变异性与急性后循环梗死患者预后的预测效能,以P<0.05为差异有统计学意义。
2 结果
1例患者失访,159例患者获有效随访,发病后3个月,共有57例患者mRS评分>2分,其余102例患者预后良好。预后良好组与预后不良组各项动态血压指标比较,差异无统计学意义(P>0.05)。预后良好组24 h SSD、24 h DSD及nSSD低于预后不良组,差异有统计学意义(P<0.05)。见表1。
表1 预后良好组与预后不良组血压指标比较()
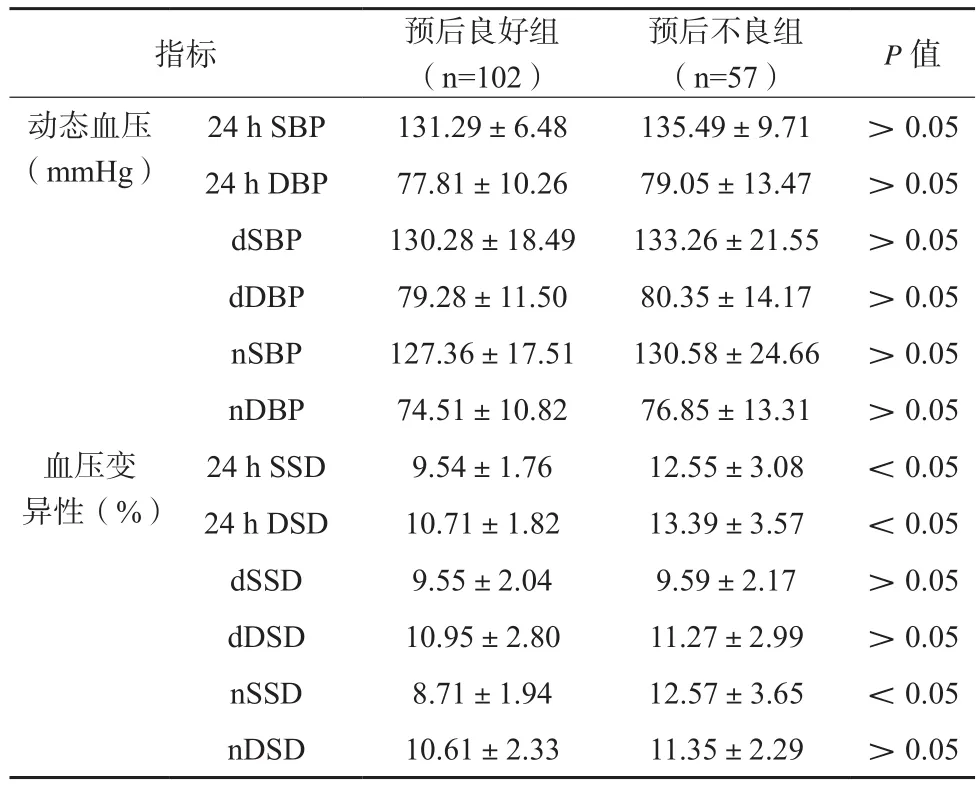
表1 预后良好组与预后不良组血压指标比较()
指标 预后良好组(n=102)预后不良组(n=57) P值动态血压(mmHg)24 h SSD 9.54±1.76 12.55±3.08 <0.05 24 h DSD 10.71±1.82 13.39±3.57 <0.05 dSSD 9.55±2.04 9.59±2.17 >0.05 dDSD 10.95±2.80 11.27±2.99 >0.05 nSSD 8.71±1.94 12.57±3.65 <0.05 nDSD 10.61±2.33 11.35±2.29 >0.05 24 h SBP 131.29±6.48 135.49±9.71 >0.05 24 h DBP 77.81±10.26 79.05±13.47 >0.05 dSBP 130.28±18.49 133.26±21.55 >0.05 dDBP 79.28±11.50 80.35±14.17 >0.05 nSBP 127.36±17.51 130.58±24.66 >0.05 nDBP 74.51±10.82 76.85±13.31 >0.05血压变异性(%)
ROC曲线见图1,以24 h SSD≥9.96%为截断值,其预测急性后循环梗死患者预后不良的AUC为0.796;以nSSD≥10.03%为截断值,其预测患者预后不良的AUC为0.713;以24 h DSD≥11.08%为截断值,其预测患者预后不良的AUC为0.655。24 h SSD、24 h DSD及nSSD均可为急性后循环梗死患者预后不良的预测提供参考(P< 0.05)。

图1 24 h SSD、24 h DSD、nSSD评估急性后循环梗死患者预后的ROC曲线
3 讨论
脑梗死的高发病率、高致残率、高病死率,给社会和患者家庭带来了沉重的负担。近年来,越来越多的研究表明,高血压是急性脑梗死的重大危险因素,即随着血压的升高,脑血管病发生风险显著上升[8]。除基础血压水平外,血压变异性对脑血管病变的影响也备受关注。研究显示,与急性前循环梗死患者比较,急性后循环梗死患者血压变异性更高,其原因考虑与血压波动对后循环即椎-基底动脉系统的影响较大有关[9]。此外,后循环系统的交感神经纤维分布较少,对血压波动尤其是血压急剧上升的损害更为敏感,也是导致急性后循环梗死患者血压变异性升高的重要原因之一[10-11]。因此,血压变异性升高不仅是急性后循环梗死的独立危险因素,也可能对患者预后产生一定影响。
此次研究分析结果不同预后患者动态血压水平未见明显差异,但预后不良者24 h SSD、24 h DSD及nSSD明显高于预后良好的患者,其机制可能包括:1)人类自主神经有着明显的昼夜节律,且自主神经功能的昼夜变化特征与血压昼夜变化节律具有一致性,日间交感神经兴奋、夜间交感神经兴奋性下降并伴副交感神经兴奋性增强,是引起血压昼夜变化的重要机制[12]。正常状态下,人群血压变异性呈杓状,即凌晨3~5时为一天内血压最低值,而后持续上升,并在清晨6~10时达到血压晨峰,16~20时可再次达到峰值[13-14]。在本次研究中,预后不良患者更高的24 h SSD、24 h DSD及nSSD意味着其血压节律呈现非杓形甚至反杓形变化,说明交感神经兴奋性异常,这一病理生理变化可造成脑血管自动调节能力下降、脑血流持续性不足,进而使得缺血区脑组织灌注几乎全部依赖于全身动脉血压,此时血液轻微波动性变化均可造成脑水肿和出血风险上升,且血压下降时脑组织缺血缺氧随即加重[15]。2)缓冲血压的神经如颈动脉窦,主动脉体减压神经、交感神经和迷走神经均终止于延髓网状结构的迷走神经背核,血压变异性的上升往往意味着延髓病变,此时血压自主调节能力不足,易出现各类不良事件[16-17]。此外,血压变异性上升可激活肾素-血管紧张素-醛固酮系统(RAAS),造成血液循环内血管紧张素Ⅱ和醛固酮升高,被认为是导致心室重构发生发展的主要原因[18],而心室重构所致冠状动脉灌注不足可在造成心功能受损的前提下影响脑血管功能,并诱发靶器官损害,因此,血压变异性上升对心脑血管系统均可造成不良影响,进而影响患者预后质量。
总之,血压变异性与急性后循环梗死患者预后密切相关,24 h SSD、24 h DSD及nSSD的上升意味着患者预后不良,根据患者血压变异性特点评估其病情特点并探索调控血压变异性的治疗手段,有望为急性后循环梗死的临床诊疗提供更为全面的指导。

