气相色谱-质谱法无基质效应测定冷冻韭菜中的腐霉利
许文娟,刘永强,丁葵英,郭礼强,张轩恺
(1.潍坊出入境检验检疫局,山东潍坊261041;2.潍坊第一中学,山东潍坊261041)
腐霉利又名速克灵、速克利、杀霉利、二甲菌核利等,是一种广谱内吸性杀菌剂,常用于韭菜等蔬菜中灰霉病的防治[1-2]。中国规定韭菜中腐霉利的最大残留限量为0.2 mg/kg[3],欧盟为0.01 mg/kg[4],建立一种高效准确的韭菜中腐霉利残留量的检测方法十分必要。
韭菜是一种复杂基质,其中的蒜氨酸水解会产生一系列含有不同取代基的硫化物[5],对检测结果会产生较强干扰,在农残检测中属于分析难度较大的基质。对于新鲜韭菜,常采用微波消解先消除巯基的干扰,但冷冻韭菜无法进行微波消解分散巯基,检测难度更大。
已报道的韭菜中腐霉利的检测方法主要有气相色谱法、气相色谱-质谱法、液相色谱法和光谱法[6-15]。气相色谱-质谱法是腐霉利检测的常用方法,但经常存在明显的基质增强效应,使检测结果偏高。为消除基质效应,使定量结果准确,必须配制基质匹配校准曲线进行校正[10,16]。最常用的检测标准GB23200.8-2016《食品安全国家标准水果和蔬菜中500种农药及相关化学品残留量的测定气相色谱-质谱法》,亦采用基质标准曲线内标定量[17]。
本文以乙酸乙酯为主要试剂,对冷冻韭菜进行提取和净化处理,气相色谱-质谱测定腐霉利残留量。在优化的气相色谱-质谱条件下,克服冷冻韭菜复杂基质对腐霉利检测的强基质效应,使用溶剂标准曲线即可准确完成定量,方法的准确度、精密度和灵敏度均满足相关要求。与国家标准及传统的QuEChERS方法相比,本方法操作更简单、安全,灵敏度高、成本低。料离心管中,加入乙酸乙酯40 mL,无水硫酸钠10.0 g,均质2 min后,以5 000 r/min高速离心8 min,上清液倒入装有无水硫酸钠的玻璃漏斗中,接入尖底旋转蒸发瓶中,旋蒸浓缩至近干。
净化:称取5 g硅胶,正己烷湿法装到层析柱中,上加5 g无水硫酸钠。用2 mL乙酸乙酯溶解旋蒸瓶中蒸至近干的样品,转移至硅胶柱中,以25 mL乙酸乙酯分2次冲洗旋蒸瓶,转移至硅胶柱中,滴至近干时再加25 mL乙酸乙酯洗脱。收集所有洗脱液于250 mL梨形瓶中,旋转蒸发至近干,用乙酸乙酯定容至1 mL,过滤膜后上机检测。
1.2.3 气相色谱-质谱条件
色谱柱:DB-5MS(30 m×0.25 mm×0.1 μm);电子轰击离子源(EI);升温程序:初始 80℃,保持 1 min,以20℃/min的速率升至180℃保持3.0 min,再以20℃/min升至230℃保持4.0 min,以35℃/min升到280℃,保持2 min。进样口温度:280℃;GC-MS接口温度280℃;离子源温度230℃。载气:He,纯度≥99.999%,流速:1 mL/min。进样量1 μL,不分流进样。选择离子监测(SIM)模式,定性离子 67、96、124,定量离子 283。
1 试验部分
1.1 材料与仪器
1.1.1 原料
韭菜:市售。
1.1.2 仪器
Agilent 7890A-5975C气质联用仪:美国安捷伦公司;GM 200碾磨仪:德国RETSCH公司;IKA-T25高速分散均质器、MS3 basic涡流混匀器:德国IKA公司;PB403-S电子天平:瑞士Mettler公司;Eppendof 5810R离心机:德国Eppendof公司;LABOROTA 4000旋转蒸发仪:德国Heidolph公司。
1.1.3 试剂
乙酸乙酯、丙酮、乙腈、正己烷(均为色谱纯)、硅胶(用前130℃烘烤10 h活化):德国Merk;无水硫酸钠(分析纯,用前在500℃马弗炉内烘5 h):天津光复科技公司;腐霉利(procymidone,CAS#32809-16-8)固体标准物质:美国Sigma公司,纯度≥99%。
1.2 方法
1.2.1 标准溶液的配制
称取10 mg(精确至0.1 mg)腐霉利标准品,分别置于100 mL的棕色容量瓶中,用丙酮溶解,准确定容至100 mL,得100 μg/mL标准储备液。用乙酸乙酯将腐霉利标准储备液稀释成不同浓度的标准工作液。
1.2.2 步骤
提取:准确称取10.00 g韭菜样品,置于100 mL塑
2 结果与分析
2.1 提取试剂的选择
考察常用提取试剂乙酸乙酯、乙腈、正己烷、丙酮对冷冻韭菜中腐霉利的提取效率。以腐霉利阳性冷冻韭菜样品为测试对象,采用国标方法GB 23200.8-2016测定其腐霉利残留量,以平行测定3次的平均值为该阳性样品的腐霉利含量(C0)。分别用乙酸乙酯、乙腈、正己烷为提取溶剂,采用本文的前处理方法进行提取,经铺有滤纸和无水硫酸钠的漏斗过滤除水,收集滤液旋蒸至近干,不经硅胶柱净化,直接以提取试剂定容后上机检测,计算样品中腐霉利含量(C)。二者比值为不同溶剂的提取效率,即C/C0×100%,其中提取效率的计算过程采用了回收率校正,结果见图1。

图1 不同提取试剂对冷冻韭菜中腐霉利的回收率和提取效率Fig.1 Recoveries and extraction efficiency of different reagents for procymidone in frozen leek
由图1可见,乙腈做提取试剂时,提取效率最高(97.3%),但回收率为140.4%,超出合理范围(80%~120%),说明乙腈提取出的冷冻韭菜中的干扰化合物具有较明显的基质增强效应。提取效率仅次于乙腈的是乙酸乙酯,且回收率也满足试验要求(95.3%)。丙酮做提取试剂时,情况和乙腈类似,提取效率高于80%,但也表现出了较强的基质增强效应,使回收率明显高出合理范围。以正己烷做提取试剂时,提取效率和回收率均在合理范围内,但均低于乙酸乙酯。
2.2 洗脱试剂的选择
通过2.1不同试剂的提取效率对比试验,综合考虑溶剂性质及基质效应情况,确定采用毒性更小、效率高的乙酸乙酯为冷冻韭菜中腐霉利的提取试剂。为使整个试验过程溶剂使用简单化,净化时直接尝试乙酸乙酯洗脱,以阴性样品添加回收试验的回收率及基质效应情况考察洗脱能力。结果表明,采用乙酸乙酯提取,硅胶柱净化,乙酸乙酯洗脱的前处理方法,添加浓度为0.02 mg/kg~2.0 mg/kg时冷冻韭菜中腐霉利的回收率为94.7%~98.3%,基质效应为0.95~1.02,回收率高,基质效应不明显,可很好的满足试验要求。
因此最终确定的前处理溶剂组合为,乙酸乙酯提取,乙酸乙酯洗脱,溶剂单一、毒性小,操作简单。
2.3 方法的线性、检出限、定量限、回收率及精密度
对质量浓度为 0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7 μg/mL的腐霉利标准溶液按1.2.3的条件进行气相色谱-质谱分析,由仪器软件以峰面积(y)对质量浓度(x,μg/mL)做回归曲线,得到线性方程y=36 637x+4.719 1,线性相关系数R2为0.999 9,结果见图2。

图2 腐霉利标准溶液的线性曲线Fig.2 Standard curve of procymidone
以添加样品信噪比(S/N)≥3时的空白样品中添加浓度确定方法的检出限(limit of detection,LOD)为0.002 mg/kg;以S/N≥10确定方法的定量限(limit of quantitation,LOQ)为0.006 mg/kg。检出限和定量限均满足国内外对腐霉利的残留限量法规要求。
在空白冷冻韭菜样品中添加不同浓度的腐霉利标准物质进行回收率试验,添加水平为0.006、0.01、0.2 mg/kg,每个水平做6次平行,计算平均回收率和相对标准偏差(relative standard deviation,RSD),结果见表1。

表1 冷冻韭菜中腐霉利的加标回收率及相对标准偏差(n=6)Table 1 Recoveries(Rec)and relative standard deviations(RSDs)for procymidone in frozen leek %
2.4 与传统方法比较
将试验建立的方法与腐霉利检测国标方法GB 23200.8-2016及常用的QuEChERS方法[18-21]进行比较,比较内容及结果见表2。

表2 本方法与传统方法的对比Table 2 Comparisons of this study with common methods
其中,QuEChERS方法的核心步骤为,0.1%醋酸-乙腈提取,C18、PSA净化(美国分析化学家协会方法)。
基质效应计算方法:测定腐霉利农药在纯溶剂中的平均响应值(A,n=3)、通过前处理获得的同浓度冷冻韭菜基质匹配标准溶液的平均响应值(B,n=3),二者比值定义为基质效应因子(ME),即ME=B/A。ME=(1.0±0.1)时可忽略基质效应影响[22-26]。
可见,跟常用的国家标准及QuEChERS方法相比,本文建立的冷冻韭菜中腐霉利残留量的测定方法,仅使用乙酸乙酯一种试剂,所用溶剂种类单一、毒性低。而最常用的国标方法GB 23200.8-2016,采用乙腈、甲苯、正己烷3种试剂,且乙腈和甲苯对人体危害较大。QuEChERS方法一般使用乙腈为提取试剂,其毒性也明显高于乙酸乙酯。从方法的定量限比较,本文建立的方法,对韭菜中腐霉利的定量限为0.006 mg/kg,采用GB 23200.8-2016及QuEChERS方法检测时,定量限分别为0.012 6 mg/kg和0.01 mg/kg,均高于本文方法定量限。除溶剂安全、方法灵敏度高外,本方法最优异的特点是可以忽略的基质效应。从该表看出,采用不同的方法对韭菜中的添加同浓度的腐霉利进行GC-MS检测,采用GB 23200.8-2016及QuEChERS方法时,都有明显的基质增强效应,基质效应因子分别为1.42和1.58,定量时需用基质匹配标准曲线进行校正,否则检测结果偏高。而用本方法检测时,基质效应因子为0.95,接近理想情况(ME=1),可忽略基质效应对检测结果的影响,定量时直接采用溶剂标准曲线即可准确完成。
2.5 实际样品检测
从当地超市、菜市场购入韭菜样品10份,冷冻后制成冷冻韭菜样品,采用本文建立的方法,检测其中的腐霉利残留量。本文试验条件下,腐霉利标准物质(0.7 μg/mL)、冷冻韭菜阳性样品(2.57 mg/kg)在气相色谱/质谱中的选择离子监测(selective ion monitoring,SIM)色谱图及提取离子色谱图见图3和图4。

图3 腐霉利标准物质的SIM色谱图和提取离子色谱图Fig.3 Selected ion monitoring chromatogram and extraction ion chromatogram of procymidone
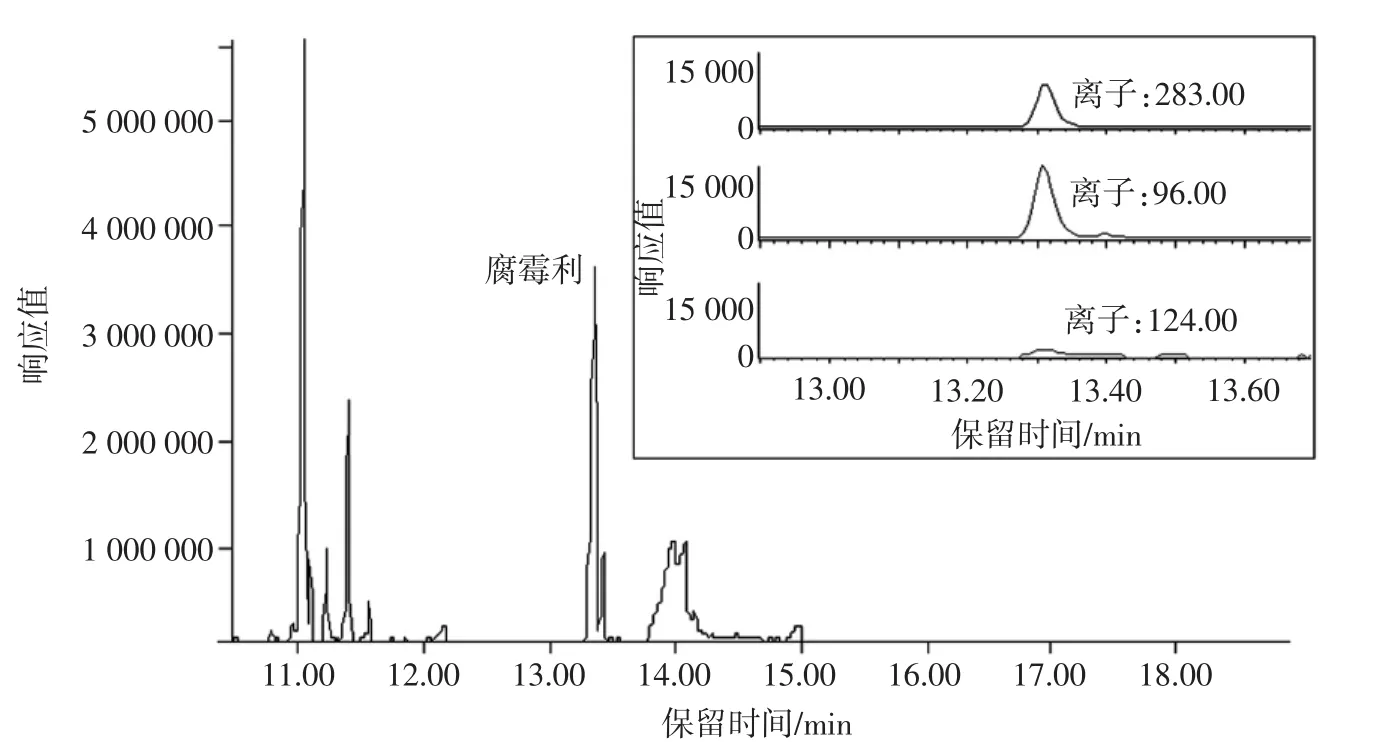
图4 冷冻韭菜阳性样品的SIM色谱图和提取离子色谱图Fig.4 Selected ion monitoring chromatogram and extraction ion chromatogram of positive frozen leek samples

表3 实际样品检测结果Table 3 Detection results of practical samples

续表3 实际样品检测结果Continue table 3 Detection results of practical samples
经检测,随机购买的10种韭菜样品,有7种未检测出腐霉利残留,3种检测出腐霉利残留,但仅有一种超过国家限量要求(<0.2 mg/kg)。将所有样品送到某检测公司实验室进行比对检测,相关检测结果见表3。
可见,经实验室间比对,无假阴性、假阳性结果,阳性样品的定量结果偏差很小,本文建立的冷冻韭菜中腐霉利的检测方法定性可靠、定量准确,可用于实际检测。
3 结论
气相色谱-质谱法是腐霉利检测的主流方法,但常存在基质效应,需要配制基质匹配标准曲线定量。冷冻韭菜在前处理之前无法通过微波消解去除巯基干扰,使最终提取液在仪器上的基质干扰及基质效应更强。本文建立的以乙酸乙酯为主要试剂的冷冻韭菜中腐霉利的前处理方法,摒弃常用的乙腈、甲苯等高毒试剂,且最终提取液在GC/MS分析时无基质效应,可直接配制溶剂标准曲线进行定量,平均回收率为95.4%~98.5%,相对标准偏差为1.22%~3.08%,检出限为0.002 mg/kg,定量限为0.006 mg/kg,优于常用的国标和QuEChERS方法,可满足不同国家的残留限量要求。