桂花提取物对雄性果蝇抗氧化及抗衰老作用的研究
刘冀婕,黄玲艳,曾照准,孙霁寒,王虹懿,彭景
(扬州大学食品科学与工程学院,江苏扬州225127)
桂花(Osmanthus fragrans Lour.)又名木樨、金栗、九里香,为木犀科属植物,是我国十大传统花卉之一。桂花不仅是著名的观赏及芳香植物,也是重要是食用及药用植物。目前关于桂花的研究多集中于芳香物质、提取工艺以及体外抗氧化活性。已有研究发现[1],桂花中蕴藏着丰富的蛋白质、氨基酸、维生素和黄酮类化合物。杨秀莲等研究证实不同品种桂花间的营养成分差别很大[2],国内外均有研究报道桂花的各种化合物的提取工艺以及抗氧化活性,主要集中在黄酮类、多酚和多糖[3-5],现已普遍认为桂花具有降血糖、清除自由基、抗氧化、抗炎等作用。由此可推断桂花可能有延长寿命、抗衰老的作用。
衰老是人类生活的一个自然生理过程,受复杂的调节系统控制,其特点是细胞和组织功能逐渐衰退。关于衰老的机理,以Harman[6]提出的自由基学说最具有代表性。机体会通过酶系统与非酶系统产生氧自由基,氧自由基通过多不饱和脂肪酸的过氧化引起细胞损伤,产生大量代谢产物丙二醛(malondialdehyde,MDA),可引起细胞代谢及功能障碍,加速机体衰老。但机体存在直接清除自由基,抑制自由基的生成或是激活机体抗氧化体系的自由基清除剂,包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(catalase,CAT)等酶类清除剂。
果蝇生命周期短,成本低,且具有与人类十分相似的衰老基因[7],因此常被作为研究延缓衰老和抗氧化的生物模型。本文以雄性Oregon K野生型红眼黑腹果蝇为生物模型,研究桂花提取物的抗氧化作用及其对果蝇寿命的影响,为进一步开发利用桂花提供科学依据。
1 材料与方法
1.1 实验动物、材料与试剂、设备
1.1.1 实验动物
Oregon K野生型红眼黑腹果蝇:温州大学生命与环境科学学院提供。
1.1.2 实验材料
桂花提取物:参照李姝[8]的方法,略有改动,金桂花采摘阴干后置于烘干箱中,50℃烘干,粉碎,过40目筛。取金桂花粉末200 g,按料液比1∶8(g/mL)加入80%乙醇,浸泡14 h后在50℃水浴条件下回流浸提3 h,滤渣重复提取3次,合并萃取液,萃取液用旋转蒸发仪40℃,-0.1 MPa减压浓缩,0.22 μm过滤器过滤除菌,得浸膏即桂花醇提物,桂花醇提物的成分主要为多酚类化合物、黄酮和多糖。补充无水乙醇使桂花醇提物总质量为100 g,则该1 g桂花提取物相当于2 g金桂花的有效成分,4℃冰箱保存备用。
1.1.3 实验试剂
无水乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS):上海苏懿化学试剂有限公司;乙醚:上海苏懿化学试剂有限公司;葡萄糖:天津致远化学试剂有限公司;对羟基苯甲酸乙酯、琼脂粉:国药集团化学试剂有限公司;玉米粉:市售;酵母粉:安琪酵母股份有限公司;总蛋白(total protein,TP)试剂盒、过氧化氢酶试剂盒、丙二醛试剂盒、超氧化物歧化酶试剂盒:南京建成生物工程有限公司。
1.1.4 仪器设备
BS22九阳料理机:九阳股份有限公司;BS224S电子天平:赛多利斯科学仪器有限公司;DZF-6020型真空干燥箱:上海博迅实业有限公司;DK-S28电热恒温水浴锅:上海精宏实验设备有限公司;VPH11-5T超纯水仪:四川优普超纯科技有限公司;SHB-Ⅲ型循环水真空泵、RE-52B旋转蒸发仪:上海亚荣生化仪器厂;HSX-250B恒温恒湿培养箱:上海福玛实验设备有限公司;SX-500快速自动高压灭菌器:上海珂淮仪器有限公司;Allegra X-22R台式冷冻离心机:美国Benckman Coulter公司;Vortex-Genie2旋涡混匀器:美国Scientific Industries公司;Spectrumlab755s可见分光光度计:上海棱光技术有限公司。
1.2 方法
1.2.1 培养基配制
基础培养基:参照王彦平等[9]的配方,蒸馏水750 mL、酵母 10 g、葡萄糖 72 g、玉米粉 72 g、琼脂 6 g、75%乙醇水溶液40 mL(含1%对羟基苯甲酸乙酯);分别用蒸馏水溶解玉米粉、葡萄糖、琼脂粉、酵母粉,葡萄糖和琼脂粉溶解后加热至沸腾,加入已溶的玉米糊和乙醇水溶液,不断搅拌至黏稠,沸腾后暂停加热,加入溶解的酵母粉,揽拌均匀,冷却前用注射器将其分装到培养管,每管大约2 mL。
试验培养基:在基础培养基中,添加2.5、5、10、15 mg/mL桂花提取物,配制成不同浓度的试验培养基。
1.2.2 果蝇的生存实验
收集2 d龄雄性果蝇成虫1 000只,随机分为对照组、桂花提取物剂量组(2.5、5、10、15 mg/mL)共 5组,每组5管,每管40只,置于恒温培养箱培养[温度(25±0.5)℃,湿度(60±5)%],每 4天更换一次培养基并记录果蝇的死亡数量至全部死亡。计算平均寿命、最高寿命[10]和延寿率[11],延寿率/%=(处理组平均寿命-对照组平均寿命)/对照组平均寿命×100,并绘制生存曲线。
1.2.3 桂花提取物对应激条件下果蝇寿命的影响
1.2.3.1 急性氧化损伤实验
果蝇分组与培养同生存实验。参考文献[9]的方法。养至第25天后,饥饿2 h,用CO2麻醉后导入无培养基的干净试管中,将沾有含30%H2O2的6%葡萄糖水溶液的滤纸条放入试管,每4小时记录果蝇死亡数目,直至全部死亡,并绘制生存曲线。
1.2.3.2 SDS急性损伤实验
果蝇分组与培养同生存实验。参考文献[12]。养至第25天后,饥饿2h,均给予6%葡萄糖溶液(含6mg/mL SDS),每4小时记录死亡数至全部死亡,绘制生存曲线。
1.2.3.3 果蝇的热应激损伤实验
果蝇分组与培养同生存实验。参考文献[13]。第25天龄时放入(35±1)℃培养箱,每4小时记录其死亡数至全部死亡,绘制生存曲线。
1.2.4 果蝇体内氧化指标的测定
收集2 000只2 d龄雄性果蝇成虫,随机分为对照组、桂花提取物剂量组(2.5、5、10、15 mg/mL)共 5 组,每组10管,每管40只,培养方法同生存实验。在第25天和第45天时,将果蝇饥饿处理2 h,每组用CO2麻醉5管,称重。按照果蝇体重1∶49(mg/mL)的比例加入生理盐水,冰浴匀浆,2 500 r/min,4℃离心15 min,吸取上清,取上清液按试剂盒说明测定果蝇体内血清总蛋白含量(mg/mL)、总超氧化物歧化酶、Cu,Zn-SOD活性(U/mL)、CAT活性(U/mL)和MDA含量(nmol/mL)。
1.3 数据分析
2 结果与分析
2.1 桂花提取物对果蝇寿命的影响
桂花提取物对果蝇寿命的影响见表1,果蝇生存曲线见图1。
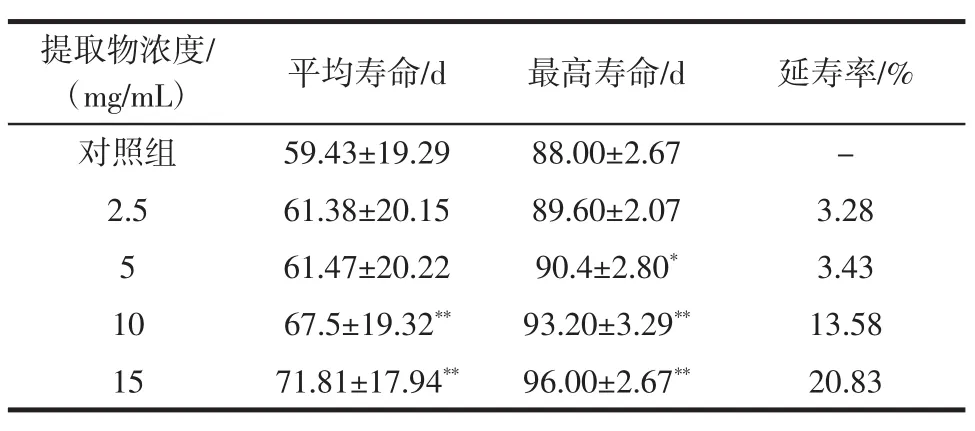
表1 桂花提取物对果蝇寿命的影响Table 1 Effect of Osmanthus extract on drosophila melanogaster lifespan

图1 果蝇生存曲线Fig.1 Drosophila melanogaster survival curve
由表1可知,与对照组相比,桂花提取物剂量组果蝇的平均寿命和最高寿命均有所增长,延寿率分别为3.28%、3.43%、13.58%、20.83%,其中 10、15 mg/mL剂量组平均寿命的差异极其显著(P<0.01),5 mg/mL剂量组最高寿命有显著差异(P<0.05),10、15 mg/mL剂量组最高寿命的差异极显著(P<0.01)。
由图1可看出,36天龄后,各组存活率明显下降,但各剂量组存活率均高于对照组。另外,与对照组相比,随着桂花提取物剂量的增加,果蝇生存曲线逐渐发生右移。
2.2 桂花提取物对果蝇体内TP含量的影响
桂花提取物对果蝇体内血清总蛋白含量的影响见表2。
由表2可知,空白对照组在45 d龄时的体内TP含量低于25 d龄的果蝇体内TP含量,而各剂量组果蝇体内TP含量均高于25 d龄的果蝇。在25 d龄时,与空白对照组相比,各剂量组雄性果蝇体内TP含量无显著差异(P>0.05);在45 d龄时,与空白对照组相比,剂量组均能提高果蝇体内TP含量,15 mg/mL剂量组能显著提高果蝇体内 TP 含量(P<0.05),但 2.5、5、10 mg/mL剂量组TP含量无显著差异(P>0.05)。
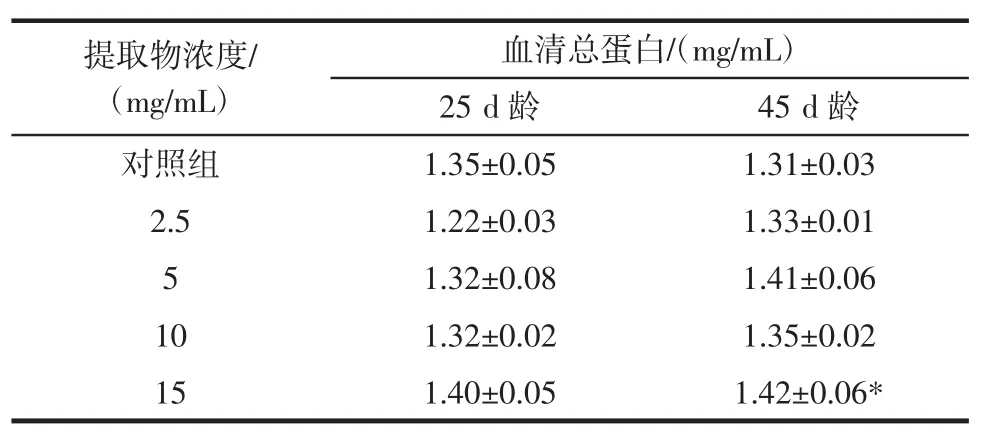
表2 桂花提取物对果蝇体内血清总蛋白含量的影响Table 2 Effect of Osmanthus extract on TP content in drosophila melanogaster
2.3 桂花提取物对果蝇SOD活性的影响
桂花提取物对果蝇超氧化物歧化酶活性的影响见表3。

表3 桂花提取物对果蝇超氧化物歧化酶活性的影响Table 3 Effect of Osmanthus extract on SOD activity in drosophila melanogaster
由表3可知,对照组和剂量组果蝇在45 d龄时体内T-SOD活性均比25 d龄时高。与对照组相比,25 d龄时,剂量组均能提高果蝇体内T-SOD活性,其中2.5 mg/mL剂量组果蝇体内T-SOD活性明显提高,差异显著(P<0.05),5、10、15 mg/mL 剂量组果蝇 T-SOD显著提高,差异极其显著(P<0.01)。45 d龄时,与对照组相比,各剂量组果蝇体内T-SOD活性均显著提高,差异极其显著(P<0.01)。
由表3可知,空白对照组和2.5 mg/mL剂量组果蝇体内的Cu,Zn-SOD活性在45 d龄时较25 d龄略有下降。5、10、15 mg/mL剂量组的果蝇在45 d龄的Cu,Zn-SOD活性较25 d龄均略有提高。与对照组相比,25 d龄时,剂量组均能提高果蝇体内T-SOD活性,其中5、10、15 mg/mL剂量组果蝇Cu,Zn-SOD显著提高,差异极其显著(P<0.01)。45 d龄时,与对照组相比,各剂量组果蝇体内Cu,Zn-SOD活性均有所提高,其中5、10、15 mg/mL 剂量组果蝇 Cu,Zn-SOD 显著提高,差异极其显著(P<0.01)。
2.4 桂花提取物对果蝇CAT活性的影响
桂花提取物对果蝇体内CAT活性的影响见表4。
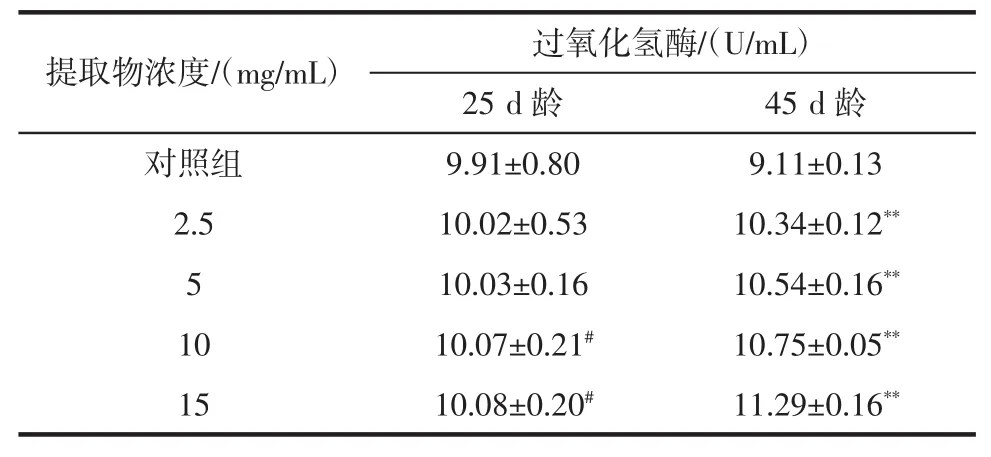
表4 桂花提取物对果蝇体内过氧化氢酶活性的影响Table 4 Effect of Osmanthus extract on CAT activity in drosophila melanogaster
由表4可知,空白对照组果蝇体内的CAT活性在45 d龄时较25 d龄略有下降,而各剂量组果蝇体内CAT活性在45d龄时较25d龄均有所提高。与对照组相比,在25 d龄时,2.5 mg/mL和5 mg/mL剂量组果蝇的CAT 活性略有提高,但差异不显著(P>0.05);10 mg/mL和15 mg/mL剂量组果蝇的CAT活性明显提高(P<0.05);在45 d龄时,与空白对照组相比,各剂量组果蝇的CAT活性极显著提高,差异极其显著(P<0.01)。
2.5 桂花提取物对果蝇MDA含量的影响
桂花提取物对果蝇体内MDA含量的影响见表5。
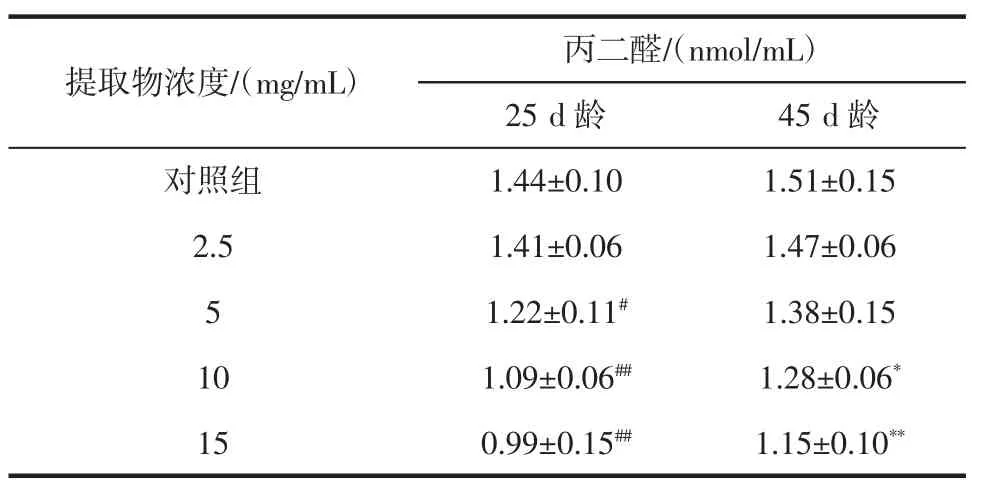
表5 桂花提取物对果蝇体内丙二醛含量的影响Table 5 Effect of Osmanthus extract on MDA content in drosophila melanogaster
由表5可知,空白对照组和各剂量组果蝇体内的MDA含量在45 d龄时较25 d龄均略有提高。其中,在25 d龄时,与空白对照组相比,2.5 mg/mL剂量组果蝇体内的MDA含量略有下降,但差异不显著(P>0.05);5 mg/mL剂量组果蝇体内的MDA含量明显下降,差异显著(P<0.05),10 mg/mL和15 mg/mL剂量组果蝇体内的MDA含量显著下降,差异极其显著(P<0.01);在45 d龄时,与空白对照组相比,2.5、5 mg/mL剂量组果蝇体内的MDA含量略有下降,但差异不显著(P>0.05),10 mg/mL剂量组果蝇体内的MDA含量明显下降,差异显著(P<0.05),15 mg/mL剂量组果蝇体内的MDA含量显著下降,差异极其显著(P<0.01)。
2.6 桂花提取物对急性氧化损伤果蝇寿命的影响
桂花提取物对急性氧化损伤果蝇寿命的影响见表6。
由表6可知,与对照组相比,各剂量组均能延长急性氧化损伤果蝇的平均寿命和最高寿命。其中,除2.5 mg/mL剂量组外,各剂量组均极其显著提高了平均寿命(P<0.01)。5 mg/mL剂量组明显提高了最高寿命(P<0.05),其余剂量组极其显著(P<0.01)。
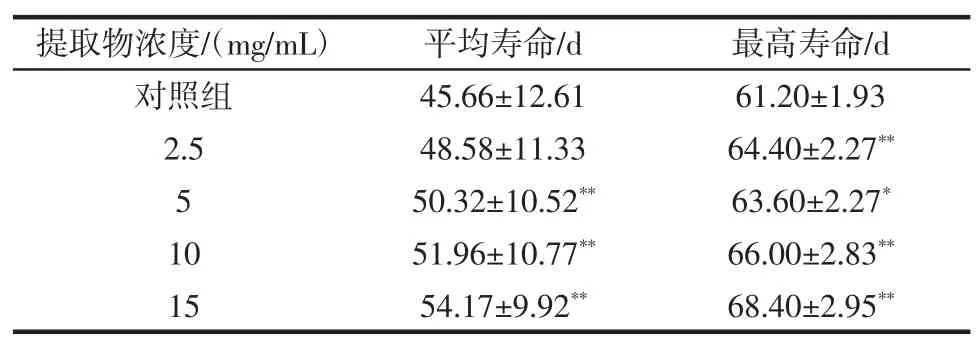
表6 桂花提取物对急性氧化损伤果蝇寿命的影响Table 6 Effect of Osmanthus extract on lifespan of derophila melanogaster in·OH acute experiment
2.7 桂花提取物对SDS急性损伤果蝇寿命的影响
桂花提取物对SDS急性损伤果蝇寿命的影响见表7。

表7 桂花提取物对SDS急性损伤果蝇寿命的影响Table 7 Effect of Osmanthus extract on lifespan of derophila melanogaster in SDS acute experiment
由表7可知,与对照组相比,各剂量组均能延长SDS急性损伤果蝇的平均寿命,但除15 mg/mL剂量组能极显著提高果蝇平均寿命外(P<0.01),其余剂量组差异均不显著(P>0.05)。与对照组相比,各剂量组均能延长SDS急性损伤果蝇的最高寿命,其中10、15 mg/mL剂量组能极显著提高果蝇最高寿命(P<0.01),5 mg/mL 剂量组能明显提高(P<0.05),2.5 mg/mL差异不显著(P>0.05)。
2.8 桂花提取物对热应激损伤果蝇寿命的影响
桂花提取物对热应激损伤果蝇寿命的影响见表8。
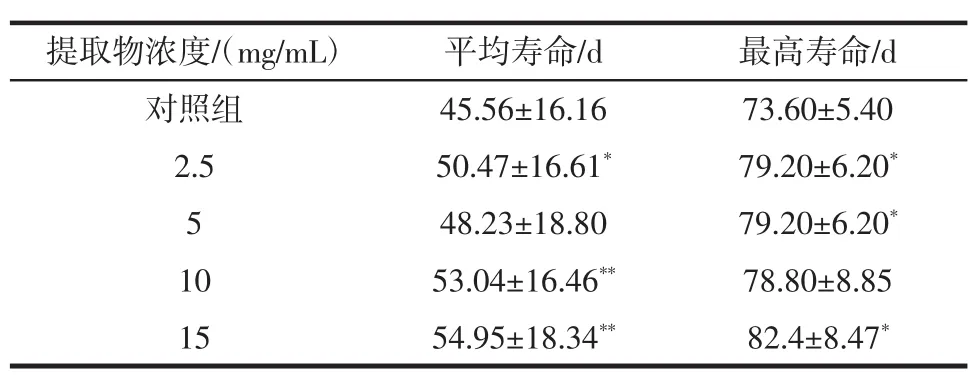
表8 桂花提取物对热应激损伤果蝇寿命的影响Table 8 Effect of Osmanthus extract on lifespan of derophila melanogaster in acute experiment of heat temperature
由表8可知,桂花提取物各剂量组均能延长热应激损伤果蝇的平均寿命和最高寿命。其中,与对照组相比,10、15 mg/mL剂量组极其显著地延长了平均寿命的(P<0.01),2.5 mg/mL剂量组延长了平均寿命,差异具有显著性(P<0.05),2.5、5 mg/mL 和 15 mg/mL 剂量组能显著延长最高寿命(P<0.05)。
3 结论与讨论
正常情况下,机体通过产生和清除自由基维持机体的正常生理功能,使生物体保持平衡。但是机体随着年龄的增长,新陈代谢异常,出现各种代谢综合征[14],使自由基大量产生,氧化和抗氧化平衡状态受到破坏,使机体处于氧化应激状态,机体防御体系的抗氧化能力的强弱与健康程度存在着密切联系,因此本研究不仅设计了寿命试验,同时测定了果蝇体内SOD、CAT的活性以及MDA的含量。
通过实验结果可以看出,桂花提取物不同剂量组均能不同程度延长果蝇的平均寿命和最高寿命,尤其是10、15 mg/mL剂量组效果最为显著(P<0.01)。桂花提取物10、15 mg/mL剂量组能显著增加25 d龄果蝇体内CAT活性(P<0.05),所有剂量组能极显著增加45 d 龄果蝇体内 CAT 活性(P<0.01),5、10、15 mg/mL剂量组能极显著增加25 d龄和45 d龄果蝇体内SOD活性(P<0.01),桂花提取物通过增加SOD、CAT活性从而提升果蝇自身的抗氧化能力。另外,由实验可知,10、15 mg/mL剂量组能极显著降低25 d龄果蝇体内MDA含量(P<0.01),15 mg/mL剂量组能极显著降低45 d龄果蝇体内MDA含量(P<0.01),说明桂花提取物能在不同程度上降低果蝇体内MDA的含量,具有抑制MDA对机体组织造成损伤的作用,可以减轻机体氧化应激的水平,延缓衰老。
除了新陈代谢异常外,机体在一些应激状态下也会导致自由基异常增多,从而加速机体的衰老与死亡。本研究设计了急性氧化损伤模型、SDS损伤模型、热应激损伤模型3个应激损伤模型,实验结果表明桂花提取物也能延缓应激状态下果蝇的寿命,而10、15 mg/mL剂量组与对照组的差异极为显著(P<0.01)。
中医理论中提倡“药食同源”,使功效与安全性兼得,是开发抗衰老保健食品的良好来源[15]。本研究结果表明桂花具有极显著的抗氧化、延缓衰老的作用,是继人参、枸杞等目前研究较多的可食性中药后又一可开发的抗衰老产品。为之后研究桂花对免疫功能的影响,明确其抗衰老活性机制,进一步开发利用桂花提供参考。

