白细胞介素17、33及1-磷酸鞘氨醇在支气管哮喘患者血清中的表达及临床意义研究
陈礼龙 吴 琼
支气管哮喘是由嗜酸性粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、气道上皮细胞等细胞和细胞组分参与的气道慢性炎症性疾病,其临床特征是广泛而多变的可逆性气流受限,导致反复发作的喘息、气促、胸闷和(或)咳嗽[1-2]。支气管哮喘的发病机制比较复杂,近年来研究显示细胞因子在支气管哮喘的发病过程中起着重要的作用[3-4]。有研究显示,白细胞介素17(interleukin-17, IL-17)在Th2细胞介导的支气管哮喘中发挥重要作用[5]。白细胞介素33(interleukin-33,IL-33)也是一种Th2细胞诱导因子,在哮喘的发病过程中扮演着重要的角色[6]。有研究者发现1-磷酸鞘氨醇(sphingosine 1-phosphate, S1P)在致敏的哮喘患者中异常升高,而缓解后又降至正常水平[7]。本研究的主要目的是探讨血清中IL-17、IL-33以及S1P在支气管哮喘患者血清中的表达情况并分析其临床意义,具体研究报告如下。
资料与方法
1. 一般资料 选择2014年5月至2016年8月期间,我院门诊收治的82例支气管哮喘患者作为研究对象,支气管哮喘的诊断标准参考《支气管哮喘防治指南(2016年版)》[8],根据喘息控制情况分为急性发作组(n=45)和临床缓解组(n=37),45例急性发作组患者中根据病情程度的不同,分为18例轻度哮喘、24例中度哮喘、3例重度哮喘;37例临床缓解组患中根据病情程度的不同分为12例间歇哮喘,15例轻度持续哮喘和10例重度持续哮喘。另外随机选择门诊健康的体检者35例作为对照组,急性发作期组、临床缓解组患者与对照组年龄、性别等基线资料之间,差异无统计学意义(P>0.05),急性发作期组与临床缓解组患者的哮喘家族史之间,差异也无统计学意义(P>0.05),具有可比性,见表1。支气管哮喘患者均进行胸X线片或者CT检查后确认没有自身免疫性疾病、肺间质性疾病、慢性阻塞性肺疾病以及肺炎等疾病,另外,排出系统炎症性疾病的感染者,且检测显示超敏C反应蛋白和降钙素原水平均比感染阳性阈值低。对照组受试者的排除标准:有吸烟史;有过敏性疾病史;患有自身免疫性疾病;肿瘤患者;有心血管疾病的患者;有肺部疾病如肺纤维化和支气管扩张等;身体其他部位患有炎症。本研究取得了我院医学伦理委员会的批准,所有受试者均签署了知情同意书。

表1 基线资料比较
2.方法 所有受试者均于清晨空腹时采集肘静脉血5 mL,室温放置20~30 min后2 500 r/min,离心30 min,收集血清于-80 ℃保存待检。IL-17、IL-33、S1P水平检测方法均为ELISA法,检测试剂盒购于MultiSciences公司(IL-17检测试剂盒目录号为70-EK1172,IL-33检测试剂盒的目录号为70-EK133-48),S1P检测试剂盒购于上海润裕生物科技有限公司,货号为01751。肺功能指标FEV1(%)、PEF(%)以及FEV1/FVC的检测采用德国耶格公司肺功能检测仪检测。所有检测操作均严格遵循仪器和试剂盒SOP进行。
3.统计学分析 分析采用SPSS20.0软件。计数资料以频数(率)表示,采用卡方检验;计量资料以均数±标准差表示,三组独立样本之间采用单因素方差分析,两两比较采用Dunnett法检验,不同参数之间的线性相关性采用Pearson相关分析。以P<0.05差异有统计学意义。
结 果
1.血清IL-17、IL-33以及S1P水平 急性发作期组、临床缓解组患者以及对照组之间的血清IL-17、IL-33以及S1P水平的差异均有统计学意义(F=67.880, 10.601, 734.453,P=0.000, 0.000, 0.000),两组间比较,急性发作期组患者的血清IL-33以及S1P水平均显著高于临床缓解组,差异均有统计学意义(t=8.915, 21.501;P=0.000, 0.000),两组患者的IL-17水平之间的差异没有统计学意义(t=0.813;P=0.419);急性发作期组患者的血清IL-17、IL-33以及S1P水平均显著高于对照组,差异均有统计学意义(t=11.031, 14.845, 37.540;P=0.000, 0.000, 0.000);临床缓解组患者的血清IL-17、IL-33以及S1P水平均显著高于对照组,差异均有统计学意义(t=11.306, 6.433, 16.257;P=0.000, 0.000, 0.000,表2)。

表2 血清IL-17、IL-33以及S1P水平比较
注:与临床缓解组比较,▲P<0.05;与对照组比较,△P<0.05
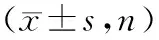
表3 肺功能指标比较
注:与临床缓解组比较,▲P<0.05;与对照组比较,△P<0.05
2.肺功能指标比较 急性发作期组、临床缓解组患者以及对照组之间的FEV1(%)、PEF(%)以及FEV1/FVC的差异均有统计学意义(F=93.410, 102.568, 101.771;P=0.000, 0.000, 0.000),两组间比较,急性发作期组患者的FEV1(%)、PEF(%)以及FEV1/FVC均显著低于临床缓解组,差异均有统计学意义(t=9.063, 9.199, 6.190;P=0.000, 0.000, 0.000);急性发作期组患者的FEV1(%)、PEF(%)以及FEV1/FVC均显著低于对照组,差异均有统计学意义(t=13.731, 14.637, 14.557;P=0.000, 0.000, 0.000);临床缓解组患者的FEV1(%)、PEF(%)以及FEV1/FVC均显著低于对照组,差异均有统计学意义(t=4.288, 4.485, 7.634;P=0.000, 0.000, 0.000,表3)。
3.血清IL-17、IL-33、S1P水平与肺功能指标的相关性 Pearson相关性分析显示,支气管哮喘患者血清IL-17水平与FEV1(%)、PEF(%)以及FEV1/FVC之间并无显著相关性(P>0.05),而IL-33水平与FEV1(%)、PEF(%)以及FEV1/FVC之间均呈负相关(r=-0.893, -0.842, -0.696;P<0.01),见图1A、1B、1C。S1P水平与FEV1(%)、PEF(%)以及FEV1/FVC之间均呈负相关(r=-0.656, -0.709, -0.775;P<0.01),见图1D、1E、1F。
讨 论
支气管哮喘是一种慢性炎症性呼吸系统疾病,目前对于支气管哮喘的发病机制并未完全研究清楚,大致可以归纳为以下几种情况:第一,遗传与环境因素,与先天遗传因素和后天环境因素有关[9-10]。第二,神经受体调节机制,随着神经肽参与神经源性炎症在哮喘发生过程中的作用被发现,神经受体调节也被认为是导致哮喘发生的机制之一[11]。第三,呼吸道感染,主要由于病毒感染后引起气道高反应性,刺激产生特异性的IgE,使气道嗜酸性粒细胞增多,参与哮喘的发生过程[12]。第四,免疫学机制,包括早期免疫细胞致敏,中期慢性炎症以及后期的起到重塑[13]。

图1 血清IL-33、S1P水平与肺功能指标的相关性 A:IL-33与FEV1的相关性;B:IL-33与PEF的相关性;C:IL- 33与FEV1/FVC的相关性;D:S1P与FEV1的相关性;E:S1P与PEF的相关性;F:S1P与FEV1/FVC的相关性
IL-17在T细胞介导的炎症反应中发挥重要作用,与此同时还能促进气道内炎症细胞的募集[14]。IL-17被活化后能够激活上皮细胞、巨噬细胞等释放GM-CSF和相关细胞因子,进一步促进气道炎症反应[15]。本研究结果显示,临床缓解组患者的血清IL-17、IL-33以及S1P水平均显著高于对照组,差异均有统计学意义(P<0.05),然而急性发作期组患者的血清IL-17水平与临床缓解组之间,差异无统计学意义(P>0.05)。杜端林等[16]研究显示,随着哮喘严重程度逐渐增加,血清IL-17水平逐渐增加(P<0.01),与本研究结果并不一致,分析原因可能由于临床样本数量比较少,尽管总体上随着哮喘严重程度逐渐增加的趋势存在,但是差异并不明显。IL-33是一种Th2型免疫反应的活化因子,通过促进Th2型细胞因子的是否参与哮喘的发生[16-17]。S1P是一种具有生物活性鞘脂类代谢物,不仅可以与G蛋白偶联受体结合发挥第一信使的作用,同时还能够参与细胞增殖、重塑和活化等生物效应[18]。本研究结果显示,随着支气管哮喘严重程度逐渐增加,血清IL-33以及S1P水平显著增加,急性发作期组患者的血清IL-33以及S1P水平均显著高于临床缓解组,差异均有统计学意义(P<0.05);临床缓解组患者的血清IL-17、IL-33以及S1P水平均显著高于对照组,差异均有统计学意义(P<0.05),与相关研究结果一致[19]。为了探讨血清中IL-17、IL-33、S1P水平与肺功能相关指标的相关性,本研究检测了FEV1、PEF以及FEV1/FVC等肺功能指标,初步研究显示,急性发作期组、临床缓解组患者以及对照组之间的FEV1、PEF以及FEV1/FVC的差异均有统计学意义(P<0.05),其趋势为随着支气管哮喘的严重程度增加,FEV1、PEF以及FEV1/FVC逐渐降低,急性发作期组患者的FEV1、PEF以及FEV1/FVC均显著低于临床缓解组,差异均有统计学意义(P<0.05);急性发作期组患者的FEV1、PEF以及FEV1/FVC均显著低于对照组,差异均有统计学意义(P<0.05),临床缓解组患者的FEV1、PEF以及FEV1/FVC均显著低于对照组,差异均有统计学意义(P<0.05)。另外,采用Spearman秩相关检验分析血清IL-17、IL-33以及S1P水平与FEV1、PEF以及FEV1/FVC相关性结果显示,支气管哮喘患者血清IL-17水平与FEV1、PEF以及FEV1/FVC之间并无显著相关性(P>0.05),而IL-33水平与FEV1、PEF以及FEV1/FVC之间均呈负相关(r=-0.893,-0.842,-0.696;P<0.01)。S1P水平与FEV1、PEF以及FEV1/FVC之间均呈负相关(r=-0.656, -0.709, -0.775;P<0.01),与相关研究结果一致[19-20]。由此可以证明,IL-33和S1P可以作为指标用于判定支气管哮喘严重程度。然而,有部分研究者发现,IL-17的表达水平也与哮喘的发作程度呈正相关[21],与本研究结果不符合。笔者分析一方面可能与样本数量较少有关,另一方面可能与所选临床样本的支气管哮喘患者自身身体状况有关,导致IL-17水平波动较大,对检测结果的真实性影响较大。
综上所述,本研究选择了IL-17、IL-33和S1P3个血清学指标作为检测对象,分析了这3个血清学指标在支气管哮喘患者中的表达和临床意义,从实验结果中可以看出,支气管患者血清IL-17、IL-33、S1P表达均升高,IL-33、S1P可以作为支气管哮喘患者气道炎症反应严重程度的指标之一应用于临床。
利益冲突声明:本研究没有利益冲突。

