传递函数分析动态脑血流自动调节:源于国际脑血流自动调节研究网络的白皮书
韩珂,王政严,纪乃方,胡汉华,,4
1 引言
1.1 脑血流自动调节
人脑的灌注由多系统控制,包括化学调控、自动调节(如针对压力变化的肌源性反应)、调控局部脑代谢的神经血管耦联以及可能还包括自主神经血管调控。脑血流自动调节(cerebral autoregulation,CA)是指血压(blood pressure,BP)变化时大脑维持足够脑灌注的内在能力。BP与脑血流(cerebral blood flow,CBF)之间的动态关系有高通滤波器的特点,推测是由于脑小动脉对压力变化的适应不够快,无法抵消灌注压的高频振荡(>0.20 Hz),结果这些高频振荡信号无阻碍地通过进入了脑血流的振荡。相反,脑小动脉可以抵消及衰减较低频率振荡(<0.20 Hz,但最有效的是<0.05 Hz)。由于大脑高度依赖持续的(含氧)血供,当CA功能障碍时,大脑对灌注不足及过度灌注更为敏感。已知有多种疾病损害CA,如糖尿病、痴呆、卒中、脑外伤以及蛛网膜下腔出血。另外,在严重的高血压、脑损伤或者正在进行外科手术的患者中,CA则在维持稳定的脑灌注中扮演了重要的角色。因此,评估和监测CA功能可为患者提供有用的临床信息,为降低二次脑损伤风险提供了一个更注重个体生理特性的治疗方案。
1.2 评估脑血流自动调节的方法
过去30多年,已经提出了许多评估CA功能的方法。传统的评估方法是诱发BP变化观察脑血管系统的变化。采用药物或者动作诱发如Valsalva、蹲下站起或者坐下站起、下肢袖带加压释放试验,均能诱发BP急剧变化。另一方法是短暂充血反应试验,即压颈动脉,颈动脉压迫释放瞬间测量CBF的增高。然而由于一些方法可致患者BP变化幅度相对大、需要患者配合以及一些诱发方法可致患者不适,故无法用于重病者、年老者或者重度认知障碍者。而且,上述检查方法可能影响其他生理系统(如,Valsalva动作可激活交感神经系统,视觉或者声音刺激可激活大脑皮层),或者其他的变量[如,蹲-站和(或)坐-站动作时体位变化对pCO2],使结果混杂。鉴于这些人为引起BP波动的方法存在局限性,一些研究团队改用自发BP波动替代诱发波动的方法研究CA。
根据静息时BP和CBF自发性波动,已研发出多种无创性CA分析方法,如相关系数分析(correlation coefficient analysis,Mx)、自动调节指数、传递函数分析(transfer function analysis,TFA)及应用Volterra核心的laguerre扩展或者主要动态模式的非线性分析、自回归以及多模式压力-血流分析。必须说明,上述方法测量CA的前提是简化CA,这些方法提供了描述BP与CBF关系的度量标准,但事实上,除了CA外,这些参数还受其他许多因素的影响。
1.3 传递函数分析
虽然测量CA方法诸多,但具体方法的选择仍然是个人的习惯,至今无公认的金标准。然而,由于CA的概念代表了BP(刺激或输入信号)和CBF(反应或输出信号)之间的动态关系,采用基于BP自发波动的TFA是目前研究中的常用方法。测量CA的TFA参数包括增益、相位和一致性。Arenda Hea van Beek解释了这些参数的生理意义以及如何与其他评估CA的方法相关联。
1.4 传递函数分析方法学的背景简述
为了统一认识,有必要简单介绍下TFA是如何与线性控制系统理论关联的。TFA用于评估可反映人类脑血管自动调节系统的动态行为变化的前提是假设CA是一个线性控制系统。而现实中,BP变化可导致脑血管阻力变化,进而影响CBF,但除BP之外,其他诸多变量如CO2,也会影响CBF,故CA并非线性系统。尽管如此,将CA“简化”为线性系统,再用TFA分析CBF动力学是可行的,但解释结果时需要记住上述的其他影响因素。

图1 传递函数分析的主要步骤
通常,TFA是利用傅里叶方法,将平稳的输入和输出信号,即具有稳定的统计矩的变量,主要是均值和方差,分解为多频率的正弦和余弦的叠加。在线性假设下,正弦波输入将被转换成相同频率的正弦波输出,但和原信号相比,输出信号振幅或增益不同,并且通常会有时间上的偏移,即反应相位差(图1)。虽然可以直接计算每个频率的增益与相位,但由于现实中存在诸如无关噪音等影响,不太容易评估其可靠性。采用一致性函数有助于识别哪些情况下增益和相位的评估可能是不可靠的。一致性在每个频率上的值均介于0与1之间,类似于相关系数的平方,体现了各个频率的输出方差中有多少比例源自对应该频率的输入功率。对于高信噪比且单变量输入-输出关系的线性系统,一致性函数将趋近1。另一方面,如果信噪比低、系统为高度非线性或有其他变量影响输出时,一致性函数则趋近0。
1.5 白皮书的理论基础
总之,通过记录静息时BP和CBF的自发波动或者通过动作诱发波动[通常用经颅多普勒超声(transcranial Doppler,TCD)测定的脑血流速度(cerebral blood flow velocity,CBFV)代表CBF],TFA可获取频率依赖的增益和相位评估,并根据一致性函数评估这些数据的可靠性。尽管理论可行,但实践中TFA参数和设置的范围很大,导致文献中TFA分析动态CA的结果范围也很大,严重限制了不同研究之间的比较,阻碍了该方法的临床应用,例如,缺乏标准化的主要后果之一是很难明确界定正常与受损的自动调节。
因此,白皮书旨在完善和标准化动态CA研究中TFA的参数和设置。本白皮书始于但不局限于脑血流自动调节研究网络(CARNetwww.car-net.org)。被推荐的建议来自于不同的研究团队,他们分别独立完成了工作,以提高改进TFA测量和分析技术方法的证据水平。本报告推荐的关于人类TFA最合适的评估方法的一系列建议是建立在回顾及批判近期生理和模型研究的基础之上的。这仅仅是实施改进方法的第一步,不应该被视为阻碍继续改进参数设置或方法的“约束衣”。可以想象,这些推荐将使检测结果更稳定、更可靠,并尽快推动该研究结果的临床转化。
最后,特别强调,白皮书选择了TFA,并不意味着TFA就是现有检测CA的最佳方法。
2 方法学
对与本报告主题相关的TFA文献进行了系统回顾。先前发表的文献(包括有详细的搜索策略和研究纳入标准)显示,TFA所采用的信号处理方法、实验室条件和研究流程有很大差异。与此倡议相关的是近期由脑血流自动调节研究网络所发起并进行的多中心研究所生成的报告,其构成是基于不同的研究中心以各自的TFA设置(滤波、频率范围、取样窗、分段等)对记录了健康患者的BP及TCD的单独的、联合数据库所进行的分析。该研究揭示了TFA设置不同对最终的分析结果的影响。
我们努力让以下每一个推荐均能提供出引文证据。TFA所依赖的完善的数学框架是线性系统分析的一部分,多数情况下,这是后文推荐选择参数和设施的主要理由。然而,白皮书中仍有一些方法学不太明确,需要更多的证据。
采用TFA检测CA的主题包括5个部分:实验流程、数据准备和预处理、TFA方法、TFA参数提取以及报告TFA结果。
3 白皮书推荐
3.1 实验流程
白皮书的主要目的是标准化TFA流程。要得到稳定、可靠的结果,必须对数据获取和检测方案制定准则,包括可影响CA的环境条件、体位、检测技术和生理协变量等。
推荐1
检测需要在一个空调的环境中,理想温度是22~24 ℃。检查前至少4 h避免饮用含咖啡因的饮料、巧克力和难消化食物,还须在检查前至少12 h避免运动和摄入酒精。保健品和各种药物也可以影响TFA,需要根据实验目的酌情考虑。如果检测静息状态下的CA(基线),应该尽量避免视觉或者听觉刺激(不能有人员进出干扰)。但如果CA分析只是包括神经血管耦联在内的分析的一部分,则应在可控制条件下给予感觉刺激。充分告知受试者检测流程,尤其是焦虑症者,有助于减少恐惧和焦虑。应该记录呼气末CO2,确保检测过程中呼吸维持稳定(避免过度通气或者通气不足),因为即使CO2微小的变化也能影响CBF。由于CA存在昼夜生物节律变化,故推荐在相似时间段检测,以保证检测的可重复性。对于组间研究,评估时间应统一规定。而对颅内压(intracranial pressure,ICP)增高患者,检测时应注意平均ICP;尽管已经有其他方法评估脑灌注压,但将脑灌注压用作TFA输入信号进行分析,还有待进一步的研究。
为了检查静息状态或基线水平的CA,受试者应休息15 min后,在仰卧位或下肢未交叉的坐位测量BP和CBFV。应该明确记录所有检查体位(如头高30°的仰卧位)。
针对可控条件少的情况,如重症监护室的患者,则不能遵照上述推荐,应将此作为局限性,并讨论对结果的影响。
证据:TFA的基本前提之一是数据的平稳性。严谨的研究需要稳定的生理条件,并尽量控制CBF和CA的混杂因素和共同变量。老年心力衰竭患者检测前至少仰卧位休息12 min以稳定BP、心率和心搏量;而高血压患者检测前应坐位休息15 min以稳定血压。
推荐2
大多数研究动态CA的TFA是应用手指动脉的动脉容积夹记录持续的无创性BP测定,以及应用TCD记录CBFV作为CBF的替代指标。还有其他许多方法可以替代记录上述变量,不在本文讨论范畴。但必须说明当检测方法不同时,例如用TCD或者近红外光谱法评估CBF,增益、相位和一致性的评估会有很大差异。而且,设备会有信号输出延迟,例如Finapres(Finapres医疗设备,阿姆斯特丹)对重建肱动脉BP信号有固定输出延迟1 s,而CO2分析仪(capnography设备)信号延迟时间取决于使用管子的长度等。因此,有必要知晓此延迟,并在同步化BP和CBFV(和其他参数)信号时给予考虑。
鉴于PaCO2严重影响动态CA和BP,测量BP和CBFV时要同时纳入PaCO2。常采用近红外CO2分析仪或质谱法记录呼气末CO2。在分析TFA结果时,应记录和重视任何明显的PaCO2波动(>1 mmHg)。如果有ICP监测(如重症监护病房),还应在分析动态CA时记录ICP水平,毕竟颅内高压可损害CA。
证据:TFA分析需要连续记录数据。不能控制的生理学变量如PaCO2及ICP,应该被记录,并在结果分析中考虑其变化性。
推荐3
TFA研究要求至少持续记录5 min BP和CBFV自发波动的、生理条件稳定的、不间断的高质量的数据,以保证得到传递函数参数的稳健数值及改善后文中详细介绍的频率分辨率。某些生理实验如高碳酸血症,为了获取稳定的生理条件,需要记录更长时间,最少持续5 min。
证据:后文推荐11和推荐12的技术规格的前提是需要数据至少连续记录5 min。
3.2 数据准备与预处理
关于采样频率。文献还显示了各种范围的采样频率,即连续的输入信号在1 s内被采样记录了多少次。注意不要与后文描述的插补每搏心跳数据时所使用的“再-采样率”发生混淆。
推荐4
将BP和CBFV连续信号进行模拟-数字转换时,推荐的最小采样频率为50 Hz,接下来是合适的抗混叠滤波,典型的低通频率截止值为20 Hz。
证据:Nyquist定律规定,采样频率至少是采集信号最大频率的双倍。众所周知,对于心血管数据,有意义的功率其频率不会超过20 Hz,因此,符合Nyquist定律的采样频率至少是50 Hz。然而,在工程实践中,若是考虑到设备及数据储存的可行性,通常会优选设置比Nyquist频率高4~5倍。

图2 健康成人的血压和脑血流速度的代表性数据
关于波形与每搏的数据。TFA文献显示,BP和CBFV的时间信号采用了两种格式:①记录BP和CBFV信号的原始波形;②每搏心跳数据(如每搏心跳时的平均BP和平均CBFV)。Brian M. Deegan等比较了采用完整波形时间信号与每搏心跳数据之间的TFA结果,发现无伪迹数据时,两种方法相关性很好;而有伪迹的数据,完整波形分析更容易受到干扰,例如Finapres BP设备的“physiocals”功能,会造成缺失BP数据的短片段。
推荐5
目前大多数研究采用每搏心跳数据分析TFA,可实现标准化,所以推荐用于未来的研究。而且,每搏心跳数据的重要优势是,相比完整波形分析,对于BP或TCD数据短片段的缺失不敏感。推荐的最常用方法是将BP舒张值的时间作为每个心动周期的起、终点,根据波形积分(曲线下面积)得出每个心动周期的平均BP和平均CBFV。建议目视检查原始信号,以核实该方法可在心动周期正确获得BP和CBFV波形。
证据:Brian M. Deegan等直接比较了完整波形与每搏心跳数据分析,及缺失数据是如何影响这两种方法的。
推荐6
数据分析之前,均应目视检查信号(最好是检查原始的及每搏心跳的平均信号),以确保数据无过多噪音及伪迹(图2)。应删除短时程的强伪迹(多达3次心跳),并由线性插值取代。当伪迹过多、持续时间较长时,直接从分析中删除此数据片段。散发的异位搏动数据可被纳入分析。
证据:Brian M. Deegan等证实,短时异位搏动片段数据的插值(或如生理因素所致数据丢失)并不会影响TFA检测参数。目前还不清楚通过插值能去除的异位搏动的最大次数;但Brian M. Deegan等认为0.03~0.07 Hz频段的缺失<10 s时可以接受,而0.07~0.5 Hz频段每50 s缺失5 s则导致结果不可靠。
关于插值法。TFA设定等距的数据点。通过在一组已知的离散数据点范围内构建出新的数据点,插值法可用于创建等距时间间隔(仅在每搏心跳数据)。可用不同类型的插值,如线性和仿样插值法,但已证实此选择不会明显影响TFA检测。
推荐7
为了各中心流程标准化,推荐采用仿样插值(三阶多项式)计算每个心动周期时间系列的平均BP和平均CBFV。对于从每一心动周期(每搏心跳数据)获取的BP和CBFV均值,在插值后最小再采样频率应为4 Hz(为了得到一个规格统一的时间轴)。此过程见图3。
证据:将不同类型的每搏心跳插值进行比较,无差异。该推荐旨在进一步推进标准化及心率快时避免结果偏差。
关于去趋势。去趋势通过去除数据中任何线性或非线性趋势,降低了低频功率的数量。Meel-van den Abeelen等证实,采用何种类型的去趋势(包括无去趋势、线性趋势的去除和3阶多项式去趋势)并不影响TFA结果,但是,这个结果是在由计算机生成(合成)的输入输出信号呈绝对线性相关且无任何杂讯的数据中得出的。这或许可以解释为什么在合成信号中没有看到去趋势的利与弊,却在测量的人类受试者的信号中可能会看到。应该对加了噪音及信号漂移的合成信号做进一步的研究,以确认上述观察结果。尽管如此,去趋势去除的将是低于0.01 Hz的极低频趋势。我们推荐,将低于该范围的频率从TFA分析中排除(见推荐13),这解释了为什么去趋势不会对结果造成明显的影响。
推荐8
为了使各中心的分析程序一致,我们建议对未去趋势亦未高通滤波的数据进行分析。但TFA分析之前应该先去除平均值并将其值保留以备进一步分析用,例如正态化(见推荐15)。
证据:没有足够的证据证明去除信息(通过去趋势)在临床应用中具有潜在诊断或预后价值。但需要注意的是,删除平均值时需最小化频谱漏。

图3 每个心跳周期内的每搏血压或脑血流速度平均值计算及其后续的插值与重采样过程
推荐8的说明:如果数据的变化趋势大,这提示数据本身存在质量问题(如无创BP信号中的漂移或者有创导管BP信号的衰减),或者数据采集时的生理状态不稳定,如高碳酸血症或者低碳酸血症。无论哪种情况,最好去掉这些数据。或者,在作者判定出其数据中存在一个他们认为可能影响频谱分析的极低频趋势时,去趋势的作用尚待进一步论证,并判定如何处理此趋势。
关于滤波。滤波是用来滤掉不被关注的频率,如极高频或极低频。文献中只有少数(11%)的研究用过各种类型的滤波。滤波对TFA结果的影响尚未明确。
推荐9
不推荐TFA分析之前对数据进行低通或高通滤波。
证据:没有证据表明哪一种类型的滤波是合理的,该推荐旨在推进流程的标准化。
推荐9的说明:在TFA过程中,获取每搏心跳均值的步骤相当于低通“滤波”,允许并推荐采用此步骤(见推荐5)。
3.3 传递函数分析的方法
TFA常用快速傅里叶转换(fast Fourier transform,FFT)计算,以获取自相关和互相关频谱。单一数据窗的频谱分析得到的变异系数(标准差/平均值)呈散点分布,约等于1。为了提高频谱分析的精确度,需要进行平均化或平滑化处理,常用Welch方法将完整的数据分割为单独的片段或窗长以获得平均的自相关及互相关频谱。除了分割信号外,在频域中还可以用移动平均滤波器对频谱进行平滑化处理。由于存在频谱漏现象,在FFT计算前,时域中的每段数据必须应用锥形窗(推荐10)。
关于选择最佳参数设置。关于TFA近期的系统性综述显示,TFA采用的信号处理方法多样。文献中采用的设置及参数各不相同,如数据的类型(原始数据或每搏平均值)、采样频率、插值、去趋势、正态化、滤波以及估算功率频谱密度时采用的取样窗的长度和类型、数据片段的数量和重叠幅度等。推荐的参数见下文和表2。应保证TFA设置的精确,因为已经证实,设置上小的差异却可导致TFA结果很大的差异,使结果无法比较。
关于防漏窗。数据片段需要窗函数处理,以尽量减少一种特殊类型的失真-频谱漏。各种形状的防漏窗,如Hanning、Hamming和Tukey窗已经被应用。近期一项多中心研究对不同中心的TFA方法学进行了比较,发现采用Hamming或Hanning防漏窗的分析结果并无显著差异;但Tukey窗在极低频频段(0.01~0.07 Hz)的增益和相位失真。然而,这个结论是基于无伪迹的模拟信号,对CA研究中记录的真实信号有何影响尚未评估。
推荐10
为了最小化出现频谱漏,推荐Hanning窗函数。
证据:为了最小化频谱失真,FFT分析之前需要应用Welch算法的窗函数处理数据。无足够证据显示Hamming及Hanning防漏窗分析之间存在结果的差异。但为了标准化,推荐选择Hanning取样窗。
关于取样窗的长度。窗内数据点数量与采样频率共同决定了以秒为单位的窗长,而这将决定传递函数评估的频率分辨率(△f=1/T,其中△f是频率分辨率、单位赫兹,T是窗的持续时间、单位秒)。经模拟显示,窗长<75 s的结果与预期值偏差较大,特别是在极低频段范围内。
推荐11
为了保证频率分辨率,推荐窗长至少100 s。使用Welch算法时,当可用数据的长度超过5 min时,最好增加窗的数量,而非增加窗长。
证据:不适用。在选择用来平均一致性、增益和相位的频带时,较高的频率分辨率可以提供更大灵活性。
关于数据段的数目和叠加。如前所述,文献中计算自相关和互相关频谱的主要技术是采用(快速)傅立叶转换结合Welch方法,以改进统计的可靠性。此涉及将分离的数据片段频谱进行平均,并通过各种不同程度的叠加进行重叠以最大程度平滑化。文献报道,分别用25%、50%和75%的叠加度百分比进行叠加并不会影响TFA结果,最常用的叠加度是50%。
推荐12
推荐在Welch算法协作下,对重叠数据片段采用50%叠加。结合此推荐,整个数据记录的最小时限至少5 min和窗长>100 s,意味着采用Welch方法需要结合至少5个独立的数据段。当记录时间超过5 min时,不应该增加取样窗长,而是应该增加窗的数量。为了充分利用可用数据的全部长度,推荐将窗的重叠度调整为50%左右。
证据:尚无足够证据判定采用特定程度的叠加。相较于未选择叠加的情况,推荐旨在改进标准化和改进检测值的统计稳健度。
关于频谱平滑化。采用FFT分析自相关与互相关谱后,在频域中通过一个移动的平均滤波器平滑化频谱,提高其可靠性,尤其是一致性函数的可靠性,具体将在后面讨论。
推荐13
自相关和互相关谱应该用一个系数为[1/4,1/2,1/4]的三角形移动的平均窗平滑化处理。
证据:频谱平滑化提高了TFA参数的可靠性,并降低了具有统计意义的一致性的阈值(见推荐14)。为改进标准化,推荐使用一个三角形的三点窗口。
关于一致性函数。如在引言中所述,假定BP-CBFV线性相关时,评估一致性函数对实现每个频率的增益和相位值是否有效是至关重要的。最简单的方法是检查一致性的值是否高于某个阈值,通常采用无效假设为输入与输出无关的,即理论上一致性为0的95%可信区间(即5%的临界值)。注意,有些文献将一致性定义为“幅值取平方的一致性”。判断一致性的最小值应该是多少才能视作与0显著不同时必须考虑的一个因素是在计算中用独立观察次数,这常被定义为自由度(degrees of freedom,DF)。类似于相关系数(correlation coefficient,r),用于说明在这种情况下DF是怎样起作用的。例如,如果仅观察10次计算出r=0.3,这代表与0无显著差异(P>0.05);而若是观察30次得出相同的r值,则差异有显著性(P<0.05)。这个原则同样适用于一致性,但这种情况下,DF的确定需要结合TFA参数设置(表1和2)。由于频谱的计算是由正弦系数和余弦系数的平方项求和,其应符合DF=2的卡方分布。傅立叶分解的一个重要特性是,不同频率对应的正弦系数和余弦系数在统计学上是独立的。这意味着,如果求两个相邻谐波的频谱的均值,DF数将增到4,并依此类推。虽然已经提出了评估一致性临界值的方程,但更实用的数值是源于采用了蒙特卡洛模拟法的一组特定参数,见表2推荐。应用这些参数,表1给出了Welch算法中不同的数据段(“窗”)下的一致性函数的临界值,图4给出了窗数与一致性函数临界值的关系。如表所示,如果仅采用3个窗数,则5%的临界值将是0.51,接近于大多数研究者所采用的正常值γ2min(f)=0.5。但增加窗数,临界值会明显降低,例如,9个窗时会减少至0.20。这个例子说明了DF是怎样影响具有统计学意义的一致性函数阈值,以及为什么不能用单一的、一刀切的阈值,如之前已被广泛采用的γ2min(f)=0.5。当一致性函数的值低时,经常提示要舍弃增益和相位值,所以应严格计算阈值,以避免漏掉可用的数据或纳入不可靠的数据。而且,尤其要注意,当极低频(<0.05 Hz)时,BP与CBFV非线性关系,由于脑血管阻力变化相对较大,即使符合一致性的临界值,此频率范围内也无法用此方法。例如,在自发波动与通过重复蹲-站动作强化波动的TFA分析结果比较试验中,已经证实了上述现象。如预期一致,与自发波动相比,强化波动的频谱功率更高,极低频的一致性函数会增加。值得注意的是,自发波动时低值的一致性函数获取的增益和相位值与高值的一致性函数获取的增益和相位具有可比性。

表1 推荐的传递函数分析设置及其对应的一致性临界值

表2 标准化TFA参数设置的建议
推荐14
用于删除数据的一致性的阈值(或截止值)的定义必须用具有统计学意义的一致性函数作为指导。统计计算必须考虑到具体实施的自由度的数量,这取决于窗的数量、重叠、频谱的平滑化和窗的其他设置(图4)。推荐:如果一致性在所有频带中都低(无统计学意义),则该记录不被纳入分析,因为数据质量差,预期结果将不可靠。计算不同频带的平均相位和增益时(见推荐17),应该将频带中那些一致性不超过该频率的临界值的频率点从平均值中删除。表1提供了以窗数为函数的一致性可信区间。这些值适用于单个谐波(频带内的单个频率点)。在整个频带内的平均谐波将降低表中的数值。
证据:理论分析和使用替代数据的模拟均证实,一致性的分布取决于对频谱自由度数量的评估(图4和表1)。

图4 在3~15个窗内,显著水平为α=0.01、0.05和0.1时评估一致性的临界值
3.4 从TFA提取参数
关于计量单位。一致性函数无单位。关于相位的单位,有的文献用弧度,有的文献用角度数,大约各占一半,但两者可以直接换算(α0是指度数,αrad是指弧度)。然而,关于增益的单位的选择,其影响尚未明确。正常静息状态时CBFV和BP的自发波动常低于基线均值的10%。实践证明,计算FFT时删除平均值比较好(将在下文讨论报告)。因为声波的入射角度未知,不同个体间入射角存在差异,尤其是个体间血管直径的差异(对CBFV的影响最大),导致用CBFV的绝对值进行比较受限。对于CBFV以百分比变化表示其均值存在很大争议,但可降低受试个体间CBFV幅度与增益的变异性。现有选择是应用绝对值及相对值表达这两个变量,对应单位为cm/(s·mm Hg),%/mm Hg,%/%或者cm/(s·%)。文献显示,比较常用的是前3个,第4个不常用。理想情况是,任何条件下,增益的单位均有最大的敏感性和特异性,但遗憾的是,至今无研究能够回答这个问题。有人反对统一BP值(用%表示变化程度),举例说明,当BP改变10%时,对平均BP基线值为90 mm Hg与150 mm Hg的个体的生理影响则完全不同。
推荐15
TFA得出的增益可用绝对值[cm/(s·mm Hg)]和百分比(%/mm Hg)表示。
证据:在缺少增益的研究中,比较两个不同的单位通常换算成增益-频率反应,而多中心间比较时为方便交流,所有研究中增益的单位均用绝对值[cm/(s·mm Hg)]和百分比(%/mm Hg)。
关于相位环绕。相位评估需要计算复数传递函数的实部对虚部比值的反正切(tg-1)。遗憾的是,反正切的计算无法对介于π至2π弧度间的相位值与其相对应的负角度做出鉴别。当对一组受试者或是数个频率的相位取平均时,若是相位值有正、负值掺杂,则无法判定相位,则此相位未定,通常称为相位环绕,可能导致结果严重失真。图5列举了相位环绕。
推荐16
每个受试者完整相位频率反应需要通过目视检查“环绕”发生情况(图5)。当负值的相位出现在频率<0.1 Hz时,应该从极低频和低频频带中删除这些平均;而较小的负值的相位预期出现在频率>0.1 Hz时,计算高频频带的平均时则不需删除。
证据:若负值相位源于极低频或低频频带中的相位环绕,则该组受试者的相位平均值估值将因为对正值与负值取平均而失真。
3.5 报告TFA结果
TFA精确设置后,以标准化模式报告TFA结果很重要。
早期系统性综述中显示,TFA结果呈现方法多样。总的来说,这些研究报告了特定频段的增益、相位、一致性的均值。既往最常应用的频带:极低频0.02~0.07 Hz、低频0.07~0.2 Hz、高频0.2~0.5 Hz。然而,在不同的患者中和(或)在不同生理条件下检测CA受损的敏感性和特异性的证据缺乏。而且,一些中心应用不同方法,如通过加权值(如用一致性函数的截止值),算出跨频带的均值,但在文中总是未被备注。
推荐17
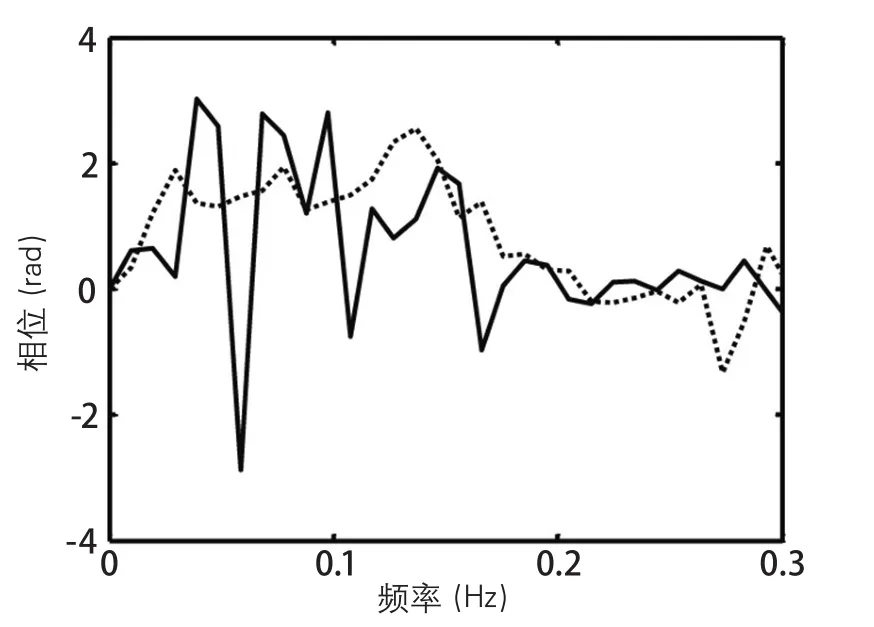
图5 频率<0.1 Hz时相位环绕的发生
在报告T FA结果时,重要的是呈现0.02~0.5 Hz频带范围内所有频率对应的一致性、增益和相位在每一个频带内的均值和标准差。理想情况下,还应该提供每个频率内CBFV和BP的功率谱密度分布。在有新证据之前,统计分析应以极低频(0.02~0.07 Hz)、低频(0.07~0.2 Hz)和高频(0.2~0.5 Hz)的平均值为基础。此外,还应报告BP和CBFV的均值及其记录自身的变异度。具体的计算均值的方法,例如频带内个体值的加权,应单独备注,且必须清楚报告使用的方法。
证据:尚无足够证据判定选择特定频带的一致性函数、增益和相位的均值。该推荐旨在提高标准化。低于0.02 Hz频率时BP和CBF之间的相位和增益值不可靠,所以截止频率的下限选0.02 Hz。如果研究者们提供的数据具有高的频谱分辨率且数据长超过5 min,并且有信心可以评估较低频(低到0.008 Hz)的数据,则这些可作为附加分析,但必须提供上述频带内的具体数据,以便多中心比较。
3.6 应用
将指南转化至日常临床工作和研究仍具有挑战性。该白皮书的主要目的是提高研究成果的可重复性及实现应用。表2概况了上述TFA量化CA所推荐的条目。
作为应用的第一步,我们鼓励研究人员将他们的做法与白皮书中推荐的设置进行比较。虽然一些研究人员为了不采纳推荐的设置,还进行了激烈的争论,我们仍强烈建议所有的同行都呈现应用推荐设置后的结果(即使仅仅是作为附加的结果),以便将不同的研究及不同的中心之间进行比较。对“标准”设置有异议应该提出来,有助于将来修订白皮书。被推荐的设置并不代表是“最好的”(无论采用何种标准),而且需要强调的是,推荐的一些设置的支持证据仍然不足,但标准化的应用大大改善了多中心之间持续存在的巨大分歧。
3.7 数据库校准
研究人员可能希望验证他们的软件及设置是否能正常工作;而对于医疗设备,定期校准是很好的质控检查方式。因此,我们决定提供一个特定的“测试数据库”,是已经得知其TFA详细结果的BP和CBFV记录的数据库。表3提供了这些TFA结果。研究者可以从脑血流自动调节研究网络网站下载数据(http://www.carnet.org/content/resources),分析数据,并与表3提供的校准结果进行比较。当更改软件或设置后,软件升级或采用同行的新方法后,此数据库可用于检查结果的精确性。
4 讨论
该白皮书为应用TFA定量分析包括BP及CBFV信号的动态CA提供了推荐。
对白皮书的迫切需求是缘于TFA检测中信号处理方法在国际交流中存在很大差异。除了脑血流自动调节研究网络所发起的多中心研究曾经调查一些参数设置对TFA结果影响作用之外,仅仅少数的研究公开发表了不同TFA设置的影响作用。因此,仍存在诸多不确定性,尚待更多研究明确。未来的研究将利用现有的工作基础,进一步优化白皮书的推荐。

表3 CARNet数据库的参数结果的参考值
概述未来可能最有研究价值的方向,具体如下:
①更多地研究探讨不同设置对TFA的影响,如数据选择、数据记录最佳的持续时间、正态化、窗长及滤波。
②提倡应用国际标准方案获得有效的CBFV信号,保证信号质量,以降低TFA结果的变异性,便于不同研究之间进行比较。
③研究确定特殊人群如儿童、老人及特殊疾病患者的参考值及诊断价值。
④基于TFA结果,明确其标准化的决策标准。
⑤应该更关注实验方案或者临床方案,包括调查“休息”状态是否是最好的研究状态,如果是,评估哪个体位(仰卧位/坐位)及生理性诱发动作可以增强血流动力学的波动。
⑥其他的分析技术也可以进行相似的研究,如时域相关系数分析、非线性多模血流分析以及应用volterra核心的laguerre扩展或主要动态模式的动态非线性分析,并对其判断CA受损的能力进行方法学的比较。
⑦与TFA相比,其他的分析技术(见上文⑥)可为CA参数提供较高的时间分辨率,将有利于进一步调查CA的非稳态属性。
⑧应研讨PaCO2对CA整个过程的动态影响,并纳入CA的分析中。
⑨应关注ICP对TFA参数的影响,包括一致性函数,ICP的平均值(如颅内高压时)及波动的振幅。
⑩应接受并理解CA不是脑灌注调控的唯一机制。我们需要知晓其如何与CBF调节的其他机制如神经血管耦联、CO2反应性及其调控BP(如动脉的压力感受性反射)、心率和呼吸的机制相互作用。
最后,我们强调,这些推荐并非支持TFA是量化分析CA“最好”的方法。TFA最主要的局限性之一是其假设BP与CBFV为线性关系,而一般情况下,CA更多地被认为是一种非线性现象。其他方法,如非线性的方法,可以提供更可靠或更敏感评估CA的方法,但在一直缺少评估动态CA的金标准的状况下,需要明确的标准和更多的多中心研究才能得出稳定的结论。同时,该白皮书建立标准化的目的是为各研究之间进行有意义的比较,包括寻找更好的CA分析方法。
资金:研究得到以下资助:Internationale Stichting Alzheimer Onderzoek(ISAO)grant # 05516 to Jurgen AHR Claassen,Netherlands Heart Foundation grant# 2008B113 to Jurgen AHR Claassen;Marina ten Damme grant to Aisha SS Meel-van den Abeelen; EPSRC(UK)-projects EP/K036157/1,EP/G010420/1,EP/K036181/1 to Ronney B Panerai and David M Simpson.
利益声明:作者们无利益纠纷。
作者的贡献:Jurgen AHR Claassen完成了初稿、修改稿及终稿,协调写作、收集讨论资料,进行了研究,生成了本文的研究背景。Aisha SS Meel-van den Abeelen完成了初稿,修改了终稿,收集了该领域以前的文献,进行了研究,生成了本文的研究背景。David M Simpson完成及修改了本文的一部分,提供了分析和在线数据计算和一致性的表格,并完成了本文的研究背景。Ronney B Panerai完成了论文的一部分,对整个文本进行了编辑及修改,与Jurgen AHR Claassen共同完成了对早期版本的同行评审和建议,积极参与完成了本文的研究背景。
参考文献:请见原文。
附录:同行评审及建议的联合签名的专家名单
比利时:
› Alexander Caicedo Dorado,Department of Electrical Engineering-ESAT,SCD-SISTA and iMinds Future Health Department,Leuven(Research Foundation Flanders postdoctoral fellow).
加拿大:
› Georgios D Mitsis,Department of Bioengineering,McGill University,Montreal QC,Canada. Patrice Brassard,Department of Kinesiology,Faculty of Medicine,Universite′ Laval Que′becCanada; Research Center of the Institut Universitaire de Cardiologie et de Pneumologie de Que′bec,Que′bec. Philip N Ainslie,School of Health and Exercise Science,University of British Columbia Okanagan,Kelowna,B.C.
意大利:
› Paul Summers,Division of Radiology,Istituto Europeo di Oncologia,Milano.
日本:
› Kenichi Iwasaki,Department of Social Medicine,Division of Hygiene,Nihon University School of Medicine.
立陶宛:
› Arminas Ragauskas,Kaunas University of Technology,Telematics Scientific Laboratory,Kaunas.
新西兰:
› Yu-Chieh Tzeng,Cardiovascular Systems Laboratory,Centre for Translational Physiology,University of Otago,Wellington.
瑞士:
› Martin Müller,Luzerner Kantonsspital,Zentrum für Neurologie und Neurorehabilitation,Lucerne
台湾:
› 王政严,台湾中央大学自适应数据分析研究中心(Cheng-Yen Wang,Research Center for Adaptive Data Analysis,National Central University.)
› 胡汉华,台北阳明大学神经科(Han Hwa Hu,Neurological Department National Yang-Ming University Taipei.)
荷兰:
› Aisha SS Meel-van den Abeelen,Radboud University Medical Centre,Department of Geriatric Medicine,Nijmegen.
› Erik Gommer,Maastricht University Medical Center,Department of Clinical Neurophysiology,Maastricht.
› John M. Karemaker,Academic Medical Center,Amsterdam,Systems Physiology.
› Jurgen AHR Claassen,Radboud University Medical Centre,Department of Geriatric Medicine,Nijmegen.
› Marcel Aries,Universitair Medisch Centrum Groningen,The Netherlands.
› Johannes J. van Lieshout,Internal Medicine& Clinical Cardiovascular Physiology,Academic Medical Centre,Amsterdam &School of Life Sciences,The Medical School,University of Nottingham.
俄罗斯:
› Vladimir Semenyuti,Laboratory of brain circulation pathology,Russian Polenov Neurosurgical Institute,Saint-Petersburg.
› Vugar Aliev,Laboratory of brain circulation pathology,Russian Polenov Neurosurgical Institute,Saint-Petersburg.
英国:
› David M Simpson,Institute of Sound and Vibration Research,University of Southampton,Southampton;
› John Potter,University of East Anglia,Norwich.
› Peter Smielewski,Xiuyun Liu,and Marek Czosnyka,Academic Neurosurgical Unit,Cambridge University Hospital Trust,Cambridge.
› Ronney B. Panerai,Leicester NIHR Biomedical Research Unit,and Department of Cardiovascular Sciences,University of Leicester,Leicester.
› Stephen Payne,Institute of Biomedical Engineering,Department of Engineering Science,University of Oxford,Oxford.
› Damian Bailey,Neurovascular Research Labaoratory,Faculty of Life Sciences and Education,University of South Wales.
乌拉圭:
› Bernardo Yelicich,Corina Puppo,Emergency Department,Clinics Hospital,Universidad de la República School of Medicine,Montevideo.
美国:
› Dae Shin,Biomedical Simulations Resource,University of Southern California,Los Angeles.
› Caroline A Rickards,Department of Integrative Physiology,University of North Texas Health Science Center,Fort Worth,Texas;
› Jorge Serrador,Rutgers University,New Jersey and Veterans Affairs New Jersey Health Care System,East Orange,New Jersey.
› Rong Zhang,Institute for Exercise and Environmental Medicine,Texas Health Presbyterian Hospital of Dallas and The University of Texas Southwestern Medical Center at Dallas,Dallas,Texas.
› Vasilis Marmarelis,Department of Biomedical Engineering,University of Southern California,Los Angeles.
› Vera Novak,Division of Gerontology,Beth Israel Deaconess Medical Center,Boston.
原文:CLAASSEN J A,MEEL-VAN DEN ABEELEN A S,SIMPSON D M,et al. Transfer function analysis of dynamic cerebral autoregulation:A white paper from the International Cerebral Autoregulation Research Network[J]. J Cereb Blood Flow Metab,2016,36(4):665-680. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4821028/

