硫酸小檗碱对猪轮状病毒感染的IPEC-J2中TGF-β1、EGFR、EGF、IGF1 mRNA表达的影响
徐环叶,李妹玲,陈立功,,王丽叶,孟利佳,崔 欢,张 诚,白 晓,王迎春,董世山,*
(1. 河北农业大学动物医学院,保定 071001; 2.农业部动物疫病病原生物学华北科学观测实验站,保定 071001; 3.邯郸市涉县农牧局,邯郸 056400)
仔猪腹泻是各国养猪业发展中遇到的普遍难题,其中病毒性腹泻在规模化猪场的发病率呈明显上升趋势[1],猪轮状病毒是引起仔猪腹泻的病原之一,病毒主要侵害小肠,导致肠道黏膜损伤,使小肠吸收功能失调,从而引起腹泻,临床表现为呕吐、水样腹泻等症状[2]。因此,如何采取有效措施保护和修复肠道损伤,防治仔猪的腹泻,提高仔猪成活率,已成为养猪生产中亟待解决的问题。
小檗碱又名黄连素[3],是从中药黄连等植物中提取的异喹啉类生物碱,其硫酸盐衍生物即硫酸小檗碱(berberine sulfate,BS),在人医和兽医临床都具有确切的抗腹泻功效,能明显延长小肠传递时间,对治疗消化道黏膜损伤和溃疡效果较佳。
近年来,许多文献报道小檗碱具有抗病原体、抗毒素、调节机体免疫功能等药理作用[4-6],关于其对肠道修复因子基因表达的影响尚未见相关报道。腹泻期间肠道黏膜损伤后,肠道修复受多种修复因子调节。其中促进仔猪肠道发育和修复的生长因子主要有转化生长因子(TGF-β1)、表皮生长因子受体(EGFR)、表皮生长因子(EGF)、类胰岛素生长因子(IGF1)。这些因子不仅能够调控肠上皮细胞的增殖、转化,刺激肠道发育,并且能修复受损的肠道黏膜,是腹泻治疗的关键[7-9]。前期研究已经利用MTT法筛选BS对体外培养的IPEC-J2最大安全浓度为20 μmol·L-1,本研究通过PoRV感染IPEC-J2建立试验模型,攻毒前(预防组)和攻毒后(治疗组)使用浓度为0、5、10 μmol·L-1的BS进行干预,同时设空白对照组,对黏膜修复因子基因表达情况进行分析,以揭示BS防治腹泻的作用机制是否与调控肠道修复因子的表达有关,对丰富中兽医理论和开发防治仔猪腹泻的中药制剂意义重大。
1 材料与方法
1.1 病毒与细胞
仔猪肠黏膜上皮细胞(IPEC-J2),购自广州吉妮欧生物科技有限公司;Marc145细胞,由本试验室保存;猪轮状病毒(CVCCAV55),购自中国兽医微生物菌种保藏管理中心。
1.2 主要试剂
硫酸小檗碱,购自上海源叶生物制品有限公司;RNA提取试剂盒、反转录试剂盒、胶回收试剂盒、质粒提取试剂盒、荧光定量试剂盒,均购自宝生物工程(大连)有限公司;pEASY-T1Cloning Kit和Trans1-T1Phage Resistant Chemically Competent Cell,购自北京全式金生物技术有限公司。
1.3 IPEC-J2细胞分组与处理
治疗组:将细胞接种到6孔细胞培养板,各攻毒200 μL,37 ℃感作1 h,弃掉病毒液,加维持液正常培养24 h后,弃掉维持液,分别加浓度为0、5、10 μmol·L-1的硫酸小檗碱2 mL,给药后,继续培养,在6、12、24、36、48 h时,于显微镜下观察细胞生长状态,拍照保存后收集细胞,备用。
预防组:首先在各孔细胞中加浓度为0、5、10 μmol·L-1硫酸小檗碱2 mL,分别在6、12、24、36、48 h时将药液吸出,各攻毒200 μL感作1 h,加维持液培养24 h,于显微镜下观察细胞生长状态,拍照保存后收集细胞,备用。
空白对照组:细胞接种到6孔细胞培养板,不进行攻毒和药物处理,细胞维持液培养。每个样品重复3次。
1.4 荧光定量PCR标准曲线的建立
1.4.1 细胞总RNA的提取 选择上述培养的空白对照组IPEC-J2细胞,采用TaKaRa试剂盒进行操作,提取细胞总RNA,使用核酸蛋白测定仪测定总RNA的浓度和纯度,并分装出5 μL进行琼脂糖凝胶电泳。RNA产物-80 ℃保存,备用。
1.4.2 反转录 反转录合成cDNA参照相关试剂盒的操作(Prime ScriptTMRT reagent Kit with gDNA Eraser),反应体系20 μL。如下:5×gDNA Eraser Buffer 2.0 μL, gDNA Eraser 1.0 μL,Total RNA 1.0 μL,用RNase Free dH2O补足10.0 μL。室温反应5 min。再添加PrimeScript RT Enzyme Mix I 1.0 μL, RT Primer Mix 1.0 μL,5×PrimeScript Buffer 2(for Real-Time) 4.0 μL,RNase Free dH2O 4.0 μL,混匀后37 ℃ 15 min,85 ℃ 5 s。反转录产物-20 ℃保存,备用[10-11]。
1.4.3 引物设计 根据GenBank中已发布的猪TGF-β1(NM_214015.1)、EGFR(NM_214007.1)、EGF(NM_214020.1)、IGF1(NM_214256.1)、β-actin(XM_003124280.4)的基因序列为模板,采用Premier5.0软件设计引物(表1),由上海生物工程公司合成。
表1目的基因引物序列和扩增片段长度
Table1Primersequenceandlength
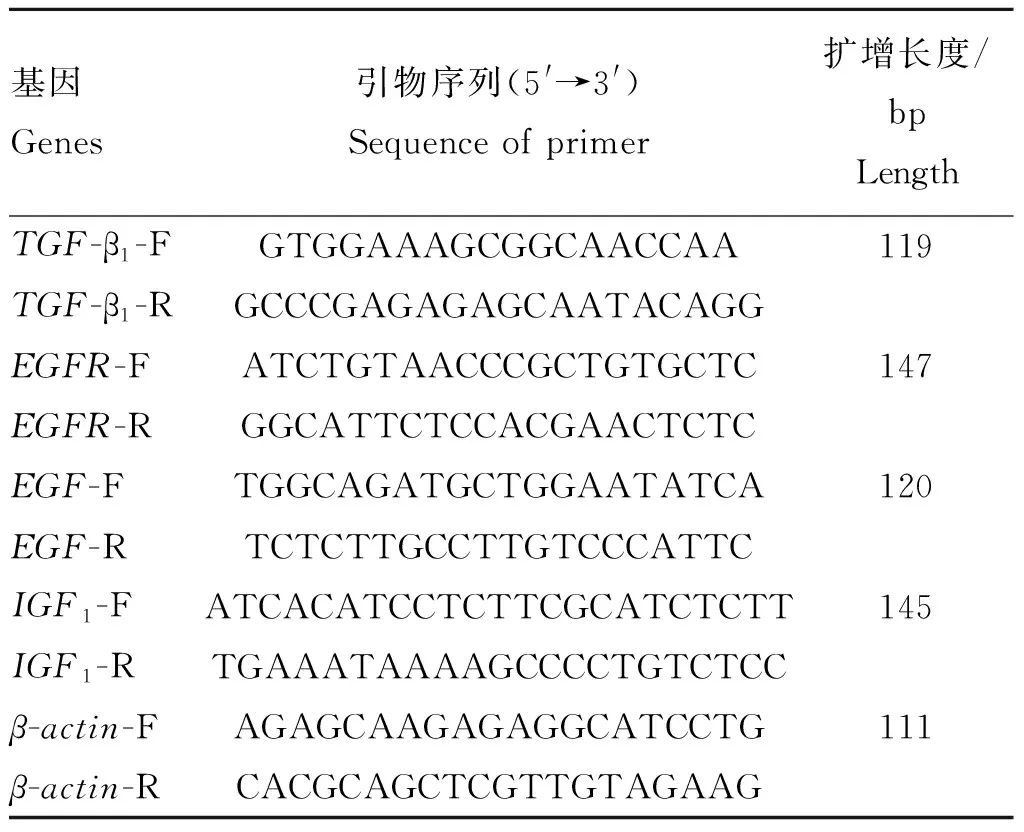
基因Genes引物序列(5'→3')Sequence of primer扩增长度/bpLengthTGF-β1-FGTGGAAAGCGGCAACCAA119TGF-β1-RGCCCGAGAGAGCAATACAGGEGFR-FATCTGTAACCCGCTGTGCTC147EGFR-RGGCATTCTCCACGAACTCTCEGF-FTGGCAGATGCTGGAATATCA120EGF-RTCTCTTGCCTTGTCCCATTCIGF1-FATCACATCCTCTTCGCATCTCTT145IGF1-RTGAAATAAAAGCCCCTGTCTCCβ-actin-FAGAGCAAGAGAGGCATCCTG111β-actin-RCACGCAGCTCGTTGTAGAAG
1.4.4 目的基因的克隆与标准品质粒的构建 参照TaKaRa EsTaqPCR试剂盒对TGF-β1、EGFR、EGF、IGF1和β-actin部分片段进行PCR扩增。反应总体积为50 μL, 2×EsTaqDNA Polymerase 25 μL,上下游引物各1 μL, cDNA 5 μL,灭菌蒸馏水18 μL。PCR产物经2.0%琼脂糖凝胶电泳检测,用胶回收试剂盒回收目的基因后,产物与pEASY-T1Cloning Kit载体连接,转化到Trans 1-T1感受态细胞,过夜培养,挑选阳性菌落,LB培养基(含氨苄抗性)振荡培养12 h,提取重组质粒[12-13]。将所获重组质粒进行PCR鉴定,挑取阳性克隆送上海生物工程技术服务有限公司进行测序鉴定。
1.4.5 标准曲线的建立 将测序结果为阳性的重组质粒DNA,使用核酸蛋白测定仪测定质粒浓度,并换算成标准品拷贝数,倍比稀释成105、106、107、108、109copies·μL-1,以不同浓度的质粒为模板,进行荧光定量PCR反应,仪器收集荧光信号,以质粒拷贝数为横坐标,Ct值为纵坐标,根据荧光值的变化规律,系统将自动生成标准曲线和熔解曲线。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s, 40个循环;循环完成后加一产物熔解曲线,用来分析荧光定量PCR反应的特异性,条件:95 ℃降至65 ℃,每5 s降温0.5 ℃。每个样品孔重复三次,同时每个基因设立3个无模板阴性对照。
1.5 不同组IPEC-J2中TGF-β1、EGFR、EGF、IGF1 mRNA表达的测定
1.5.1 样本细胞IPEC-J2总RNA的提取与cDNA的合成 将上述培养的治疗组和预防组IPEC-J2,按照宝生物工程(大连)有限公司试剂盒进行总RNA的提取与cDNA的合成。
1.5.2 实时荧光定量PCR检测样本 严格按照SYBR Premix ExTaqTMⅡ试剂盒说明书,将上述合成的标准样品和待测样品的cDNA进行实时荧光定量PCR扩增和检测,测定TGF-β1、EGFR、EGF、IGF1基因mRNA表达水平。最后,对待测样品进行定量分析。
1.6 统计分析
2 结 果
2.1 不同处理对IPEC-J2生长状态的影响
显微镜下可见,空白组IPEC-J2单层贴壁生长,排列整齐,生长状态良好,呈梭形、多角形或卵圆形(如图1A);PoRV作用24 h后,IPEC-J2出现聚集成团、变性、脱落坏死甚至崩解死亡的现象(如图1B);预防组(如图1C)和治疗组(如图1D)在PoRV攻击前后使用BS药物干预,可见IPEC-J2虽然部分细胞出现成团现象,但仍处于单层生长和紧密排列状态,细胞的生长状态明显好于攻毒不给药组。

A.空白组IPEC-J2生长状态(100×);B. PoRV作用24 h后IPEC-J2生长状态(100×);C. 预防组IPEC-J2,其中用药浓度为10 μmol·L-1,作用时间12 h (100×);D. 治疗组IPEC-J2,其中用药浓度为10 μmol·L-1,作用时间12 h (100×)A.The growth state of IPEC-J2 in the blank group (100×); B. The growth state of IPEC-J2 treated by PoRV after 24 hours (100×); C. The growth state of IPEC-J2 in the prevention group, in which the concentration of the drug was 10 μmol·L-1 and the time was 12 h (100×); D. The growth state of IPEC-J2 in the treatment group, in which the concentration of the drug was 10 μmol·L-1 and the time was 12 h (100×)图1 不同处理对IPEC-J2生长状态的影响Fig.1 The effection of different treatments on growth state of IPEC-J2
2.2 荧光定量标准曲线的构建
2.2.1 总RNA提取情况 通过2.0%琼脂糖凝胶电泳法检测,提取的总RNA完整性良好。检测样品的OD260nm/OD280nm值在1.8~2.0之间,RNA纯度较高,适合后续试验。
2.2.2 重组质粒的鉴定 把提取的质粒DNA做为模板,采用PCR进行扩增,用琼脂糖凝胶电泳鉴定重组质粒上的目的基因,结果为阳性,结果见图2;将阳性菌液序列测定结果与GenBank中登录的各目的基因序列进行比较,相似性均为100%,说明扩增片段为各目的基因的特异片段,可进行后续试验。
2.2.3 基因扩增动力学曲线 构建各基因标准曲线,进行三次生物学重复,重复性较好。各基因的扩增效率均在95%~105%,线性回归系数均大于0.99,表明在一定范围内,起始模板与Ct值之间呈良好的线性关系,反映了目的产物的扩增效率较好。熔解曲线峰值单一,表明在扩增过程中,无引物二聚体和其他非特异性产物扩增,引物具有很好的特异性,说明结果准确可靠。
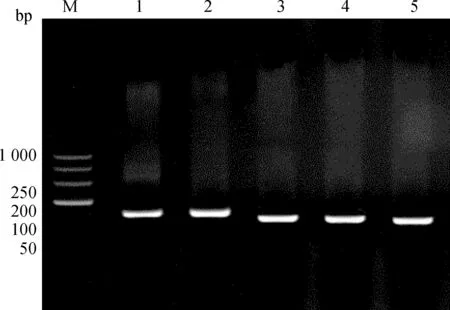
M. DL1000 DNA相对分子质量标准;1. IGF1基因PCR产物; 2. EGFR基因PCR产物; 3. EGF基因PCR产物; 4. TGF-β1 基因PCR产物; 5. β-actin基因PCR产物M. DL1000 DNA marker;1. PCR product of IGF1 gene; 2. PCR product of EGFR gene; 3. PCR product of EGF gene; 4. PCR product of TGF-β1 gene; 5. PCR product of β-actin gene图2 目的基因的PCR扩增产物Fig.2 PCR product of target gene
2.3 不同处理组细胞基因的转录量
从表2可见,BS对TGF-β1mRNA表达具有促进作用,5 μmol·L-1的BS无论攻毒前后用药,TGF-β1mRNA表达比对照组显著升高(P<0.05);10 μmol·L-1的BS能够极显著升高TGF-β1mRNA的表达(P<0.01)。
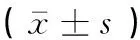
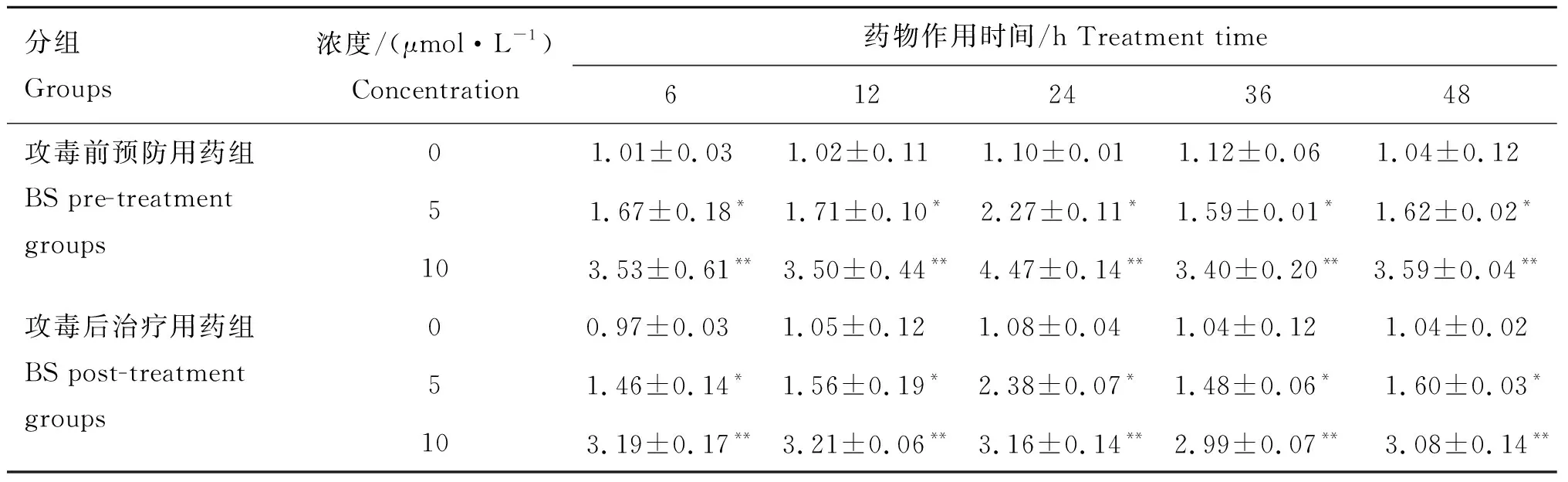
分组Groups浓度/(μmol·L-1)Concentration药物作用时间/h Treatment time612243648攻毒前预防用药组BS pre-treatment groups01.01±0.03 1.02±0.11 1.10±0.01 1.12±0.06 1.04±0.12 51.67±0.18*1.71±0.10*2.27±0.11*1.59±0.01*1.62±0.02*103.53±0.61**3.50±0.44**4.47±0.14**3.40±0.20**3.59±0.04**攻毒后治疗用药组BS post-treatment groups00.97±0.03 1.05±0.12 1.08±0.04 1.04±0.12 1.04±0.0251.46±0.14*1.56±0.19*2.38±0.07*1.48±0.06*1.60±0.03*103.19±0.17**3.21±0.06**3.16±0.14**2.99±0.07**3.08±0.14**
与对照组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下表同
Compared with control group,* means difference between the treatments (P<0.05),** means significant difference between the treatments (P<0.01). The same as below
由表3可知,BS对EGFRmRNA表达具有促进作用,6和12 h时,预防用药组和治疗用药组较各对照组EGFRmRNA的表达有不同程度的升高,差异显著(P<0.05)或极显著(P<0.01)。其中预防用药时间12 h,浓度为5、10 μmol·L-1,以及治疗用药6 h,浓度为10 μmol·L-1时,EGFRmRNA的表达较各对照组极显著升高(P<0.01);用药时间6 h,预防用药浓度为10 μmol·L-1和治疗用药浓度为5 μmol·L-1,以及用药时间12 h,治疗用药浓度为10 μmol·L-1时,EGFRmRNA的表达较各对照组显著升高(P<0.05)。药物处理24、36和48 h组,组间差异不显著。
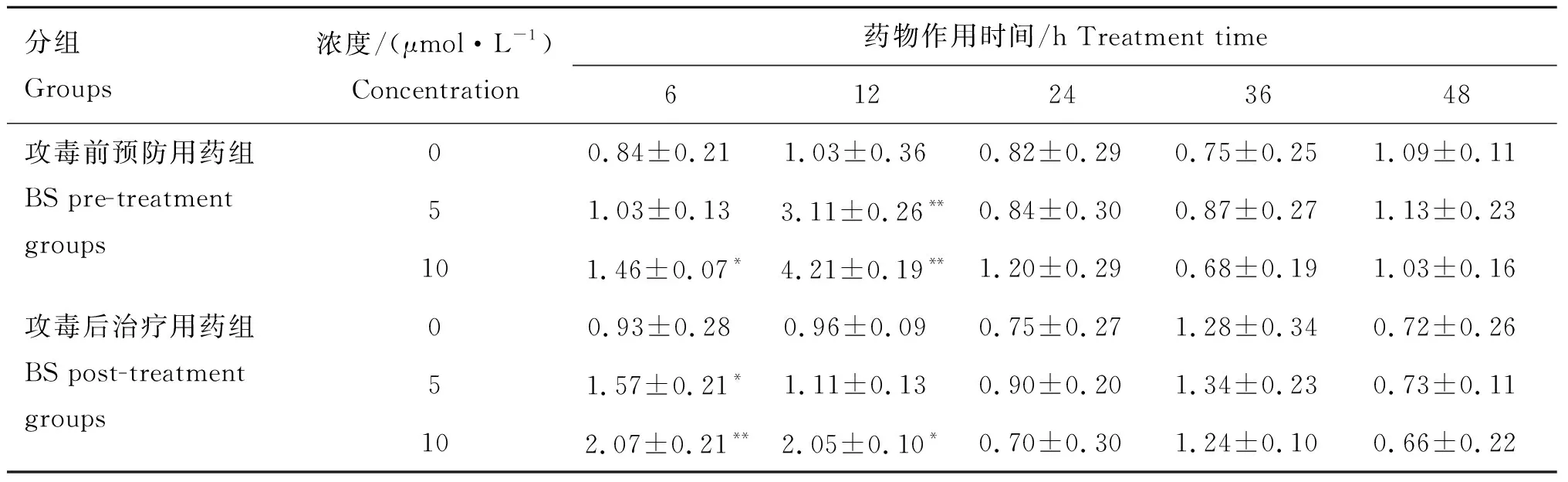
分组Groups浓度/(μmol·L-1)Concentration药物作用时间/h Treatment time612243648攻毒前预防用药组BS pre-treatment groups00.84±0.21 1.03±0.36 0.82±0.29 0.75±0.25 1.09±0.11 51.03±0.13 3.11±0.26**0.84±0.30 0.87±0.27 1.13±0.23 101.46±0.07* 4.21±0.19**1.20±0.29 0.68±0.19 1.03±0.16 攻毒后治疗用药组BS post-treatment groups00.93±0.28 0.96±0.09 0.75±0.27 1.28±0.34 0.72±0.26 51.57±0.21* 1.11±0.13 0.90±0.20 1.34±0.23 0.73±0.11 102.07±0.21**2.05±0.10* 0.70±0.30 1.24±0.10 0.66±0.22
由表4可知,BS对EGFmRNA表达具有抑制作用,6、12和24 h时,预防用药组和治疗用药组较各对照组EGFmRNA的表达不同程度的降低,差异显著(P<0.05)或差异极显著(P<0.01)。其中预防用药时间12 h,用药浓度为5和10 μmol·L-1时,EGFmRNA的表达较对照组极显著减少(P<0.01);其中预防用药时间6 h,用药浓度为10 μmol·L-1,治疗用药时间12 h,用药浓度为5和10 μmol·L-1,以及治疗用药时间24 h,用药浓度为10 μmol·L-1时,EGFmRNA的表达较各对照组显著(P<0.05) 减少。其他药物处理组,组间差异不显著。
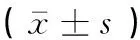
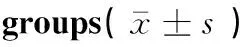
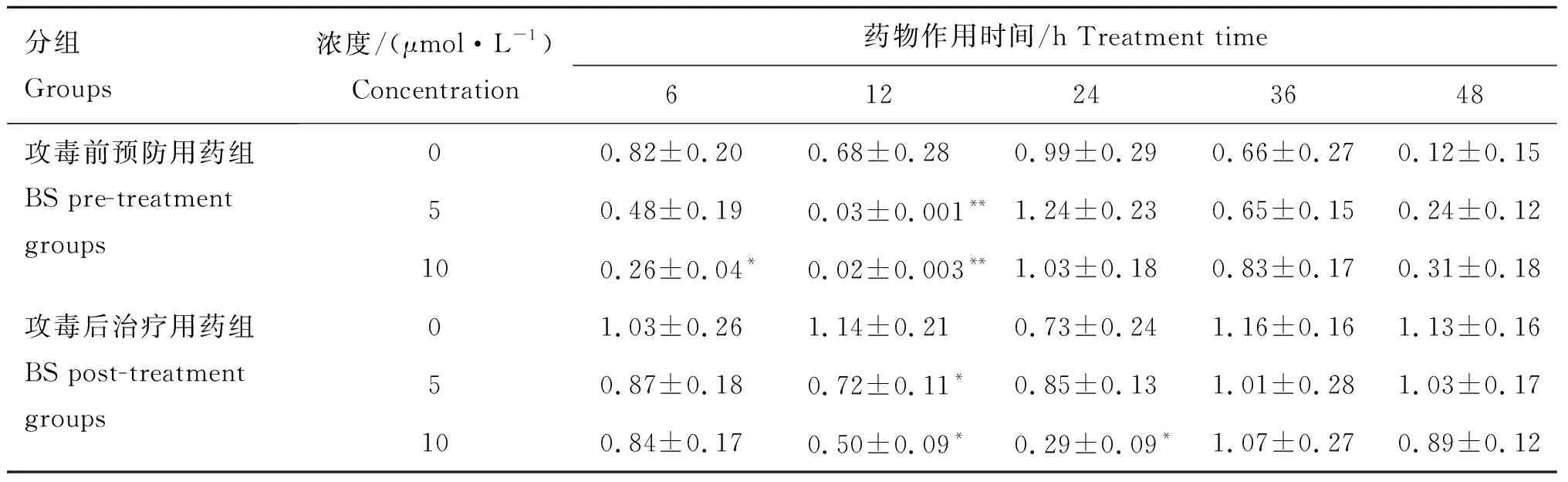
分组Groups浓度/(μmol·L-1)Concentration药物作用时间/h Treatment time612243648攻毒前预防用药组BS pre-treatment groups攻毒后治疗用药组BS post-treatment groups00.82±0.200.68±0.280.99±0.290.66±0.270.12±0.1550.48±0.190.03±0.001**1.24±0.230.65±0.150.24±0.12100.26±0.04*0.02±0.003**1.03±0.180.83±0.170.31±0.1801.03±0.261.14±0.210.73±0.241.16±0.161.13±0.1650.87±0.180.72±0.11*0.85±0.131.01±0.281.03±0.17100.84±0.170.50±0.09*0.29±0.09*1.07±0.270.89±0.12
由表5可知,BS对IGF1mRNA表达具有抑制作用,预防用药12 h,用药浓度为5和10 μmol·L-1时,IGF1mRNA的表达较对照组极显著降低(P<0.01);预防用药时间6 h和治疗用药时间24 h,用药浓度为5和10 μmol·L-1,以及治疗用药时间36 h, 浓度为10 μmol·L-1,IGF1mRNA的表达较对照组显著(P<0.05) 降低。其他药物处理组,组间差异不显著。
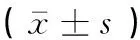
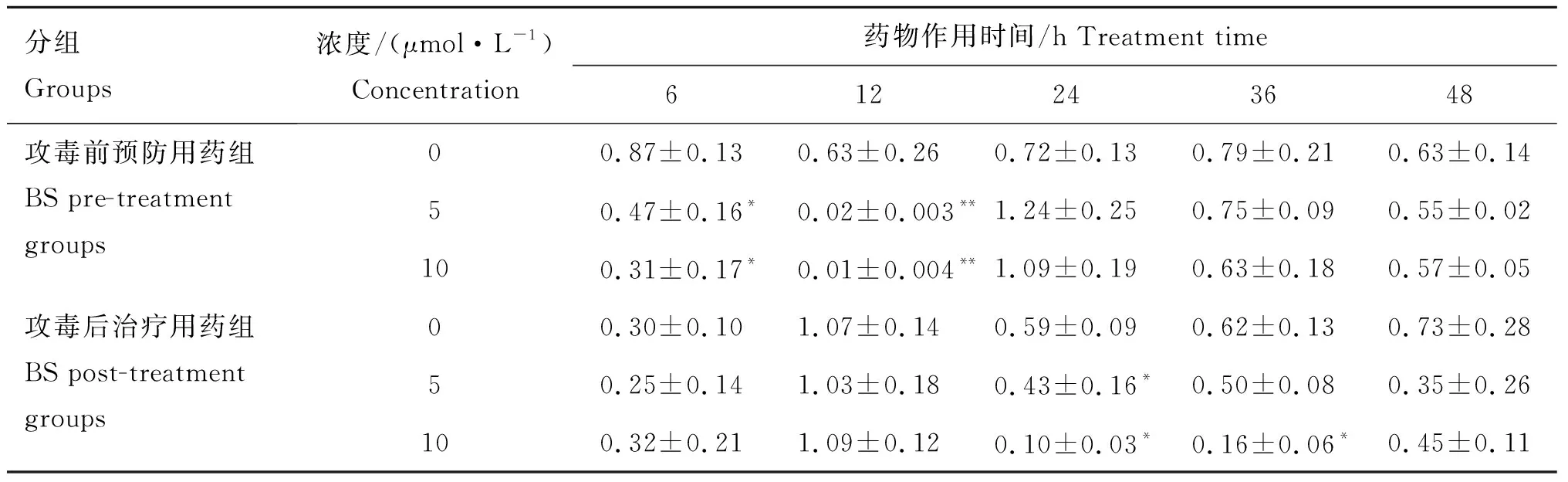
分组Groups浓度/(μmol·L-1)Concentration药物作用时间/h Treatment time612243648攻毒前预防用药组BS pre-treatment groups攻毒后治疗用药组BS post-treatment groups00.87±0.130.63±0.260.72±0.130.79±0.210.63±0.1450.47±0.16*0.02±0.003**1.24±0.250.75±0.090.55±0.02100.31±0.17*0.01±0.004**1.09±0.190.63±0.180.57±0.0500.30±0.101.07±0.140.59±0.090.62±0.130.73±0.2850.25±0.141.03±0.180.43±0.16*0.50±0.080.35±0.26100.32±0.211.09±0.120.10±0.03*0.16±0.06*0.45±0.11
3 讨 论
腹泻是困扰养猪业的主要疾病。猪轮状病毒感染引起腹泻是由于小肠黏膜的损伤,新生的上皮细胞功能低下,肠吸收不良,造成肠腔渗透压升高,从而导致腹泻[14-16]。肠道黏膜损伤后的黏膜修复对腹泻仔猪的转归至关重要。本试验选定与肠黏膜损伤后修复密切相关的细胞因子TGF-β1、EGFR、EGF和IGF1作为研究对象,以揭示硫酸小檗碱防治腹泻的作用机制是否与调控肠道修复因子的表达有关,对仔猪腹泻的病理生理机制研究及其防治意义重大。
TGF-β1是一类具有多种功能的生长因子,在细胞生长、分化、炎症反应以及细胞凋亡等过程的调控中发挥极为重要的作用[17]。张志杨[18]发现溃疡性结肠炎(UC)患者TGF-β1表达有显著增强趋势,且和UC患者严重程度相关。林源等[19]发现,胃溃疡(肝郁脾虚证)患者经健胃愈疡颗粒剂治疗后,TGF-β1及其mRNA表达增强,说明健胃愈疡颗粒剂能通过促进胃黏膜TGF-β1等促溃疡愈合因子的表达来加速溃疡的愈合。本试验结果显示硫酸小檗碱攻毒前或后给药都能明显改善IPEC-J2生长状态,对IPEC-J2具有良好保护作用。同时BS剂量依赖性增强TGF-β1的表达,表明BS可能通过调节肠黏膜细胞TGF-β1mRNA的表达达到保护和促进黏膜修复,进而实现对腹泻的防治作用。
EGFR属于跨膜受体酪氨酸蛋白激酶家族,是TGF和EGF的通用受体[20],EGFR在正常机体胃肠黏膜的上皮细胞分泌较少,损伤时可见EGFR分布区的表达明显增加[21]。对胃黏膜的保护及其损伤的修复有重要作用[22]。本试验结果显示损伤的IPEC-J2经硫酸小檗碱处理后,EGFRmRNA表达显著增强,同时配体TGF-β1表达显著增强,共同促进IPEC-J2生长和黏膜修复。说明硫酸小檗碱可能通过调节肠道上皮细胞EGFR的表达进而促进损伤愈合。
EGF是一个很强的促细胞分裂因子,能增强胃黏膜细胞抵抗胃酸的侵蚀能力,在保护胃黏膜免受损伤因子破坏[23],维持胃黏膜完整性方面起着非常重要的作用。顾玲[24]发现胆胃宁颗粒通过提高EGF的含量,促进上皮细胞增生,增强胃黏膜防御功能,从而促进胃溃疡的愈合。本试验发现损伤IPEC-J2经硫酸小檗碱处理后,EGFmRNA表达与对照组相比显著降低,由于TGF与EGFR结合竞争力更强,TGF-β1显著表达可能导致EGF表达抑制,也可能由于EGF与EGFR表达具有反向调控作用[25]。BS促进EGFR表达同时反向抑制了EGF的表达,实现EGFR与TGF-β1协同表达增强对肠黏膜上皮细胞保护和促进修复作用。
IGF1是含有70个氨基酸的碱性多肽,是一类广谱性的促生长因子。研究表明IGF1与胚胎分化、个体发育密切相关,参与糖、脂肪和蛋白质代谢,可刺激细胞代谢,与其他生长因子协同,刺激肠道细胞的增殖[26-27]。一些研究表明,通过口服可以刺激新生动物胃肠道组织的生长和功能的成熟[28]。仔猪可通过添加外源生长因子加强肠道的生长和发育[29]。本试验观察到IPEC-J2损伤后利用BS治疗过程中出现IGF1mRNA的表达显著降低,说明硫酸小檗碱对IGF1表达具有抑制作用,具体机制还需要进一步研究。
本研究采用SYBR Green Ⅰ荧光定量PCR的检测方法,通过构建目的基因TGF-β1、EGFR、EGF、IGF1与内参基因β-actin的标准曲线对各基因扩增效率进行检测[30]。结果表明:在不同的稀释条件下,各目的基因稀释倍数的对数值与其Ct值之间呈线性关系,经过PCR反应体系的优化[31],本试验各基因对应的标准曲线斜率均在-3.6~-3.0,此时得到的标准曲线可靠性较高;各基因的扩增效率均在95%~105%,说明引物设计合理,线性关系好,标准品梯度稀释恰当;当样本稀释到105时,仍能够检测到扩增产物,提示该方法有良好的灵敏度。各目的基因和内参基因相关系数R2均大于0.99,表明在一定范围内,起始模板与Ct值之间呈良好的线性关系,反映目的产物的扩增效率较好。熔解曲线峰值单一,表明在扩增过程中,无引物二聚体和其他非特异性产物扩增,引物具有很好的特异性,说明结果准确可靠[32],为后续试验奠定良好基础。
4 结 论
本研究通过PoRV感染IPEC-J2建立试验模型,分攻毒前后使用BS进行干预,对黏膜修复因子基因表达情况进行分析。PoRV能够显著引起IPEC-J2变性和坏死脱落,用BS药物组的IPEC-J2则生长基本良好。BS有促进病毒损伤IPEC-J2中TGF-β1和EGFRmRNA表达,抑制EGF和IGF1mRNA表达的作用。预防组和治疗组比较,预防组在时间上表现更提前。在肠黏膜细胞损伤修复过程中,各细胞因子发挥的作用以及作用时间存在差异。提示,中药提取物BS可能通过调节损伤的肠黏膜上皮细胞修复因子的基因表达,进而调控肠道上皮细胞的转化和发育,对损伤的肠道黏膜起到保护和修复功能。

