IL-9通过TGF-β/Smad通路诱导胃癌MKN-45细胞上皮-间充质转化
阮水良, 韩晨阳, 官俏兵, 杨 毅
(嘉兴市第二医院, 浙江 嘉兴 314001)
胃癌是中国人群常见的恶性肿瘤之一,近年来其发病率呈现上升趋势。慢性胃炎是胃癌发生的高危因素,使用常规的非甾体抗炎药和靶向干扰炎症的药物可以抑制胃癌的发生和发展[1]。白细胞介素9(interleukin-9, IL-9)是由辅助性T细胞Th9分泌的一种多功能的细胞因子,其与受体结合后促进信号转导,作用于炎症细胞和组织细胞,目前发现IL-9可以激发促炎因子并扩大炎症反应[2]。上皮-间充质转化(epithelial-mesenchymal transition,EMT)指的是由上皮到间质细胞的转化,在肿瘤中的研究发现,EMT的发生可以赋予肿瘤细胞极强的侵袭能力和转移能力,是肿瘤转移不可缺少的过程[3-4]。在胃癌的发生发展研究中发现,慢性胃炎及胃溃疡是胃癌发生的高危因素,而IL-9在胃炎的发生以及维持中具有重要的作用。虽然已经发现IL-9在胃癌中存在高表达,但是IL-9是否可以促进胃癌的发生和转移,尚未见明确的报道 ,鉴于IL-9在胃癌中的高表达,而人胃癌MKN-45细胞属于低分化高转移性的胃癌细胞,适合用于胃癌细胞侵袭的研究,因此本文主要研究IL-9促进胃癌细胞MKN-45转移的机制。
材 料 和 方 法
1 细胞和试剂
MKN-45细胞和RPMI-1640完全培养基(武汉普诺赛生命科技有限公司);重组人白细胞介素9(武汉艾美捷科技有限公司);CCK-8试剂盒(碧云天生物技术公司);抗E-cadherin、N-cadherin、波形蛋白(vimentin)、fibronectin、collagen I、Snail、Slug、转化生长因子β(transforming growth factor-β,TGF-β)、Smad3、Smad5抗体及HRP标记的 II 抗(Cell Signaling Technology);Transwell小室(北京萌壮科技有限公司);BCA蛋白定量试剂盒、RevertAid First Strand cDNA Synthesis Kit和SYBR Green SuperMix试剂盒(Thermo Fisher Scientific)。引物由大连宝生物技术公司合成。
2 方法
2.1实验分组 MKN-45细胞常规培养后分为对照组(control)和IL-9组,其中对照组不做任何处理,采用RPMI-1640完全培养基培养;IL-9组使用终浓度为100 ng/L的IL-9干预。
2.2CCK-8法检测细胞活力 取对数生长期的MKN-45细胞(1×107/L)于96孔板中培养,贴壁后进行分组,其中对照组使用RPMI-1640完全培养基培养,IL-9组使用终浓度为100 ng/L的IL-9的干预,设置空白对照,分别培养24 h、48 h和72 h后使用CCK-8试剂盒检测各组细胞的活力。
2.3Transwell法测定细胞侵袭能力 取对数生长期的细胞(1×109/L)加入Transwell小室,24孔板下室加入完全培养基,对照组常规培养,IL-9组上室用100 ng/L IL-9干预,常规培养24 h后,观察细胞贴壁情况,待完全贴壁后取出小室,弃去培养基,甲醇固定后用0.1%的结晶紫染色,棉签擦去上层未迁移的细胞后镜下观察。
2.4免疫荧光染色检测细胞中vimentin蛋白的表达 取1×1010/L的细胞接种于无菌玻璃盖破片上培养24 h。培养的细胞使用4%多聚甲醛室温固定15 min,之后使用100%冰甲醇于-20 ℃通透化10 min。将细胞置于5%牛血清白蛋白溶液中封闭1 h并加入相应的 I 抗于4 ℃孵育过夜。 I 抗处理后使用相应的 II 抗于室温下孵育2 h并利用荧光显微镜(×400)进行观察。
2.5Western blot法检测相应蛋白的表达水平 使用预冷的PBS清洗细胞3次,加入适量的细胞裂解液[20 mmol/L Tris (pH 7.4)、150 mmol/L NaCl、2 mmol/L EDTA、2 mmol/L EGTA、1 mmol/L sodium orthovanadate、50 mmol/L sodium fluoride、1% Triton X-100、0.1% SDS和100 mmol/L phenylmethylsulfonyl fluoride]于冰上裂解30 min。裂解后于4 ℃、12 000×g离心20 min并收集上清。蛋白电泳使用10% SDS-PAGE分离,之后将蛋白转印于PVDF膜上。转膜完成后,使用5%脱脂奶粉封闭1 h,然后分别加入 I 抗与 II 抗孵育后,显色。
2.6RT-qPCR检测相应mRNA的表达 取对数生长期的细胞,分为对照组和IL-9组,干预24 h后,弃去培养基,加入TRIzol试剂,裂解细胞后移入EP管,室温中放置2 min,加入三氯乙烷振荡后12 000×g在4 ℃离心15 min,弃去上清液后加入1 mL的75%乙醇,7 500×g4 ℃离心15 min,得到总RNA,按照逆转录试剂盒操作,逆转录成cDNA。取上述得到的1 μL cDNA为模板,按照试剂盒加入SYBR Green Mix,引物后进行qPCR检测,反应条件为: 94 ℃预变性15 min; 94 ℃变性20 s、56 ℃退火30 s、68 ℃延伸30 s,40个循环。以GAPDH为内参照,采用2-ΔΔCt法计算目的mRNA的相对表达量。相关引物序列见表1。
3 统计学处理
采用SPSS 13.0 软件包进行分析。实验数据以均数±标准差(mean±SD)表示,组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 IL-9对MKN-45细胞活力的影响
CCK-8法检测结果显示,干预24 h后对照组和IL-9组细胞存活率的差异无统计学显著性;48 h和72 h的结果显示,IL-9可以提高MKN-45细胞的存活率(P<0.05),见图 1。

表1 RT-qPCR用引物序列

Figure 1.The effect of IL-9 on the viability of the MKN-45 cells measured by CCK-8 assay. Mean±SD.n=5.*P<0.05,**P<0.01vscontrol group.
图1IL-9对MKN-45细胞存活率的影响
2 IL-9对MKN-45细胞侵袭能力的影响
Transwell实验结果示,当IL-9干预24 h后,IL-9组的细胞侵袭能力相比对照组显著增强,见图2。
3 IL-9对MKN-45细胞波形蛋白蛋白表达的影响
免疫荧光结果显示,未经过IL-9刺激时MKN-45细胞中的波形蛋白几乎不表达,而IL-9干预后vi-mentin表达显著增多,见图3。

Figure 2.The effect of IL-9 on the invasion ability of the MKN-45 cells detected by Transwell assay with crystal violet staining (×200). Mean±SD.*P<0.05vscontrol group.
图2Transwell法检测细胞侵袭能力的变化

Figure 3.The effect of IL-9 on the protein expression of vimentin in the MKN-45 cells observed by the method of immunofluorescence (×400). Mean±SD.n=3.*P<0.05vscontrol group.
图3免疫荧光法观察vimentin蛋白表达的变化
4 迁移运动细胞形态的变化
将细胞培养至70%~80%密度后进行划痕,继续培养24 h,镜下观察迁移运动的细胞形态的变化,对照组细胞为成规培养的圆形细胞,梭形变化不明显,而IL-9组的细胞呈现明显的梭形变化,见图4。
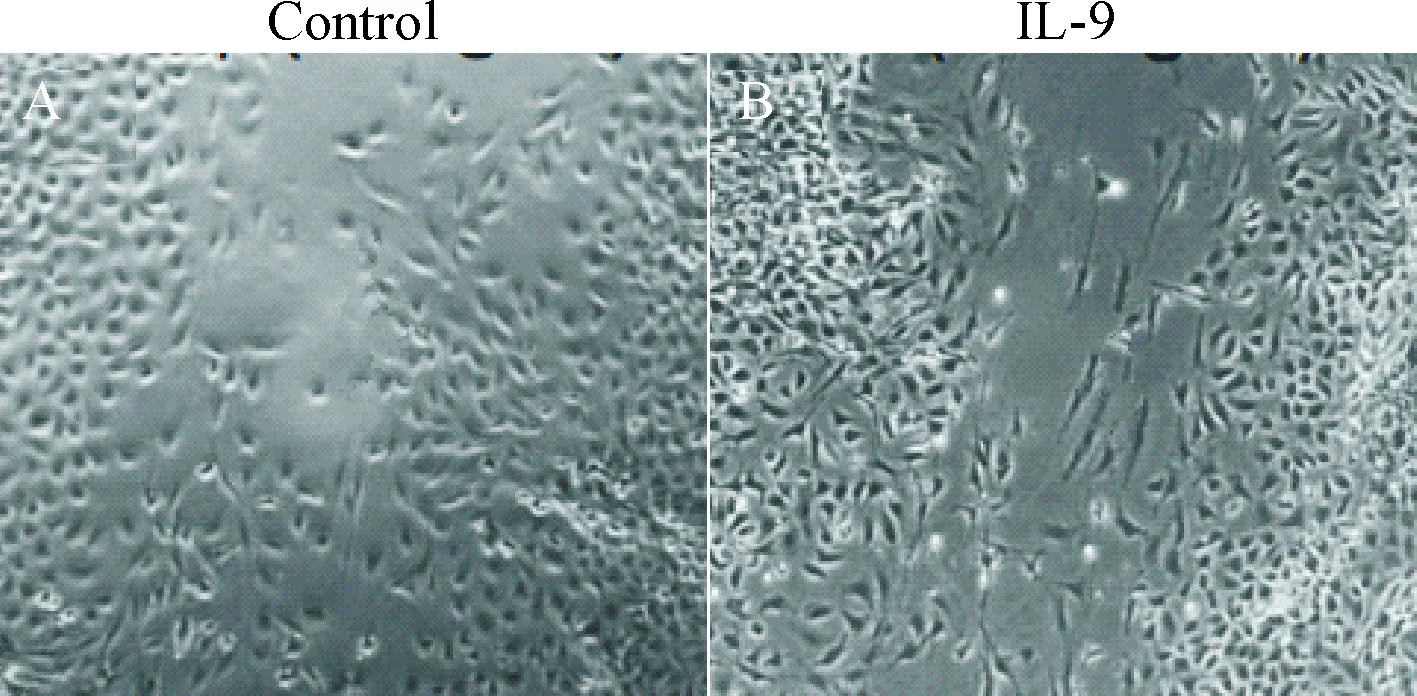
Figure 4.The morphological changes of the migrating MKN-45 cells treated with IL-9 (×400).
图4迁移运动的细胞形态的变化
5 Western blot检测EMT相关蛋白表达的变化
在IL-9干预24 h后,提取总蛋白进行蛋白定量检测,结果发现,与对照组比较,N-cadherin、fibronectin、collagen I和vimentin表达上调,E-cadherin表达下调(P<0.01),而核心转录因子Snail与Slug的表达上调(P<0.01),见图5、6。
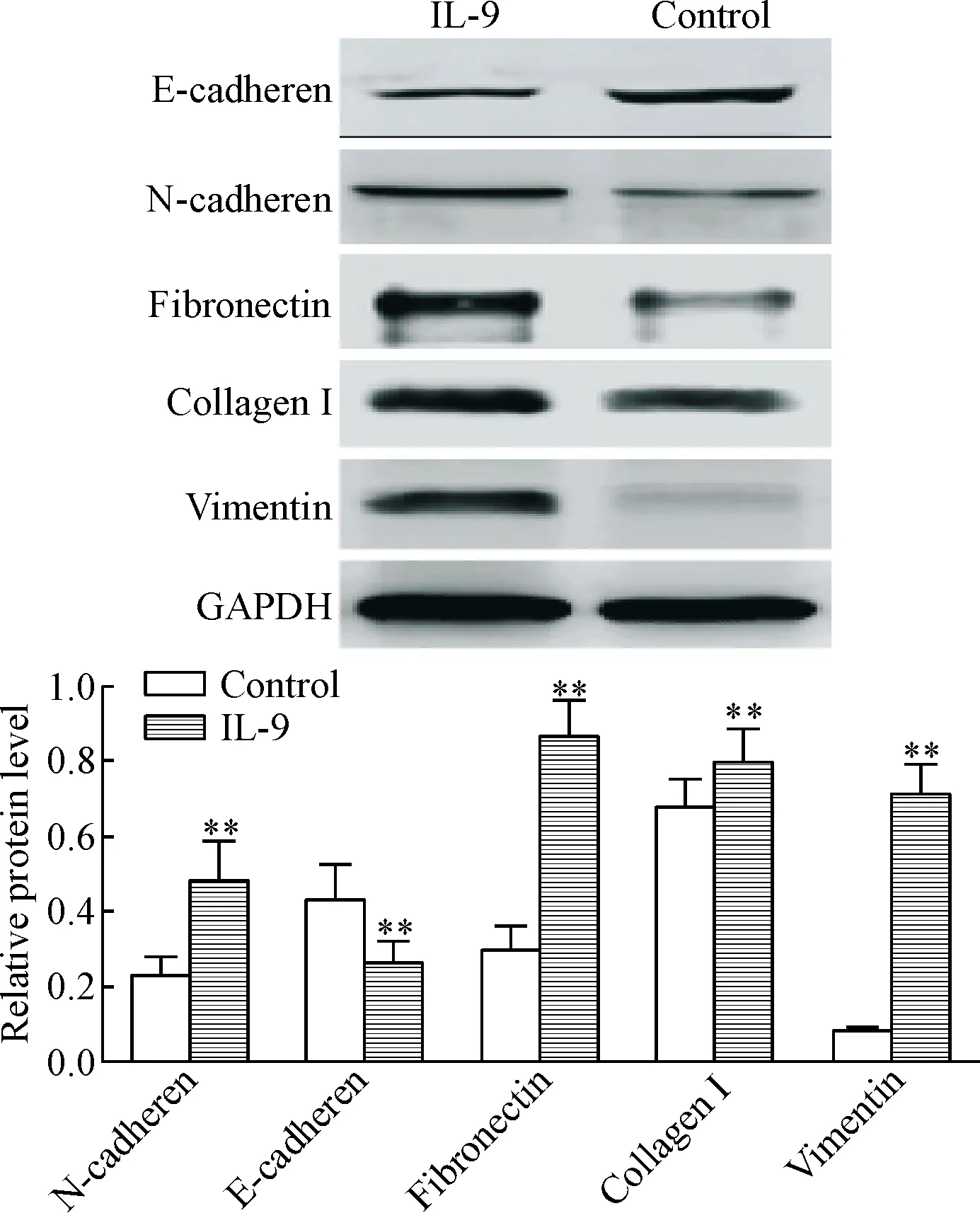
Figure 5.The effects of IL-9 on the expression of EMT-related proteins in the MKN-45 cells determined by Western blot. Mean±SD.n=5.**P<0.01vscontrol group.
图5Westernblot检测EMT相关蛋白的表达

Figure 6.The effects of IL-9 on the protein expression of key transcription factors Snail and Slug in the MKN-45 cells determined by Western blot. Mean±SD.n=3.**P<0.01vscontrol group.
图6Westernblot检测关键转录因子Snail与Slug表达的变化
6 Western blot检测TGF-β/Smad信号通路相关蛋白的表达
在IL-9干预24 h后,提取总蛋白进行蛋白定量检测,TGF-β及其下游的关键受体Smad3和Smad5的蛋白表达水平显著增高,与对照组比较差异具有统计学显著性(P<0.05),见图7。
7 EMT相关蛋白及TGF-β/Smad信号通路相关分子的mRNA表达
在IL-9作用下,MKN-45细胞的EMT关键分子N-cadherin、fibronectin、collagen I和vimentin的mRNA表达上调,E-cadherin的mRNA表达下调,与对照组比较差异具有统计学显著性(P<0.05),而核心转录因子Snail与Slug的mRNA表达上调,与对照组比较差异具有统计学显著性(P<0.01),TGF-β/Smad信号通路相关分子TGF-β及其下游的关键受体Smad3和Smad5的mRNA表达显著增高,与对照组比较差异具有统计学显著性(P<0.01),见图8。
讨 论
EMT是多细胞生物胚胎发生过程中的基础过程,在胚胎的早期较为多见,也存在于许多慢性病和肿瘤的发生过程中[5],它是上皮细胞间的黏附结构、极性以及细胞骨架的改变,许多证据证明它在肿瘤的转移和侵袭中有着重要的作用[6]。EMT发生的过程中细胞间的极性和紧密连接发生变化,与相邻细胞的分离,迁移到邻近的组织,其中主要的分子特征是钙黏蛋白的变化,例如E-cadherin、角质蛋白的表达下降[7],N-cadherin和vimentin的表达上调等[8-9]。一旦肿瘤发生了转移,在微环境的作用下,转化的细胞还可以再分化。钙黏素是一种依赖钙离子的细胞间黏连的糖蛋白分子,主要有E、P和N 3种,在EMT中E-cadherin的表达下调可以启动EMT的发生。有研究表明,E-cadherin的表达下调水平和肿瘤细胞的侵袭能力呈现正相关[7],而一些转录因子的表达也可以促进EMT的发生。目前研究表明Snail、Slug、ZEB1以及FOXC2等转录因子可以促进EMT的发生和发展[10-11],且这类转录因子可以促进细胞内ERK、Smad和PI3K等信号通路的传导促进EMT的发生,尤其是Snail和Slug的表达可以抑制E-cadherin的表达和紧密连接蛋白的表达。
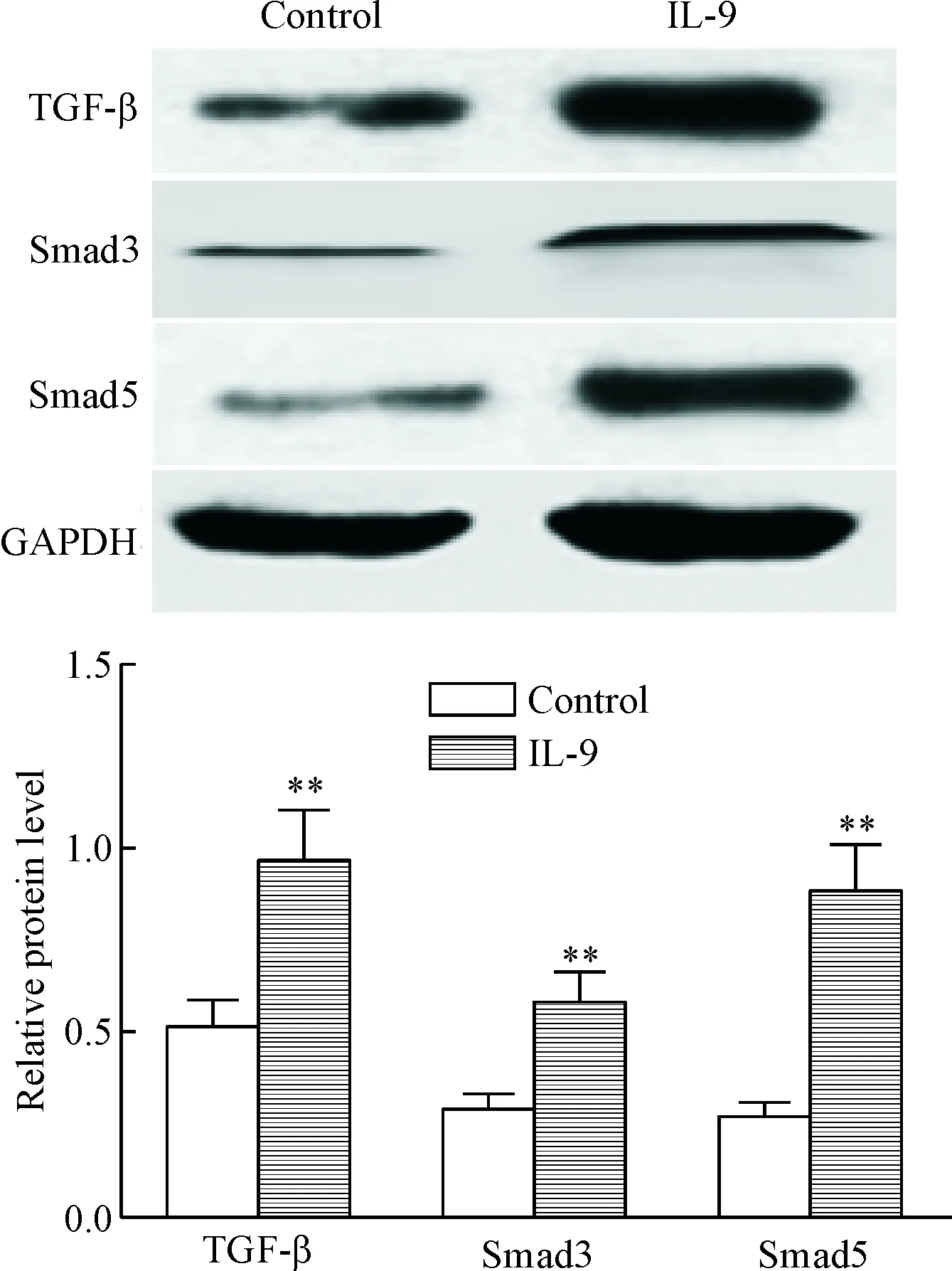
Figure 7.The effects of IL-9 on the protein expression of TGF-β/Smad signaling pathway-related molecules in the MKN-45 cells determined by Western blot. Mean±SD.n=3.**P<0.01vscontrol group.
图7Westernblot检测TGF-β/Smad信号通路相关蛋白表达的变化
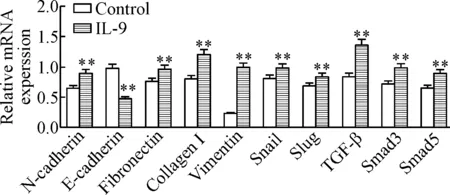
Figure 8.The effects of IL-9 on the mRNA expression of EMT factors and TGF-β/Smad signaling molecules in the MKN-45 cells detected by RT-qPCR. Mean±SD.n=3.**P<0.01vscontrol group.
图8RT-qPCR检测EMT关键因子及TGF-β/Smad信号相关分子的mRNA表达
生长因子可以诱导EMT的发生,例如HGF、EGF、TGF和PDGF等,尤其是TGF信号可以和膜表面的受体结合通过细胞内信号的传导,活化不同的转录因子。体外实验证明TGF-β可以诱导肿瘤细胞EMT的发生促进其转移[12],Smad作为TGF-β下游重要的受体,在研究中发现Smad3的敲除可以抑制EMT的发生,主要原因是因为Smad3的传导可以激活Snail的表达[12],这一点在乳腺癌细胞MCF7中得到了证实。目前认为TGF-β介导的EMT主要由Smad3完成,但是也有实验证明Smad5也可以补给Smad3信号,当Smad3通路受阻碍时,Smad5可以介导下游信号[14]。
目前在胃癌的发生中,大量的实验证明慢性炎症以及幽门螺杆菌感染是胃癌发生发展的重要因素[15],而IL-9作为Th9细胞分泌的关键炎症因子,在慢性结肠炎和胃炎发生中已经得到了证实[16],也有证据表明IL-9在胃癌患者组织中存在高表达[17],表明IL-9的高表达可能不仅仅与慢性炎症有关还可以与胃癌的发生发展有关,在以往的研究中发现TGF-β-Smad信号与Th9细胞及其分泌的细胞因子IL-9具有相关性。TGF-β主要激活naive T细胞中Foxp3的表达并诱导Th9细胞产生,Th9细胞产生的IL-9可以与Smad信号中IL-9位点结合,进一步激活下游信号[18-19]。TGF-β激活smad3和Notch蛋白胞内信号、促进重组信号连接蛋白RBP-J与IL-9位点的结合,IL-9与TGF-β信号也存在反馈性调节,高表达IL-9的同时可以激活Smad3,从而进一步促进IL-9与IL-9位点的结合[20]。从本研究的结果来看,MKN-49细胞经过IL-9干预后侵袭能力明显提高,且细胞形态由圆形向梭形转化,这提示可能存在EMT的过程,其中EMT关键的钙黏蛋白以及纤维连接蛋白的表达下降,进一步说明了细胞黏附能力的下降,EMT的核心转录因子Snail与Slug的表达上调,结合上述的结果可以说明IL-9的高表达确实促进了EMT的发生。在机制的研究中我们发现,IL-9干预后促进了TGF-β/Smad信号的激活,值得注意的是Smad3和Smad5同时高表达,说明不仅存在Smad3这一条主要的通路,Smad5旁路也被激活,这可能是由于高表达的IL-9激活了Smad3和Smad5中的IL-9位点,促进了IL-9的结合,而TGFβ信号上下游蛋白的激活,进一步促进了EMT的发生。所以我们有理由相信IL-9促进MKN-45细胞的EMT发生是与TGF-β/Smad信号密切相关的
综上所述,本研究发现IL-9的高表达可能促进了胃癌细胞EMT,增强了胃癌细胞的侵袭能力,所以IL-9不仅仅在炎症反应中有作用,在胃癌中同样有着重大的作用。这一发现可以为胃癌的研究提供新的思路。

