抑制Mcl-1表达调控结核感染的小鼠腹腔巨噬细胞凋亡的机制初探*
王新敏, 王小芳, 卢 洋, 杨 菩, 韩 玲, 王英姿, 张万江, 章 乐△
(石河子大学医学院 1第一附属医院泌尿外科, 2病理生理学教研室, 新疆 石河子 832002)
髓细胞白血病基因1(myeloid cell leukemia-1,Mcl-1)编码的蛋白是Bcl-2蛋白家族成员,其主要作用是通过维持细胞线粒体膜的完整性、阻止细胞色素C的释放及抑制caspase酶和DNA降解酶的激活进而促进细胞存活、抑制细胞凋亡[1]。越来越多的证据表明,Mcl-1基因可能是结核病潜伏感染预防与控制的一个很有潜力的靶点。Sly等[2]早期研究发现,Mcl-1基因可以在结核分枝杆菌(Mycobacteriumtuberculosis, MTB)毒力株H37Rv感染的宿主巨噬细胞内高表达,同时抑制宿主巨噬细胞的凋亡,而当抑制Mcl-1的表达后,宿主巨噬细胞的凋亡水平显著上调并抑制了毒力株在宿主细胞内的存活[2]。前期研究也发现,下调Mcl-1的表达能增加结核杆菌感染的宿主巨噬细胞的凋亡,且在结核杆菌菌株毒力不同时凋亡率存在差异[3]。因此,本研究探讨了使用Mcl-1-shRNA质粒下调Mcl-1的表达在不同处理时间和不同毒力结核分枝杆菌感染时对小鼠腹腔巨噬细胞凋亡的调控机制,为结核病的防控提供更多的理论依据。
材 料 和 方 法
1 实验菌株和动物及质粒
实验所用BCG、结核分枝杆菌H37Ra和H37Rv由中国药物生物制品检定所提供并保存;新疆地区分离的流行的结核杆菌菌株XJ-MTB由实验室早期鉴定并保存。实验所用小鼠为 8 周龄SPF 级健康雌性BALB/c小鼠,体重(18±2) g,于石河子大学实验动物中心购买,许可证编号为SYXK(新)2016-0002。所有关于动物的研究及操作都是经过在实验前批准的动物伦理委员会(IAEC)的协议进行的。实验所用质粒是由上海吉凯基因公司构建的Mcl-1-shRNA真核表达质粒,经本实验室前期筛选设计[4],活化、扩增后保存备用。
2 主要试剂
10%胎牛血清购于Thermo;RPMI-1640和DMEM培养基购于HyClone;PCR引物的合成和质粒的筛选由上海生工生物工程有限公司完成;逆转录试剂盒由北京天根生物科技有限公司提供;鼠抗β-actin单克隆抗体购于北京中杉金桥生物技术有限公司;抗Bcl-2和Bax单克隆抗体购于CST;BCA蛋白浓度测定试剂盒购于Thermo。
3 方法
3.1实验分组 将实验小鼠分为BCG组、H37Ra组、H37Rv组、XJ-MTB组、Mcl-1-shRNA组、BCG+Mcl-1-shRNA组、H37Ra+Mcl-1-shRNA组、H37Rv+Mcl-1-shRNA组、XJ-MTB+Mcl-1-shRNA组和空白对照(control)组,同时将处理后时间设为1 d、3 d、5 d和7 d 4个时点,每组每个时点各设3只小鼠。Mcl-1-shRNA质粒的剂量为每只75 μg。
3.2结核分枝杆菌感染小鼠模型的构建 室温下,在生物安全柜内,用苏通培养液与生理盐水的混合物(0.5 mL;体积比为3∶1)稀释细菌,取100 μL细菌稀释液涂抹在改良罗氏培养基上。2~3周后,灭菌接种环取罗氏培养基上生长状态良好的结核分枝杆菌菌落,置于灭菌的磨菌器中,加入少量含有0.05% Tween-80的生理盐水充分研磨,使其成均匀浑浊的菌悬液。将细菌悬液按照麦氏比浊法的标准调整至1.0×1010CFU/L。将0.3 mL的菌悬液通过小鼠腹腔注射的方式注射到对应分组的小鼠体内[4]。将感染后的小鼠置于生物安全三级实验室内,IVC 笼具中饲养。在对应的时点将前期筛选并构建好的Mcl-1-shRNA[5]质粒采用水动力转染(hydrodynamic transfection)技术注入各组小鼠体内[6]。
3.3小鼠腹腔巨噬细胞的收集与提取 室温下,于上述不同的时点,将各组小鼠脱颈处死后,用75%乙醇消毒小鼠腹部皮肤,置于超净台中;用无菌的镊子将小鼠下腹部皮肤提起撕开后向小鼠腹腔中注入5 mL RPMI-1640培养基,反复按摩腹部约10 min,避开肠和脂肪,不同的方向反复抽吸数次并收集所有吸出的腹腔液,1 200 r/min离心5 min,弃上清,PBS液洗涤1次,用DMEM培养液(含10%胎牛血清)将细胞重悬;将收集处理好的细胞接种到6孔细胞培养板中,置于37 ℃、5% CO2培养箱中培养6 h,贴壁细胞即为小鼠腹腔巨噬细胞[7-8]。
3.4应用Annexin V-APC/7-AAD凋亡检测试剂盒检测小鼠巨噬细胞凋亡 将各组小鼠于上述不同时点提取并培养小鼠腹腔巨噬细胞。按照Annexin V-APC/7-AAD凋亡试剂盒的说明步骤进行操作,先将收集的巨噬细胞用冷的PBS 洗涤 2 次,再用预冷的1×Binding Buffer 重悬细胞,调整细胞数至 1×109/L,每管加入100 μL细胞悬液、5 μL 的Annexin V-APC和10 μL 7-AAD,混合后避光放置于冰上静置 30 min,最后每管加入 400 μL预冷的1×Binding Buffer,30 min 内上流式细胞仪检测各组小鼠腹腔巨噬细胞的凋亡率。
3.5Real-time PCR检测Bcl-2和Bax的mRNA表达 将收集提取的各组小鼠腹腔液放入离心机中,1 000 r/min离心5 min,弃上清,加入2 mL PBS重悬细胞,离心洗涤2次,吸取1 mL TRIzol,反复吹打裂解细胞,再将细胞悬液移入1.5 mL EP管内,提取细胞总RNA。将提取的总RNA在NanoDrop 2000紫外分光光度计测量260 nm和280 nm下RNA的吸光度并计算其浓度,然后通过电泳检测其质量。按照逆转录试剂盒的说明将其逆转录为cDNA。引物的设计与合成由上海生工完成。PCR反应条件为95 ℃ 为 5 min; 95 ℃ 10 s, 57 ℃ 30 s,40个循环。引物序列见表1。样本按照QuantiFast SYBR Green PCR Kit 试剂盒步骤扩增。以熔解曲线确定PCR扩增产物的特异性。以β-actin为内参照,用2-ΔΔCt法计算Bcl-2和Bax的mRNA相对表达量。

表1 Real-time PCR的引物序列
F: forward; R: reverse.
3.6Western blot检测Bcl-2和Bax蛋白的表达 于上述不同时点收集并提取小鼠腹腔巨噬细胞,然后用蛋白裂解液裂解对小鼠腹腔巨噬细胞进行裂解,继而分别提取各组细胞总蛋白,应用BCA 法对蛋白浓度进行测定及配平,10% SDS-PAGE 分离蛋白质,半干电转将蛋白转移到PVDF 膜上(23 V、40 min),室温封闭 2 h,分别与兔抗鼠Bcl-2(1∶10 000)和Bax(1∶20 000)多克隆抗体反应后,用辣根过氧化物酶标记的相应的II 抗孵育 1 h,ECL 法显色压片曝光,用凝胶成像仪分析系统对 Western blot 检测条带进行灰度值扫描,计算Bcl-2或Bax与β-actin吸光度比值,进行半定量统计学分析。
4 统计学处理
利用SPSS 17.0统计软件对实验结果进行分析处理。计量资料以均数±标准差(mean±SD)表示,实验所得数据资料进行单因素方差分析(one-way ANOVA),应用SNK-q检验进行两两比较;计数资料或计量资料不服从正态性且方差不齐时采用非参数检验。以P<0.05为差异有统计学意义。
结 果
1 Mcl-1-shRNA处理的宿主巨噬细胞的凋亡率与感染的MTB菌株毒力有关
结核分枝杆菌感染宿主巨噬细胞后,可以诱导和调控宿主巨噬细胞凋亡水平,且宿主巨噬细胞的凋亡水平因感染的结核杆菌菌株的毒力不同而有差异[9-10]。因此,本研究将Mcl-1-shRNA分别作用于经BCG、H37Ra、H37Rv和XJ-MTB感染的小鼠,用Annexin V-APC/7-AAD双参数法结合流式细胞术检测了不同时点各处理组小鼠腹腔巨噬细胞的凋亡水平。结果显示,与空白对照组相比,不同毒力结核分枝杆菌感染的小鼠腹腔巨噬细胞的凋亡水平在4个时点均显著增高(P<0.05);其中BCG和H37Ra的凋亡率高于其它菌株感染组。Mcl-1-shRNA质粒处理后,与未处理的结核杆菌感染组相比,小鼠腹腔巨噬细胞的凋亡率均呈现不同程度的增高,并于处理后的第5天增高最为显著(P<0.05)。H37Ra组和BCG组的凋亡水平高于XJ-MTB组和H37Rv组(P<0.05),其趋势为BCG组最高,H37Ra组次之,H37Rv和XJ-MTB组间差异无统计学显著性,但低于H37Ra组(P<0.05),说明小鼠巨噬细胞的凋亡水平与感染的结核分枝杆菌的毒力有关,见图1。
2 Mcl-1-shRNA处理显著减少了Bcl-2的mRNA和蛋白表达
将Mcl-1-shRNA分别作用于经不同毒力的结核分枝杆菌感染的小鼠后,real-time PCR和Western blot分别检测了不同时点各处理组提取的小鼠腹腔巨噬细胞中Bcl-2的mRNA和蛋白表达。Real-time PCR的结果显示,与空白对照组相比,不同毒力结核分枝杆菌感染的小鼠腹腔巨噬细胞中Bcl-2的mRNA表达水平均有不同程度的增加(P<0.05);应用Mcl-1-shRNA质粒处理后,各组小鼠腹腔巨噬细胞中Bcl-2的mRNA表达水平均有不同程度的降低(P<0.05),其中Bcl-2的表达在未感染组中降低最不明显,Mcl-1-shRNA质粒处理的H37Ra组和BCG组中Bcl-2的表达量最低,且低于XJ-MTB组和H37Rv组,但其下调趋势基本相同(P<0.05),见图2A。Western blot的结果显示,与空白对照组相比,不同毒力结核分枝杆菌感染的小鼠腹腔巨噬细胞中Bcl-2蛋白的表达水平均有不同程度的增高(P<0.05);应用Mcl-1-shRNA质粒处理后,各组小鼠腹腔巨噬细胞中Bcl-2的表达水平均有不同程度的降低(P<0.05),其中Bcl-2的表达在未感染组中降低最不明显,H37Ra组和BCG组中Bcl-2的下调趋势稍弱于XJ-MTB组和H37Rv组(P<0.05),见图2B。
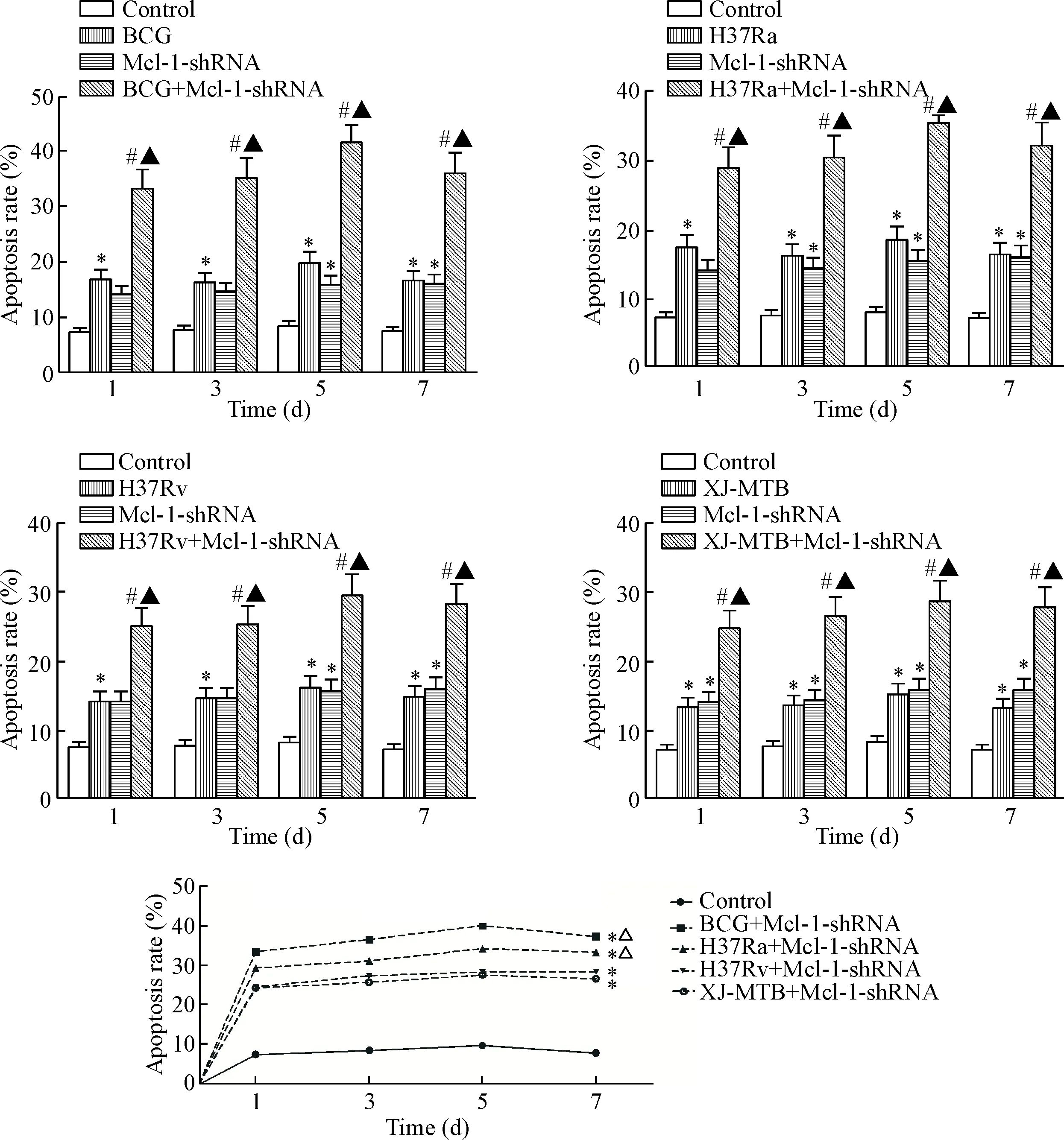
Figure 1.The effect of Mcl-1-shRNA on the apoptotic rate of mouse peritoneal macrophages infected with different virulence of MTB strains for 1 d, 3 d, 5 d and 7 d. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsBCG, H37Ra, H37Rv or XJ-MTB group;▲P<0.05vsMcl-1-shRNA group;△P<0.05vsH37Rv+Mcl-shRNA or XJ-MTB+Mcl-shRNA group.
图1Mcl-1-shRNA处理对经不同毒力的结核杆菌菌株感染的小鼠腹腔巨噬细胞凋亡率的影响
3 Mcl-1-shRNA处理显著增加了Bax的mRNA和蛋白的表达
将Mcl-1-shRNA质粒分别作用于经不同毒力的结核分枝杆菌感染的小鼠后,real-time PCR和Wes-tern blot检测不同时点各处理组提取的小鼠腹腔巨噬细胞中Bax的mRNA表达。Real-time PCR结果显示,与空白对照组相比,不同毒力结核分枝杆菌感染的小鼠腹腔巨噬细胞中Bax的mRNA表达水平均有不同程度的增高(P<0.05);应用Mcl-1-shRNA质粒处理后,各组小鼠腹腔巨噬细胞中Bax的mRNA表达水平均有不同程度的升高(P<0.05),其中H37Ra组和BCG组中Bax的上升趋势较XJ-MTB组和H37Rv组稍强,见图3A。Western blot结果显示,与空白对照组相比,不同毒力结核分枝杆菌感染的小鼠腹腔巨噬细胞中Bax蛋白的表达水平均有不同程度的增高(P<0.05);应用Mcl-1-shRNA质粒处理后,各组小鼠腹腔巨噬细胞中Bax的表达水平均有不同程度的升高,差异具有统计学意义(P<0.05),其中H37Ra组和BCG组中Bax的上升趋势较XJ-MTB组和H37Rv组稍强,见图3B。
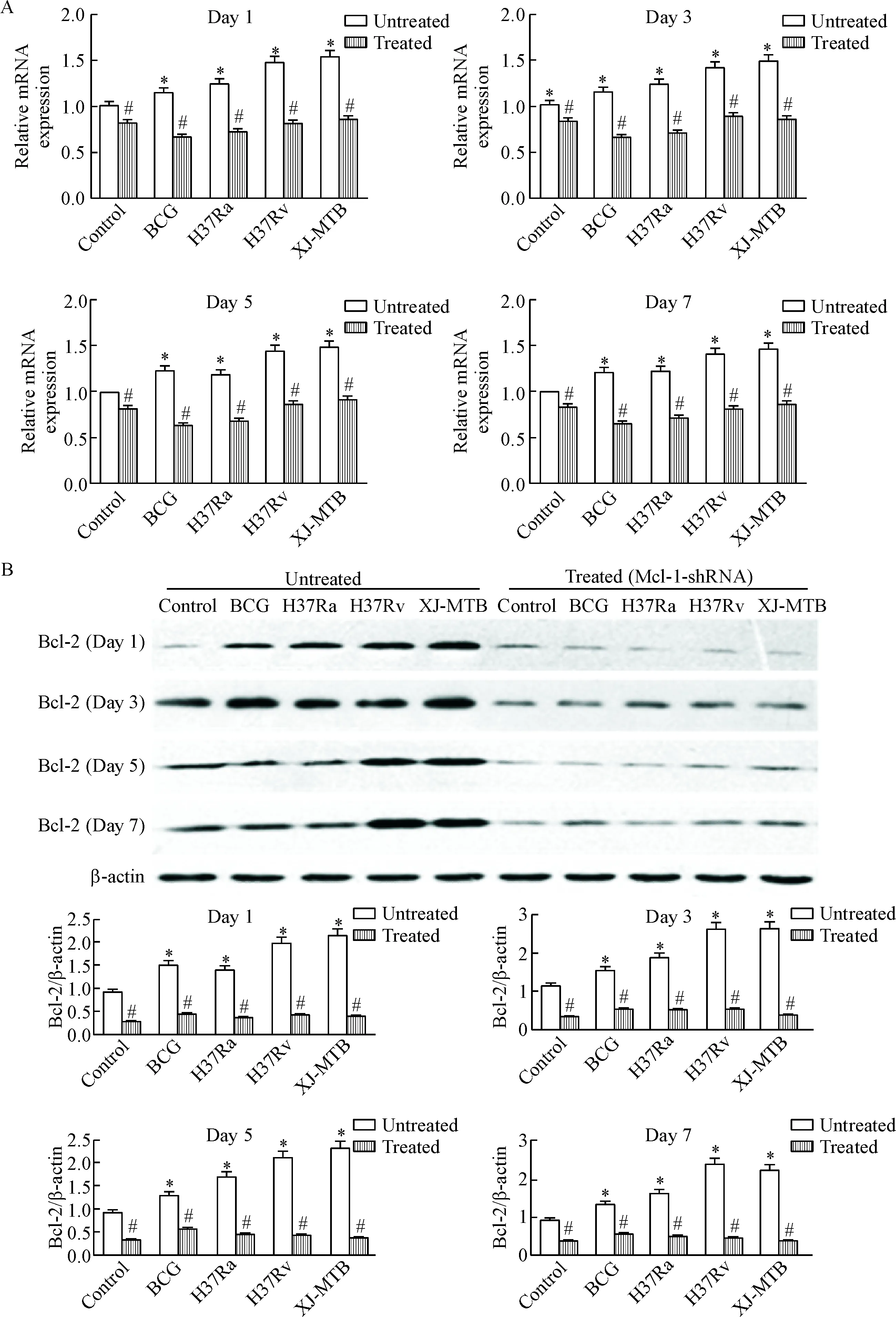
Figure 2.The effects of Mcl-1-shRNA on the expression of Bcl-2 at mRNA and protein levels in the mouse peritoneal macrophages infected with different virulence of MTB strains determined by real-time PCR and Western blot. A: the mRNA expression of Bcl-2; B: the protein expression of Bcl-2. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsuntreated group.
图2Real-timePCR和Westernblot法检测Mcl-1-shRNA处理对经不同毒力结核杆菌菌株感染的小鼠腹腔巨噬细胞中Bcl-2表达的影响

Figure 3.The effects of Mcl-1-shRNA on the expression of Bax at mRNA and protein levels in the mouse peritoneal macrophages infected with different virulence of MTB strains determined by real-time PCR and Western blot. A: the mRNA expression of Bax; B: the protein expression of Bax. Mean±SD.n=3.*P<0.05vsuntreated group;#P<0.05vsuntreated group.
图3Real-timePCR和Westernblot检测Mcl-1-shRNA处理对经不同毒力结核杆菌菌株感染的小鼠腹腔巨噬细胞中Bax表达的影响
4 Bcl-2/Bax比值在结核感染的巨噬细胞中的变化
研究发现,细胞的存亡与Bcl-2/Bax比值密切相关[11]。因此,因此我们检测了Mcl-1-shRNA质粒对不同毒力的结核分枝杆菌感染的小鼠腹腔巨噬细胞中Bcl-2/Bax mRNA和蛋白比值的影响。Bcl-2/Bax mRNA的比值在Mcl-1-shRNA质粒处理后随着时间的延长而逐渐增加,其中H37Rv和XJ-MTB组稍高于BCG和H37Ra组(P<0.05),而H37Rv组与XJ-MTB组相比差异无统计学显著性,见图4A。Bcl-2/Bax蛋白的比值在Mcl-1-shRNA处理后随时间的延长先减少再增加,各组比值之间的差异无统计学显著性,见图4B。
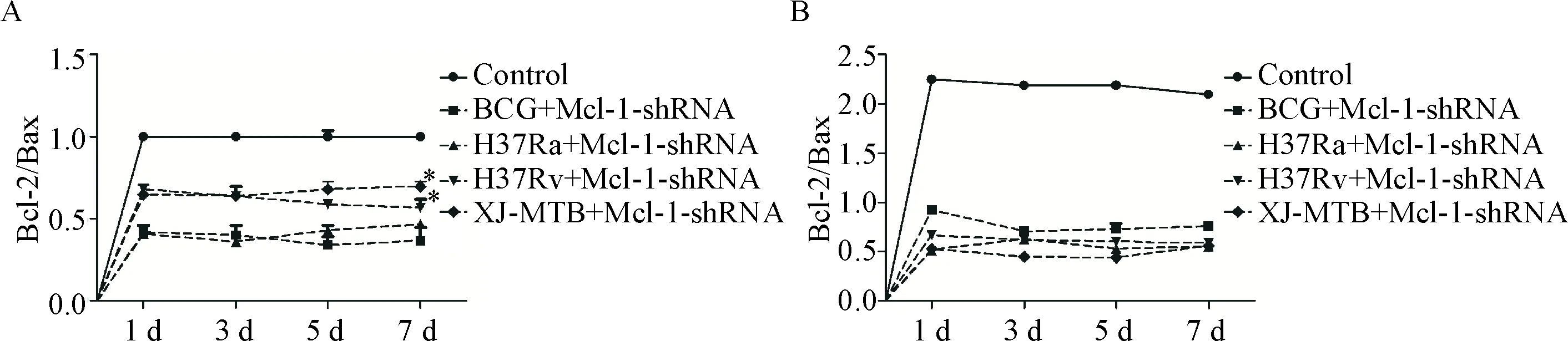
Figure 4.The effects of Mcl-1-shRNA on the Bcl-2/Bax ratio at mRNA and protein levels in the mouse peritoneal macrophages infected with different virulence of MTB strains determined by real-time PCR and Western blot. A: the Bcl-2/Bax ratio at mRNA level; B: the Bcl-2/Bax ratio at protein level. Mean±SD.n=3.*P<0.05vsBCG+Mcl-1-shRNA or H37Ra+Mcl-1-shRNA group.
图4Real-timePCR和Westernblot检测Mcl-1-shRNA处理对经不同毒力结核杆菌菌株感染的小鼠腹腔巨噬细胞中Bcl-2/Bax比值的影响
讨 论
细胞凋亡和程序性细胞死亡是指生物体为维持机体内环镜的稳定,细胞在一定的病理和生理条件下,由基因控制的、高度有序的并由一系列酶活动参与的细胞自主性死亡,它是一种高度保守的、被精确调节的被动过程[12]。结核分枝杆菌感染宿主巨噬细胞后,通过降低宿主巨噬细胞的凋亡率来逃避巨噬细胞的杀伤,且不同毒力的结核杆菌菌株通过调控宿主巨噬细胞的凋亡来逃避宿主巨噬细胞的杀伤[9-10]。在本研究中,流式细胞术的检测结果显示,不同毒力的结核分枝杆菌菌株感染小鼠巨噬细胞后,宿主巨噬细胞的凋亡率以弱毒力的BCG和H37Ra菌株高于强毒株H37Rv组。此结果与Balcewicz-Sablinska等[13]利用H37Rv和H37Ra在实验中分别来感染人肺泡巨噬细胞后H37Ra组凋亡率高,而H37Rv组巨噬细胞的凋亡率受到明显抑制的研究结果一致。除此之外,在处理后的第5天结核杆菌感染的宿主巨噬细胞的凋亡率最高,此结果也与本实验组前期研究结果吻合。我们推测出现这种结果的原因可能是:(1)结核分枝杆菌的某些菌体成分及其在巨噬细胞内的代谢活动可诱导巨噬细胞凋亡,促使巨噬细胞产生抗结核分枝杆菌感染的保护性免疫反应;(2)结核分枝杆菌毒力株的某些特殊菌体成分和其分泌的某些物质激活了凋亡通路的某些因子以抑制细胞的凋亡,从而逃避宿主巨噬细胞的杀伤。因此,结核分枝杆菌毒力株对巨噬细胞凋亡的抑制可能是结核分枝杆菌抵抗机体免疫系统杀伤的一种重要机制。相关证实,结核分枝杆菌菌株的毒力因素对于其感染的宿主巨噬细胞凋亡的调控至关重要。
Mcl-1属于Bcl-2家族的抗凋亡成员,当下调Mcl-1的表达后,将会对不同毒力的结核分枝杆菌感染的宿主巨噬细胞的凋亡有何影响呢?当利用Mcl-1-shRNA质粒抑制Mcl-1的表达后,宿主巨噬细胞的凋亡率显著增加,同样地,弱毒力的BCG和H37Ra菌株处理组小鼠巨噬细胞的凋亡率稍高于强毒株H37Rv处理组,且随着时间的延长逐渐增加,在处理后的第5天凋亡率最高。出现此结果的原因可能有2个方面:(1)下调Mcl-1的表达可能激活了巨噬细胞凋亡的某些信号通路,从而促进了宿主巨噬细胞凋亡的诱导;(2)Mcl-1有可能被有活性的毒力株诱导,而减毒株或无毒力的菌株不能诱导Mcl-1的表达。此数据结果表明,抑制Mcl-1的表达对结核分枝杆菌感染的宿主巨噬细胞凋亡的调控机制可能与巨噬细胞凋亡信号通路和MTB菌株的毒力密切相关。
而有研究发现,对细胞凋亡某个程序或环节的抑制并不是通过Bcl-2的抗凋亡作用实现的,而是通过改变细胞凋亡的阈值,而细胞凋亡的阈值由Bcl-2与Bax的比值所决定,二者的比值亦对细胞的存亡起着重要作用,并且线粒体为二者相互作用的靶细胞器[14-15]。二者作为Bcl-2家族中最重要的成员,其作用不仅取决于本身表达水平的高低,还与二者之间的比例有关。通常情况下Bax与Bcl-2改变各自整合入膜所需构象形成异源二聚体Bax-Bcl-2[11],此时不能形成膜通道,从而促进了细胞存活,抑制了细胞凋亡;而当Bax增多时,则以Bax本身形成的同源二聚体Bax-Bax为主,促进细胞发生凋亡。在凋亡信号刺激下,Bax会从细胞质转移到线粒体膜上形成同源二聚体,通过线粒体通透性的改变,使线粒体释放细胞色素C进入胞浆中,从而激活caspase级联反应而导致细胞凋亡[1]。本研究中我们检测了各组小鼠腹腔巨噬细胞中Bcl-2和Bax的表达,结果显示,不同毒力MTB感染的小鼠腹腔巨噬细胞均可不同程度地诱导Bcl-2及Bax mRNA和蛋白的表达,其中强毒株较弱毒株更能明显地诱导Bcl-2,而弱毒株较强毒株更能明显地激活Bax;应用不同处理方式沉默抗凋亡基因Mcl-1后,各组宿主巨噬细胞中Bax的表达明显被上调,而Bcl-2的表达被不同程度的抑制,其中Bcl-2与Bax于处理前后表达水平的变化以H37Ra组、BCG组最为显著。由此可见,Bcl-2/Bax比值与感染的MTB的毒力相关,并且为负相关,沉默或阻断Mcl-1在不同毒力MTB感染的宿主细胞中的表达,可诱导调控Bcl-2及Bax的表达。因而,我们认为在MTB感染的宿主细胞中抗凋亡基因Mcl-1可通过与Bcl-2及Bax的相互作用调控宿主细胞的凋亡。
综上所述,应用Mcl-1-shRNA质粒抑制Mcl-1的表达可显著促进不同毒力MTB菌株感染的小鼠腹腔巨噬细胞的凋亡,其调控机制可能与Bcl-2和Bax蛋白的表达和MTB菌株毒力密切相关。对抑制Mcl-1调控结核感染的宿主巨噬细胞凋亡的研究将为结核病的预防与控制提供更多的策略与理论依据。然而,本研究对于其调控机制的探索仅仅是初步的,后续的实验中将会对此进行深入研究。

