井冈霉素A对枯草芽胞杆菌R31生长和生物被膜形成的影响
樊胜南,陈川雁,喻国辉,黎永坚,陈燕红,温书恒
(1.珠海市现代农业发展中心,广东 珠海 519075;2.广东植物龙生物技术股份有限公司,广东 珠海 519075)
井冈霉素是我国用量最大、最为成功的微生物杀菌剂之一[1],是上海市农药研究所20世纪70年代开发的一种氨基葡萄糖苷类农用抗生素,与日本的有效霉素结构相同,由吸水链霉菌的不同变种产生。其有效成分为井冈霉素A,在我国被大量用于水稻纹枯病、稻曲病、小麦纹枯病等真菌病害的防治[1-2],其作用机理主要涉及对真菌海藻糖酶活性、纤维素降解酶、多聚半乳糖醛酸酶和肌醇生物合成活性的抑制,并能够诱导植物产生系统抗性[3-4]。
井冈霉素和芽胞杆菌类杀菌剂混用可以协同增效,提高对水稻纹枯病等[5-9]病害的防治效果,这可能与井冈霉素能够促进这些芽胞杆菌在防治对象定殖并形成优势种群有关[10]。研究表明,生物被膜形成能力直接影响芽胞杆菌在寄主根际或叶际定殖,并最终影响芽胞杆菌对病害的防治效果[11-15]。芽胞杆菌生物被膜的形成受多种外部因素的影响,如植物根系分泌的苹果酸[12]或多糖[16],一些土壤微生物的次生代谢产物如表面活性素、制霉菌素等[17-18]。微生物产生的抗生素在亚致死浓度时具有诱导微生物产生生物被膜的作用[19],而井冈霉素是土壤链霉菌产生的抗生素,两者都是土壤中最常见的微生物[20],是否通过产生的抗生素发生互作尚不清楚。
为探索井冈霉素A对芽胞杆菌游离生长和生物被膜形成的影响,本研究选择枯草芽胞杆菌R31为研究对象。枯草芽胞杆菌R31是一株广谱抗真菌植物内生芽胞杆菌[21],具有持续控制香蕉枯萎病的能力[22]。R31能够在香蕉、粉蕉和西芹根际和根围长期定殖[23-24],其对香蕉枯萎病的防治效果与其能在根系表面形成生物被膜,作为生物屏障阻碍香蕉枯萎病病菌的侵染有关[25-26]。本文通过测定井冈霉素A对枯草芽胞杆菌R31游离生长和生物被膜形成的影响,了解井冈霉素A对枯草芽胞杆菌R31的影响方式,为进一步开发和提高R31对大田作物的防效提供理论依据。
1 材料与方法
1.1 试验材料
供试菌株:枯草芽胞杆菌R31,由珠海市现代农业发展中心农业微生物学实验室分离保藏。供试培养基:LB培养基、BGM(Biofilm growth medium)培养基[27]。供试试剂:纯度99.0%井冈霉素A标准品(北京勤诚亦信科技开发有限公司)、井冈霉素A60%原药(武汉科诺生物农药有限公司)。
1.2 试验方法
1.2.1 枯草芽胞杆菌R31的活化和培养将-20℃保存的甘油种在LB上划线,37℃静置培养24 h,挑单菌落接种到5 mL LB液体培养基中,37℃、200 r/min振荡过夜培养,发酵液作为种子液,以1%的量接入5 mL新鲜LB培养基中,培养至对数生长中期,用于生物被膜形成测定。
1.2.2 井冈霉素A标准品对R31生物被膜形成的影响测定 用新鲜的BGM培养基稀释上一步培养获得的发酵液,使其OD600为0.02,在稀释好的培养液中添加不同浓度(36、60、100、150、200、300 µg/mL)井冈霉素A标准品,以不添加井冈霉素A标准品为对照,混匀后分装到2 mL离心管中,每管1 mL,于37℃静止培养3 d,观察生物被膜形成情况。
1.2.3 生物膜的定量测定 参照文献[27]方法,将BGM培养基和未附着的菌体从离心管中移走,然后用无菌水清洗以去除游离的菌体,并用滤纸条吸收离心管壁上附着的水珠。加入1%结晶紫1.5 mL,室温下染色20 min,染色结束后,移走多余的结晶紫,用无菌水洗涤到无色,然后加入33%冰乙酸1.5 mL 洗脱结晶紫,测定洗脱液OD570值,用于判断生物被膜的厚度。
1.2.4 60%井冈霉素A对R31生物被膜形成的影响测定 考虑井冈霉素A标准品的成本问题,后续研究选用60%井冈霉素A原粉开展。为校正标准品和60%井冈霉素A原粉的差异,采用同一方法检测同浓度下60%井冈霉素A对R31生物被膜形成的影响。R31的培养和稀释步骤同上,将稀释好的培养液中添加不同浓度的60%井冈霉素A原粉,使井冈霉素A的浓度分别为 36、60、100、150、200、300 µg/mL,以不添加60%井冈霉素A为对照。其他步骤同上。
1.2.5 60%井冈霉素A对R31震荡培养条件下游离生长的影响测定 根据1.2.2和1.2.4的测定结果,井冈霉素A在60 µg/mL时显著抑制R31生物被膜形成,在100 µg/mL时对R31的生物被膜形成无影响,在200 µg/mL时显著促进R31的生物被膜形成,因此选择上述3个井冈霉素A浓度测定其对震荡培养R31的生长影响。R31的活化如前所述,培养至对数中期的R31发酵液按照1%的接种量接种到LB培养基中,分别为100 mL瓶装10 mL和50 mLLB培养基,以区别溶氧量,然后加入相应浓度的60%井冈霉素A,以不加60%井冈霉素A为对照,37℃、200 r/min振荡培养,并在培养1、2、4、6、8、10、12 h测定发酵液OD600,绘制生长曲线。
1.2.6 60%井冈霉素A对R31震荡培养发酵液中胞外多糖的影响测定 按照1.2.5的方法培养R31,培养体系选择100 mL瓶装10 mL LB培养基,在培养1、2、4、6、8、10、12 h分别取2 mL发酵液入10 mL离心管中,加入两倍体积的95%的乙醇,充分混匀4℃下静止30 min,4 000 r/min离心15 min,去上清,加5 mL乙醇静止10 min,同等条件下离心去上清。将沉淀转移到已经称量好的锡箔纸(W1)中,于105℃下烘干至恒重。冷却至室温后称重(W2),W2与W1的差值为多糖的重量[28]。
1.2.7 1%海藻糖添加对R31震荡培养条件下游离生长的影响测定 按照1.2.4的方法培养R31,培养体系选择100 mL瓶装10 mL LB培养基。试验设1%海藻糖,1%海藻糖加60%井冈霉素A 60 、100、200 µg/mL,以及不加海藻糖和井冈霉素的对照5个处理,培养1、2、4、6、8、10、12 h后测定发酵液的OD600,绘制生长曲线。
试验数据采用DPS7.05软件进行方差分析和邓肯新复极差法检验,并用Excel 2007软件作图。
2 结果与分析
2.1 井冈霉素A标准品对R31生物被膜形成的影响
从图1可以看出,井冈霉素A对枯草芽胞杆菌生物被膜形成的影响存在非线性关系的浓度效应,井冈霉素A 36、60 µg/mL处理对R31的生物被膜无显著影响,但井冈霉素A 100 µg/mL处理显著抑制R31生物被膜的形成。随着井冈霉素A浓度继续升高,其对R31生物被膜形成的抑制转成促进,井冈霉素A 200 µg/mL处理R31生物被膜厚度显著高于对照。
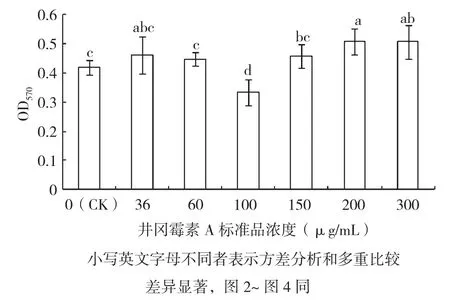
图1 井冈霉素A标准品对枯草芽胞杆菌R31生物被膜形成的影响
2.2 60%井冈霉素A原粉对R31生物被膜形成的影响
从图2可以看出,60%井冈霉素A原粉按照标准品相应浓度处理后对枯草芽胞杆菌R31生物被膜形成的影响规律同标准品一致,唯一不同的是添加60%井冈霉素A原粉333 µg/mL配置成井冈霉素A终浓度为200 µg/mL的处理未显著促进R31生物被膜形成,与标准品的结果有差异,可能与60%井冈霉素A粉剂中活性成分的浓度存在一定偏差有关。
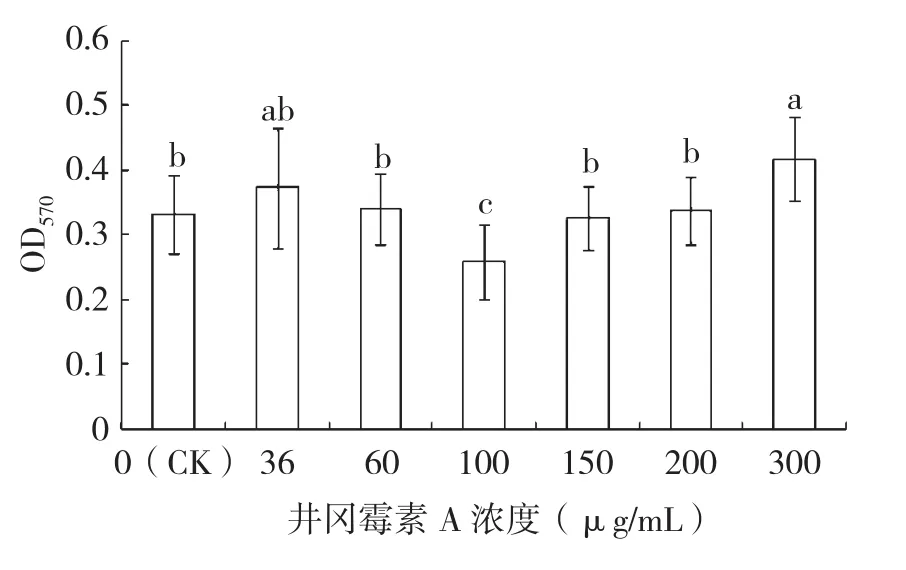
图2 60%井冈霉素A对枯草芽胞杆菌R31生物被膜形成的影响
2.3 60%井冈霉素A原粉对R31震荡培养条件下游离生长的影响
溶解氧对R31的生长存在一定影响,溶解氧越充足,R31的游离生长状态越好,表现为OD600值高,溶解氧不充足时R31的游离生长受到影响,表现为OD600值低(图3)。溶解氧充足的状态下,不同浓度的井冈霉素A对R31的生长表现出先抑制后促进的特点。培养6 h,井冈霉素A各处理间的OD600无显著差异,但显著低于对照;培养8 h,对照和低浓度(60 µg/mL)60%井冈霉素A处理的OD600显著高于另外2个高浓度处理;培养10 h后,井冈霉素A不同浓度处理的OD600均显著高于对照。
当培养体系中溶氧状况较差时,各浓度的井冈霉素A对R31生长影响的总体趋势没有变化(图3),但不同培养时间的情况存在差异。培养6 h,对照生长最好,不同浓度的井冈霉素A对R31的生长抑制表现为浓度越高、抑制越明显;培养8 h,加入井冈霉素A的处理仍然抑制R31的生长,但以井冈霉素A 100 µg/mL的处理抑制最强;培养10 h,井冈霉素A 100 µg/mL处理对R31的显著v抑制转为显著促进,另外两个处理仍表现为显著抑制;培养12 h,所有井冈霉素A处理均表现为对R31生长显著促进,但存在浓度效应:浓度越高,促进的效果越差。说明在溶氧不足的情况下,游离生长的R31更容易受井冈霉素A的抑制。但当R31的菌体达到一定浓度时,抑制则转化为促进作用。
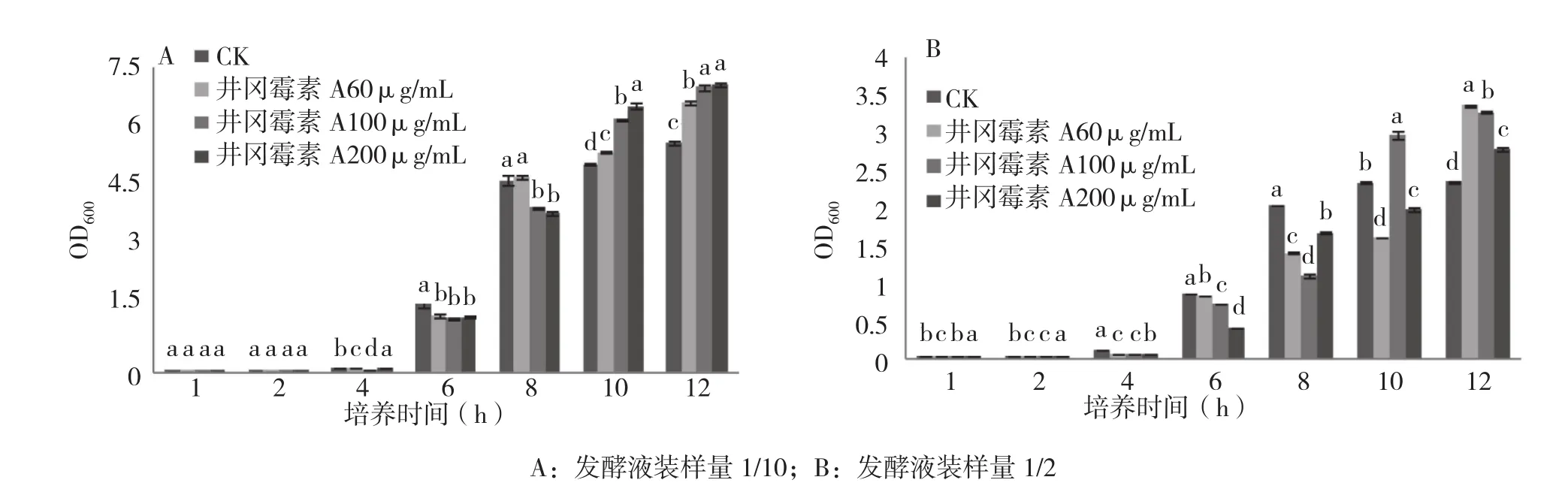
图3 井冈霉素A对枯草芽胞杆菌R31生长的影响
2.4 60%井冈霉素A对振荡培养R31胞外多糖产生的影响
从表1可以看出,除培养2 h检测到60 µg/mL井冈霉素A处理R31胞外多糖含量显著高于其他处理外,其他培养时间各处理间差异不显著,显示井冈霉素A对R31游离生长时胞外多糖的分泌无影响。

表1 不同浓度60%井冈霉素A处理枯草芽胞杆菌R31胞外多糖分泌量(g/L)
2.5 1%海藻糖促进R31生长和消除井冈霉素A对R31生长抑制作用
从图4可以看出,海藻糖的加入可以促进R31生长,并消除不同浓度井冈霉素A对R31生长的抑制。培养6 h,除60%井冈霉素A 100µg/mL处理表现为抑制R31生长外,其他所有处理都表现为促进R31生长,而不加海藻糖的井冈霉素A各浓度处理此时均显著抑制R31的生长(图3A)。培养8 h,所有加入海藻糖后的井冈霉素A处理均促进R31的生长。在不同浓度井冈霉素A处理中加入1%的海藻糖,能不同程度消除井冈霉素A在R31生长前期的抑制效应,但是在井冈霉素A 60 µg/mL和200 µg/mL处理中能较早消除抑制,而在井冈霉素A 100 µg/mL处理中,则需要延迟2 h才能消除抑制,具体原因还需进一步研究。
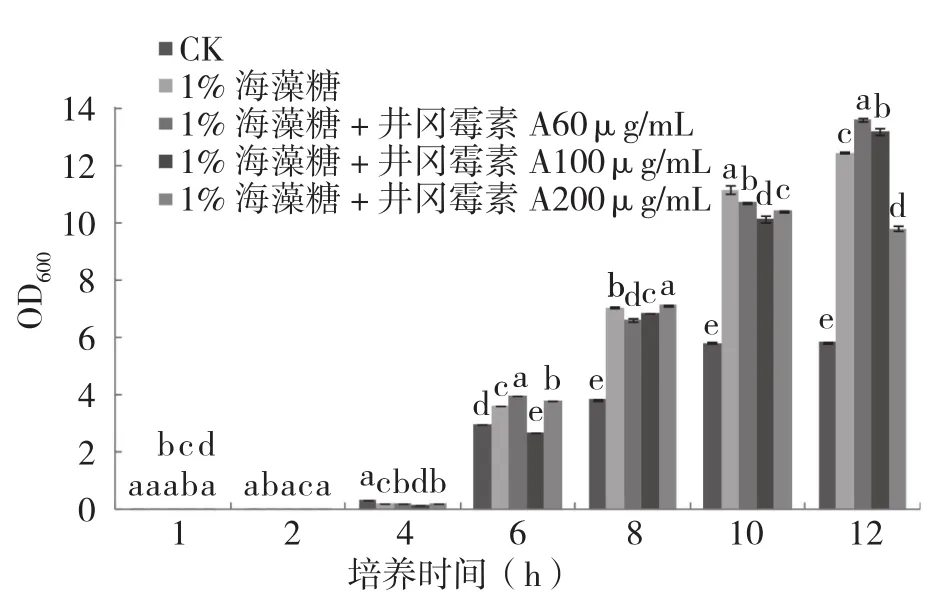
图4 1%海藻糖促进枯草芽胞杆菌R31生长并消除井冈霉素A对R31生长的抑制
3 结论与讨论
生物被膜形成是芽胞杆菌类生防菌在自然界定殖并发挥防效的先导机制[11],当其在植物叶际或根系表面形成生物薄膜后,就可以与病原菌竞争生态位,并通过释放各种抑菌物质来影响病原菌的生长与定殖,或影响植物的抗性,以达到防治病害的效果[12-15]。枯草芽胞杆菌R31在大田中对香蕉枯萎病表现出良好的防治效果,与其具有较强生物被膜的形成能力有关[26]。研究表明,井冈霉素A可以促进枯草芽胞杆菌在寄主根际和叶际定殖[5],显示井冈霉素A可能对枯草芽胞杆菌的生物被膜形成产生影响。通过测定井冈霉素A对枯草芽胞杆菌R31生物被膜形成的影响发现,井冈霉素A在低浓度(36、60 µg/mL)可以促进R31的生物被膜形成,在较高浓度(200 µg/mL)才可以显著促进R31的生物被膜形成,这与陈志谊等[5]报道的结果非常吻合:使用5%井冈霉素与Bs916对半混合使用时,混合后体系的井冈霉素A浓度为250 mg/mL,稀释后最终喷施时的井冈霉素A浓度会更低,但仍然在生产上表现出对Bs916定殖的增效作用。利用5%井冈霉素和200亿孢子/g枯草芽胞杆菌可湿性粉剂开展的研究也表现出类似结果,当两者1:1混配,混配系统中井冈霉素A的浓度达到125 mg/L时,对小麦纹枯病的预防效果达到75.1%,超过50%多菌灵和5%井冈霉素可湿性粉剂[8],室内测定的防效随井冈霉素浓度增加而增加。这些文献报道与本研究结果一致,说明井冈霉素A和芽胞杆菌协同增效的机制通过井冈霉素A促进芽胞杆菌生物被膜形成来实现,但井冈霉素A通过哪种机制来促进枯草芽胞杆菌生物被膜的形成,值得深入研究。
井冈霉素A在100 mg/mL时表现出对枯草芽胞杆菌生物被膜形成的抑制,与严清平等[10]报道结果一致,利用60%井冈霉素A开展的平板抑菌实验也显示,100 mg/mL的井冈霉素A对12株参加测试芽胞杆菌中的9株表现出抑制作用,但继续增加井冈霉素A的浓度,抑制反而转成促进,显示高浓度的井冈霉素A和枯草芽胞杆菌制备成复合制剂还是可能的。
井冈霉素A对游离生长的枯草芽胞杆菌表现出抑制,溶氧充足,芽胞杆菌生长速度快的,能够较早消除抑制,此时,井冈霉素A对芽胞杆菌的抑制转化成促进作用,而溶氧不足,菌株生长缓慢的,抑制时间延长,但最终都转换成促进作用。显示井冈霉素A对芽胞杆菌的抑制存在菌体浓度效应,这可能与芽胞杆菌自身的群体感应有关。在液体培养基中,枯草芽胞杆菌生物被膜形成被启动的基础菌体浓度是3×107CFU/mL[29],当枯草芽胞杆菌菌体浓度未达到启动生物被膜形成的浓度时,生长受到井冈霉素A的抑制,一旦菌体浓度达到足够启动生物被膜形成后,由于某种未知机制,井冈霉素A转而促进枯草芽胞杆的生长。
井冈霉素A的生物活性之一是抑制真菌或昆虫的海藻糖酶活性,影响真菌和昆虫对海藻糖的利用并最终发挥防效,在培养基中添加1%的海藻糖可以恢复井冈霉素A对枯草芽胞杆菌游离生长的抑制,显示其对R31游离生长的抑制与对R31海藻糖的利用影响有关,但具体通过哪些途径影响R31的海藻糖代谢尚需进一步研究。胞外多糖是枯草芽胞杆菌生物被膜中的主要成分之一,但对井冈霉素A不同处理的不同培养时间点R31培养液中胞外多糖的定量测定,差异不显著,显示井冈霉素A可能不是通过影响R31胞外多糖的产生而影响其生物被膜的形成。
井冈霉素和枯草芽胞杆菌都是我国重要的生物农药,本研究发现井冈霉素A可以促进枯草芽胞杆菌的生物被膜形成,对生产上进一步开发两种生物农药以扩大防治对象和提高防效具有重要的意义,同时也为进一步开展基础研究以揭示两者作用机理奠定了理论基础。

