氢治疗学对心血管疾病治疗的研究进展
杜芸 综述 黄晶,2 审校
(1.重庆医科大学研究生院,重庆400010;2.重庆医科大学附属第二医院心血管内科,重庆400010)
高血压、冠心病等心血管疾病是人类死亡的主要原因之一,所以早期预防干涉对提高生存率很重要。目前,控制血压、抗凝、抗血小板等治疗均有助于提高长期寿命;但多药联合使用会使患者依从性下降,而氧化应激反应是心血管疾病发生发展的重要机制之一。是否可以从机制探索,研究出更便捷、有效的预防及治疗方法呢?
氧化应激反应与许多疾病的发病机制有关,但目前的抗氧化剂有很高的致毒性,以致其治疗剂量控制在很窄的治疗窗。而氢作为新型抗氧化剂,因其选择性减少活性氧水平被推广使用。
1 氢与氧化应激反应
氧化应激反应会使得细胞氧化过剩从而产生过多的活性氧或自由基[1]。同时氧离子也可以由代谢氧化酶类,包括黄嘌呤氧化酶、环氧酶、脂肪氧化酶及还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶产生。尽管活性氧或自由基在高浓度下有细胞毒性作用,但它们在人体中有重要的生理角色——低浓度时参与信号传导与生物调节过程[2-6]。因此必须要在不影响基本生物活动时中和细胞毒性作用。而氢气(H2)可以在不影响其他反应性氧化物(ROS)通路的情况下减轻过氧化亚硝酸盐(ONOO-)及羟自由基(OH-)的细胞毒性(图1)[7]。因此H2,可作为一种新型抗氧化剂,应用于抑制氧化应激反应。
H2治疗的作用主要是抑制氧化应激反应。而氧化应激反应发生的环境——细胞氧化还原内稳态,是由活性氧之间微妙的平衡生产和抗氧化防御系统维护[8]。当ROS产生过度或内源性抗氧化剂能力减弱,机体不加选择地氧化反应会导致潜在的破坏性[9]。值得注意的是,H2是高选择性的与氧自由基结合,从而减少了机体的代谢紊乱。此外,H2可迅速扩散到组织和细胞中。因此,H2可以作为一种安全、有效的抗氧化治疗[10]。
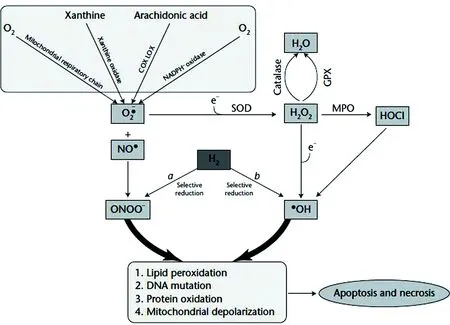
注:SOD:超氧化物歧化酶;GPX:谷胱甘肽过氧化物酶;MPO:髓过氧化物酶;HOCl:活性氯;NO-:氮氧基。
图1氧化应激反应
2 氢预防动脉粥样硬化的动物研究
动脉粥样硬化是一种受多因子影响且持久的过程,动脉粥样硬化及相关的心血管疾病具有炎症和氧化应激状态加剧的特征:巨噬细胞的聚集和氧化产物、低密度脂蛋白对血管的影响[11-13]。氢分子是一种有效的抗氧化剂,它可以通过气体迅速扩散到组织和细胞。日本学者Ohsawa等[14]进行了一项研究,该研究用基因敲除了载脂蛋白E的大鼠(可在短时间内发展为动脉粥样硬化)作为模型[15-16],探究H2在其中是否有抗动脉粥样硬化的作用。
用2月龄的敲除载脂蛋白E基因的大鼠,实验组每日喂70 mL富氢水,对照组喂脱氢水,其余条件相同。6个月后收集主动脉根及距心脏2 mm的主动脉部分,用4%的多聚甲醛固定,8 μm为间距冰冻切片,然后进行油红O、HE染色等,最后在显微镜下进行分析。
不同于其他抗氧化剂[NO、硫化氢(H2S)等],H2对人体的副作用小,且吸入H2不影响生理参数,如体温、血压、pH值和氧分压[1,17]。目前,氢已被人类用于防止潜水员的减压病(2 兆帕的氢分压)[18]。H2进入人体后可迅速扩散入细胞,有其高效性。综合来看,在未来可作为安全、起效快的抗氧化剂,H2将被广泛应用于人体的各种疾病。在此动物实验中,H2有抗动脉粥样硬化的作用,且其安全性高,有待于临床试验的进一步研究。

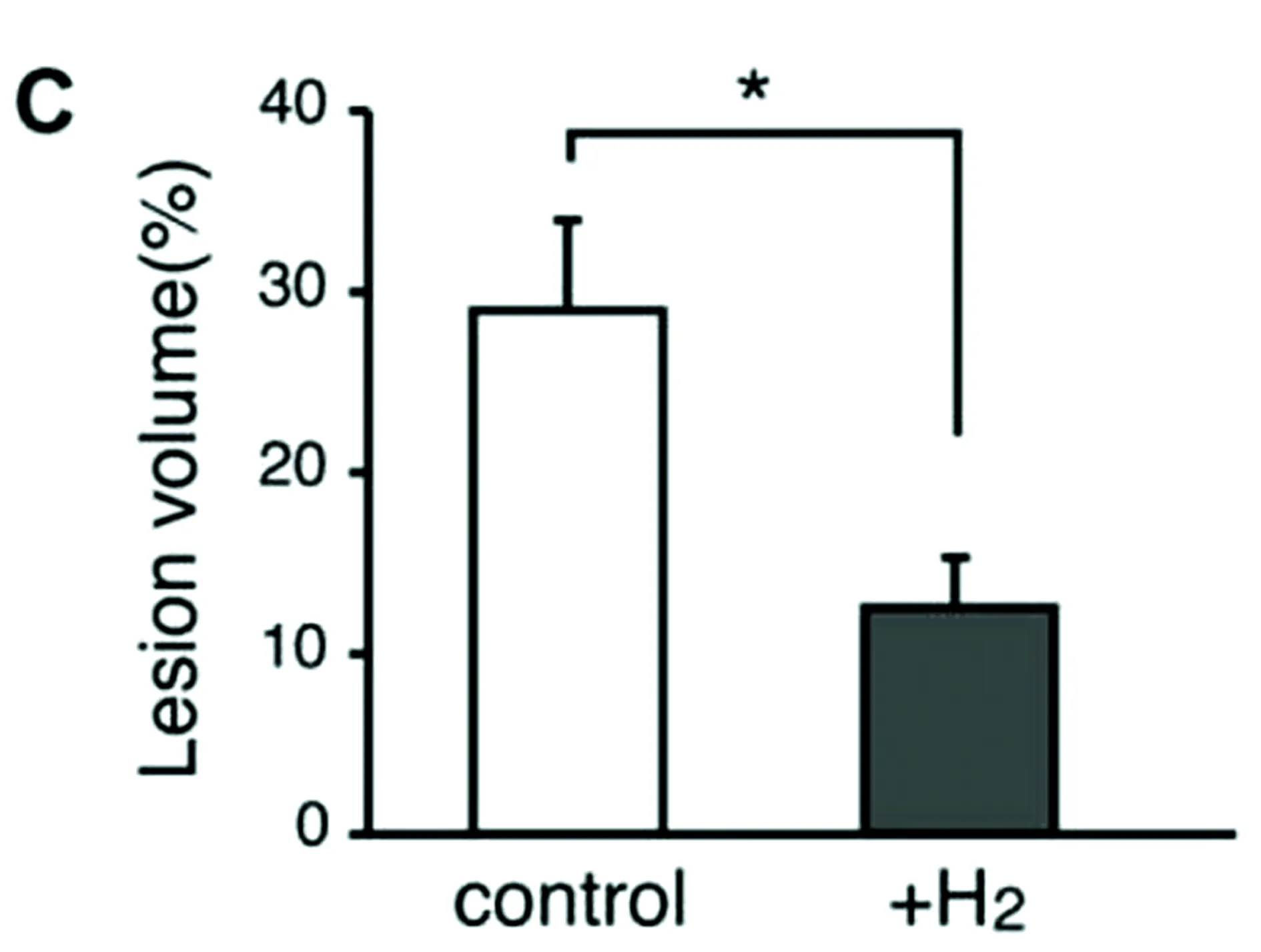
注:A代表的是显微水平的近端主动脉心脏;B代表的是垂直部分远端主动脉(距离心脏2 mm)。A、B均由油红O染色。比例尺:100 μm(A)和1 mm(B);C代表了累计的缺损体积(图2)。由A、B可以看出:实验组的脂质沉积比对照组少。由此发现喝了富氢水的老鼠动脉粥样硬化病变的体积明显减少。
图2氢对粥样硬化沉积的影响
3 氢对心脏骤停后大鼠生存率的动物研究
在心脏骤停后综合征中,缺血再灌注是快速及急性氧化应激的一个关键的原因。而H2作为一种新型抗氧化剂,可以在不影响其他ROS通路的情况下减轻ONOO-及OH-的细胞毒性。日本学者Hayashida等[10]进行了一项研究,此研究运用心脏骤停模型大鼠,分成4组,讨论低温(33℃)、吸入1.3% H2处理对其预后(7 d生存率)是否有益,从而证明H2、低温是否可用于治疗心脏骤停后大鼠的缺血性脑损伤。
选用17周大的大鼠(每只约408 g),注射戊巴比妥钠(45 mg/kg)建立心脏骤停模型。保持其他条件一致,然后随机分成4组:对照组(Ctl组):n=13,26%O2+37℃;氢气组(H2组):n=7,1.3%H2+37℃;低温组(TTM组):n=7,26%O2+33℃;低温+氢气组(TTM+ H2组):n=7,1.3%H2+33℃,最后观察大鼠的7 d生存率(见图3)。
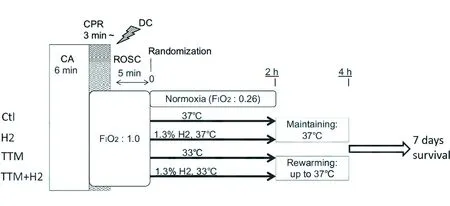
注:CPR:心肺复苏;DC:死亡;CA:心脏停搏;ROSC:自主循环恢复。
图3实验流程
从表1、表2可以看出,通气前与通气后2 h内,各组间心率、血压等变化不大。
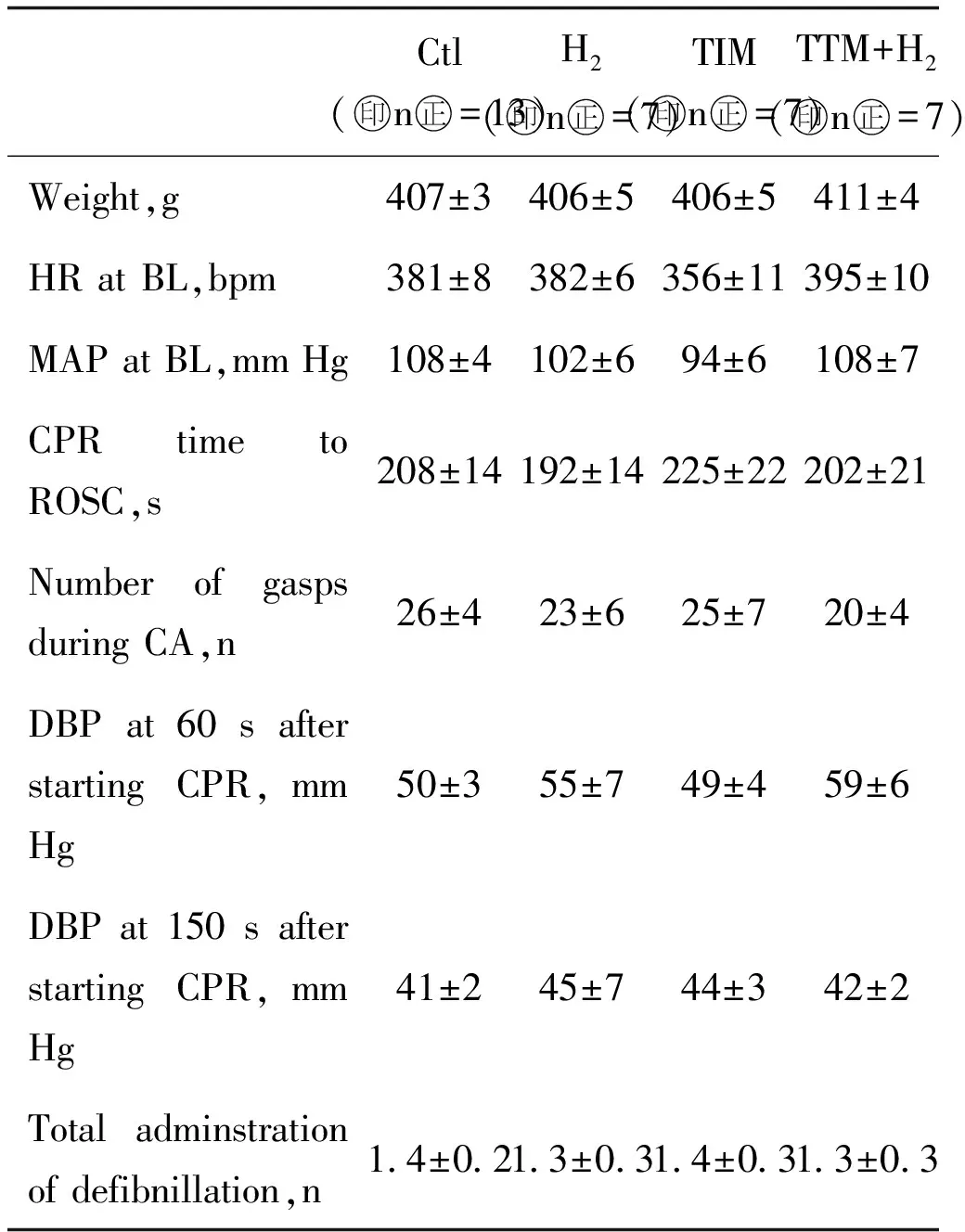
表1 各组基本信息
注:1 mm Hg=0.133 3 kPa;HR:心率;MAP:平均动脉压;DBP:舒张压单位;Base excess:碱剩余;torr:托-真空压强;:actate:乳酸。
7 d后统计各组存活的大鼠数量;对照组大鼠的生存率是38.4%(n=5),H2组是71.4%(n=5),TTM组同H2组,TTM+H2组:85.7%(n=6)(图4)。证明低温与H2可提高心脏骤停后大鼠的7 d生存率。
作者对7 d后的大鼠还做了一个神经功能缺损(NDS)评分(0分代表正常,500分代表死亡或脑死亡),从表3中可以明显发现H2及低温治疗还可以明显改善大鼠的神经功能。

表2 各组在不同时间的信息
注:PaO2:氧分压;PaCO2:二氧化碳分压。
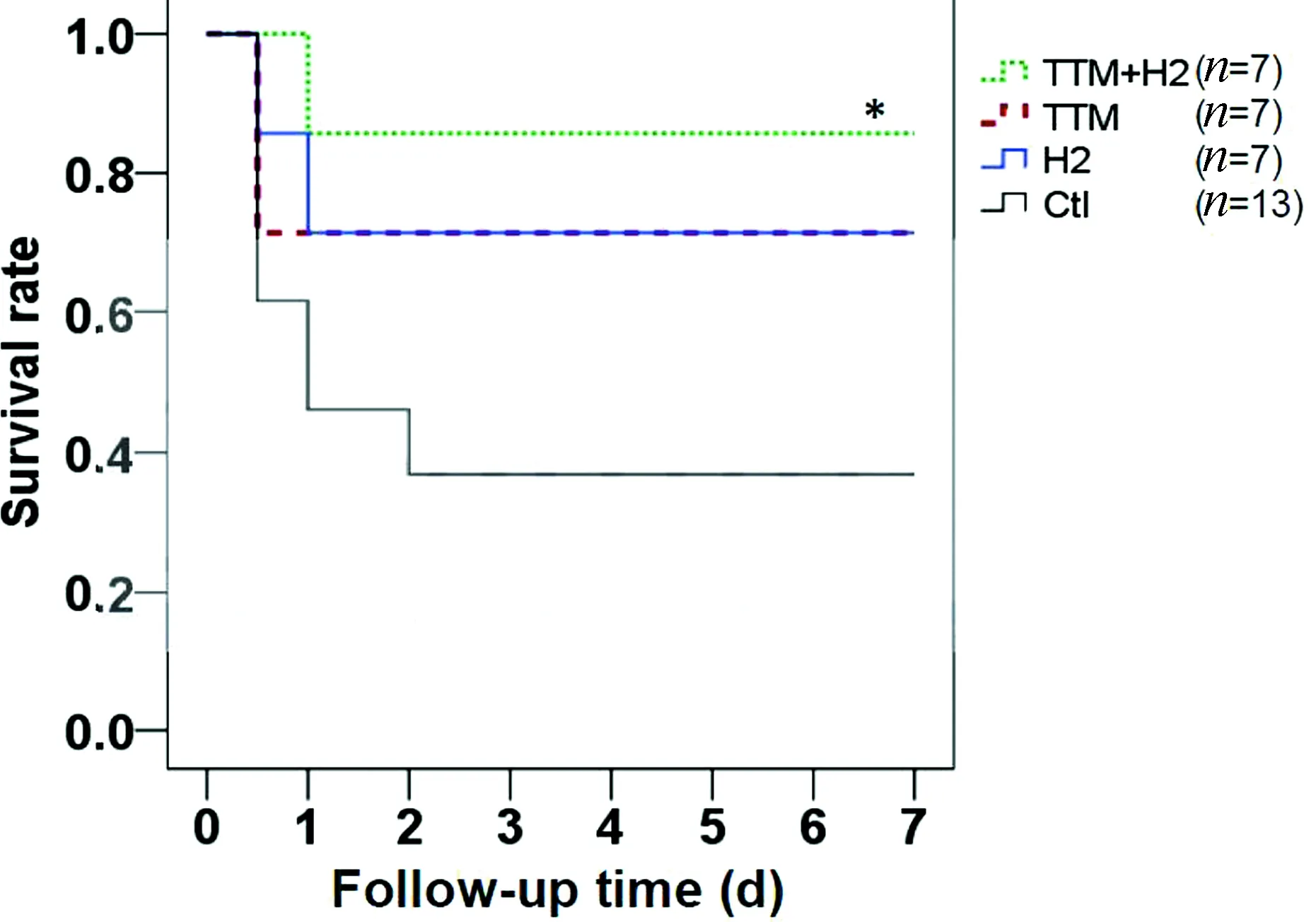
图4 各组不同时间生存率
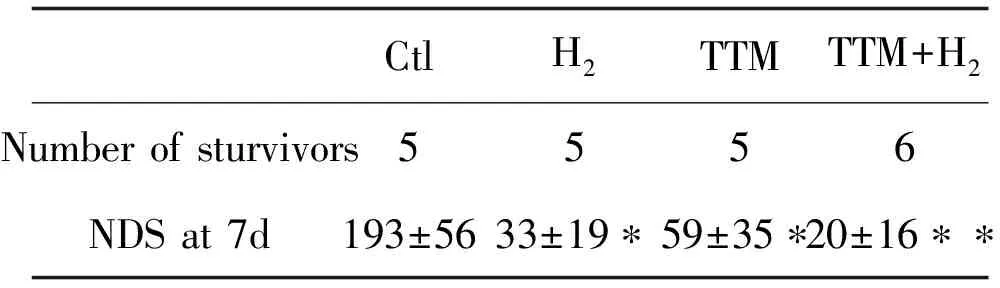
CtlH2TTMTTM+H2Number of sturvivors5556NDS at 7d193±5633±19∗59±35∗20±16∗∗
注:与对照组比较*:P<0.05;**P=0.01。
在这个研究中,发现H2对于应激反应中缺血再灌注损伤有益。经H2治疗后,大鼠的大脑神经功能得到改善。
既然H2可以提高心脏骤停后大鼠的生存率,那么是否可以进一步应用于人体心脏骤停进行CPR后,改善心肌细胞功能,从而提高其生存率呢?目前,此类研究还处于初级阶段,可发展空间大,有待进一步的研究。
4 氢对氧化应激产物影响的动物研究
该研究选用体重280~320 g的成年大鼠共110只,随机分为3组,其中样本组(Group S)30只,缺血再灌注组(Group I/R)40只,富氢水组(Group H)40只。对缺血再灌注组及富氢水组建立心脏骤停模型,随后富氢水组在CPR的最开始注射富氢盐水。作为对照,样本组及缺血再灌注组注射生理盐水。在实验过程中保持其余条件一致,后将大鼠的海马体组织用酶标法测量其ROS产物。实验发现,在此氧化应激反应过程,缺血再灌注组ROS产物明显高于富氢水组(P<0.05)(图5)[19]。

图5 各组ROS产物
此研究还探讨了各组间大鼠7 d后的存活率、NDS评分、海马体内质网中涉及氧化应激反应的分子标志物。本文意在探究H2与心血管疾病的联系,暂不涉及脑部结构,故此处不做过多的讨论。
5 现状分析
近年来,作为新型的治疗手段,氢治疗学的作用在肝损伤、急性胰腺炎、小肠缺血、脑缺血等各种疾病模型中被广泛研究[20-23];但其对于心血管疾病预防及治疗效果的研究仍然较少。综上所述,可以看出氢治疗学对氧化应激反应有抑制作用,而氧化应激反应是动脉粥样硬化、高血压等心血管疾病发生发展的一个重要机制。那么是否可以由此延伸,找到新型预防及治疗心血管疾病的方法呢?这有待于进一步深入的研究。
6 展望
相对于H2S、NO等有细胞毒性的抗氧化剂,H2安全、高效,有其独特的发展潜力。目前,氢预防及治疗心血管疾病的研究仍然较少,希望能透过本文,使大家在此方面多加思考,进一步深入研究。

