汞离子传感器检测技术研究进展
冯瑜祥 李相阳 邵向丽 许文涛
(1. 中国农业大学食品科学与营养工程学院,北京 100083;2. 中国农业大学农学院,北京 100083)
重金属是一组天然的非生物降解元素,能在食物链的生物放大作用下富集[1]。重金属在采矿业、发电业、冶炼业、电池制造业、染料纺织制造业、肥料及化肥的生产中都具有广泛的应用[2]。
汞又称水银,常温常压下是自然界中唯一的液态有色金属。汞的化学性质稳定,外表呈现银白色,其单质或化合物形式均易于挥发并被生物体吸收。因汞能长距离转移到极地、蓄积在生物体中并产生毒性危害,联合国环境规划署(United nations environment programme,UNEP) 自 2001年起将其追加为持久性有害物质(Persistent hazardous substances,PHS)[3],我国也于 2011 年将汞列入《重金属污染综合防治规划(2010-2015)》[4]。
汞的跨大陆运输及随大气沉降的性质使得汞污染成为一个全球性问题。已知存在于水环境中的有机汞包括甲基、乙基和苯基汞。在这些化合物中,甲基汞含量最高,毒性最强并且易随食物链实现生物积累和放大。汞中毒引起的临床表现与进入体内汞的形态、进入途径、接触剂量、接触时间及人体特征密切相关,表现为急性毒性、慢性毒性和蓄积性毒性,靶向器官为消化系统和神经系统。甲基汞还可以通过胎盘屏障,使新生儿发生先天性疾病[5]。为保障人类健康,美国环境保护协会(Environmental protection agency,EPA)规定的饮用水中的最大汞残留量为 2.0 ppb[6]。
1 汞离子检测技术概述
同其他金属离子一样,Hg2+的检测方法也经历了由仪器分析到传感器检测的过程。仪器分析法包括原子吸收光谱法(Atomic absorption spectrometry,AAS)[7-8], 原 子 发 射 光 谱 法(Atomic emission spectrometry,AES)[9],原子荧光光谱法(Atomic fluorescence spectrometry,AFS)[10-11]和质谱法(Mass spectrometry,MS)[12]等。仪器分析法在灵敏度和准确性方面具有明显的优势,但昂贵的设备和繁琐的样品处理过程使其难以广泛应用。作为仪器分析的补充,传感器检测法以其良好的兼容性发展起来。利用传感器检测的核心思路是构建敏感元件和换能元件[13]。敏感元件是与目标物质特异性结合并识别的部分,换能元件是指将目标物质的含量等信息转换成可识别的相关信号或方式。在搭建检测汞的传感器时,敏感元件通过与Hg2+的相互作用实现了Hg2+的特异性捕获,这些敏感元件包括荧光基团、核酸、纳米粒子、转基因微生物、肽、蛋白质及酶等。换能元件则将传感器对汞的识别信息转换成可检测的信号,通过仪器采集,放大滤噪等处理,实现Hg2+的定量检测。目前的综述大多以换能元件为分类依据,将检测Hg2+的传感器分为光学传感器、电化学传感器等,忽视了Hg2+与敏感元件结合的原理。因此,本文将从Hg2+的性质入手,对Hg2+与敏感元件的结合原理进行分类总结,阐述近年来Hg2+传感器的发展,为实现Hg2+的快速检测提供方法依据。
2 Hg2+与敏感元件间的相互作用
2.1 Hg2+与化学分子互作
2.1.1 Hg2+与荧光基团的互作 Hg2+与荧光基团互作为基础的生物传感器主要有“关”和“开”两种类型。前者将Hg2+作为一种高效的荧光猝灭剂。通过猝灭纳米粒子或荧光化学基团实现Hg2+的定量检测;后者则利用Hg2+与特殊基团的相互作用实现荧光的恢复。利用荧光法检测Hg2+时,若荧光基团具有良好的两亲质,能很好地穿越细胞膜,则能通过生物成像检测细胞内的 Hg2+[14]。
2.1.1.1 Hg2+猝灭 AuNCs的荧光 2009 年,Xie等[6]利用Hg2+与Au+的相互作用及Hg2+的荧光猝灭性质,设计了一个简单、无标记的荧光传感器。该传感器包含了高荧光产率金纳米团簇(AuNCs)。该“关”型传感器的线性检测范围为1-2×10-8mol/L,检测限为5×10-10mol/L(0.1 ppb),远低于美国环境保护署规定的饮用水中汞离子的(2 ppb)最高水平。这种检测原理可以较容易的移植在试纸条系统中,从而实现Hg2+的快速、可视化检测。2010年,Lin等[15]首次报道了AuNCs在检测CH3Hg+中的应用,并通过加入EDTA可以有效的区分Hg2+与CH3Hg+两种靶物质。同年,Hu等[16]基于Hg-S相互作用,建立了利用BSA包被的AuCNs(BSA-AuNCs)检测Hg2+的传感器。BSA-AuNCs与Hg2+通过Hg-S键形成复合物,BSA-AuNCs复合物首先被激发形成激发态,Hg2+直接拦截电子载体并被还原成Hg+,扰乱空穴与激发电子的辐射复合,从而猝灭BSA-AuNCs的光致发光作用。当Hg2+浓度为 4×10-4mol/L-4.32×10-2mol/L之间时,荧光猝灭程度与Hg2+浓度之间存在良好的线性关系,其检测限LOD可以达到8×10-8mol/L。
2.1.1.2 Hg2+与有机荧光分子的互作 有机荧光分子也是一类被广泛的应用于近红外生物成像、生理分析检测、疾病诊断等方面的功能性染料。有机近红外染料通常具有高的摩尔消光系数与荧光量子产率,并且因其具有分子结构易于合成修饰,光谱易于调节,生物相容性较好且代谢较快等优点,一直受到大家的广泛关注[17]。
(1)基于罗丹明的化学传感器 罗丹明类染料在检测重金属离子及生物成像中有广泛的应用,最常利用的性质是罗丹明螺环与开环结构转换[18]。具体来说,罗丹明类染料在螺环状态下,由于分子内的共轭结构被打断,表现为无特征吸收、无特征发射;而当其处于开环状态时,表现出特征吸收与荧光发射的现象。2007年,Wu等[19]以经过修饰的Rho 6G为荧光染料,设计了特异性检测Hg2+的“开”型传感器,实现了Hg2+的荧光-比色双重检测。其原理如图1所示。Hg2+与硫具有很强的亲和性,并且可以促进脱硫反应发生,打开作为信号分子的Rho 6G的螺环结构并促发分子内胍基化修饰,形成强烈的荧光。该传感器具有良好的特异性,不受其他二价离子的干扰,并在pH 5-10的范围内都有较好的检测效果。
同样利用Hg2+的亲硫性质,Lin等[20]设计了1作为识别Hg2+的新型探针,并将该探针应用于生物成像。1包含罗丹明衍生物,S原子和炔基3个部分。Hg2+、S原子、炔基结合会使罗丹明衍生物由无荧光的螺环状态转化为有荧光的开环状态。荧光探针1的两亲性是实现Hg2+生物成像重要基础。该探针的检测限LOD为 3.9×10-8mol/L,荧光强度与Hg2+浓度在5×10-8mol/L-4×10-6mol/L之间存在良好的线性关系。
(2)基于方酸的化学传感器 方酸(Squaraine,SQ)类染料是一类具有大平面π 共轭类荧光染料,其在近红外区域有较强的吸收与发射[21]。方酸的刚性平面也使得其具有较好的光稳定性。目前方酸类染料常常用于生化标记分析、荧光检测等领域[22]。2005年,Ros-Lis等[23]设计了比色-荧光传感器,实现了Hg2+的定量检测。Hg2+具有亲巯基性,且能够与APC衍生物发生反应。APC衍生物,如图2-A所示,含有两个独立的发色团,分别在265 nm和305 nm处有特征峰,其溶液呈蓝色。在加入Hg2+后,如图2-B,Hg2+争夺APC衍生物中的巯基基团,APC衍生物被拆分,重新形成方酸染料,原有的特征峰消失,体系的颜色由蓝色变为无色,并在642 nm处产生一个新的吸收带,产生荧光信号。该方法实现了水溶液中2 ppb Hg2+的检测。2011年,Chen等[24]利用方酸在不同的溶液体系中表现出的不同特性,实现了Hg2+的定量检测。作者通过修饰生成SQ-1增强了方酸对Hg2+的特异性。实验表明,SQ-1在548 nm处的吸收峰按比例降低,伴随着636 nm处新的吸收峰的出现。该检测方法具有良好的特异性,即使是对巯基敏感的Ag+或Pb2+,也不会对检测结果产生干扰。
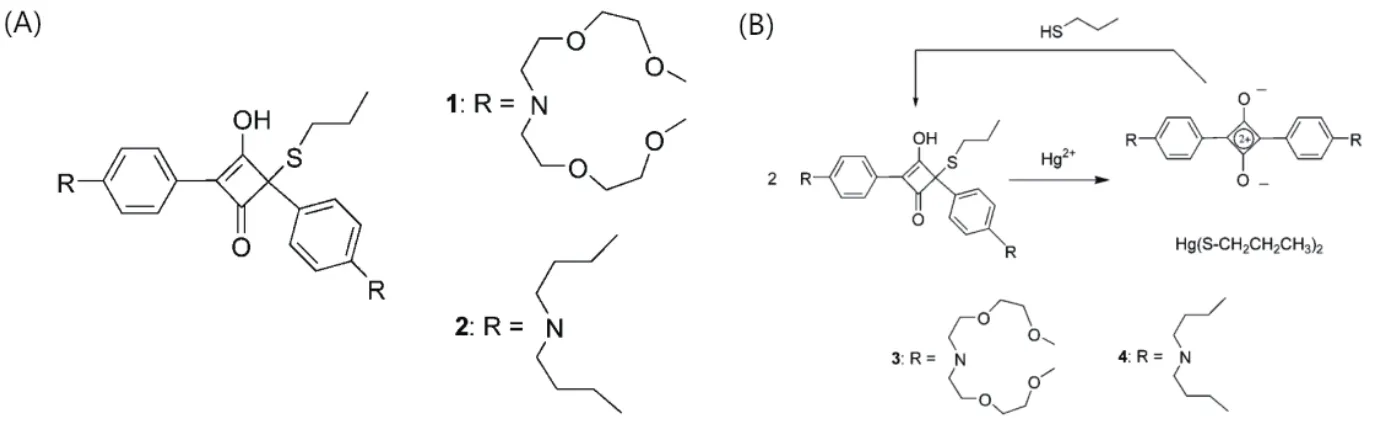
图2 Hg2+与丙硫醇反应诱导APC衍生物再生原理图[23]
(3)基于萘酰亚胺荧光基团的化学传感器 萘酰亚胺是一类优秀的发色基团,目前作为信号基团大量应用于荧光分子探针的设计。这类化合物具有较好的平面刚性和嵌入能力,已被广泛应用于嵌入剂、光敏损伤和抗肿瘤药物等方面的研究[25]。Guo等[26]设计了一个水溶性化学传感器1,实现了Hg2+的定量检测。1是由两个萘酰亚胺荧光物质和受体 2,6-二(氨基甲基)吡啶组成,该物质可与金属离子选择性结合,而2,6-二(氨基甲基)吡啶的氮原子既作为离子受体又发挥荧光猝灭剂的作用。1的荧光强度与Hg2+浓度在(0.1-1.0)×10-5mol/L的区间范围内线性相关,且具有良好的特异性。
利用萘酰亚胺类荧光基团还可以实现Hg2+的生物成像。Li等[27]通过共价连接萘酰亚胺吡啶和大共轭卟啉基团设计了可以定量检测Hg2+的比率传感器1,其结构如图3所示。该传感器可以发生可逆的比率荧光反应,对水溶液中Hg2+具有很高的灵敏度和选择性。在激发波长415 nm,发射波长处于450-700 nm区间时,无Hg2+状态下,1在525和650 nm处有两个典型的荧光发射峰,这两个荧光发射峰分别来自于萘酰亚胺和卟啉基团。Hg2+的加入会引起萘酰亚胺荧光基团的荧光信号显著增加,而卟啉基团的荧光信号减少。二者的发射强度I525/ I650,随着Hg2+浓度的增加而增加。其线性检测区间为1.0×10-7mol/L-5.0×10-5mol/L,检测限为2.0×10-8mol/L。生物成像实验表明,该探针同样可以实现细胞内Hg2+的检测。
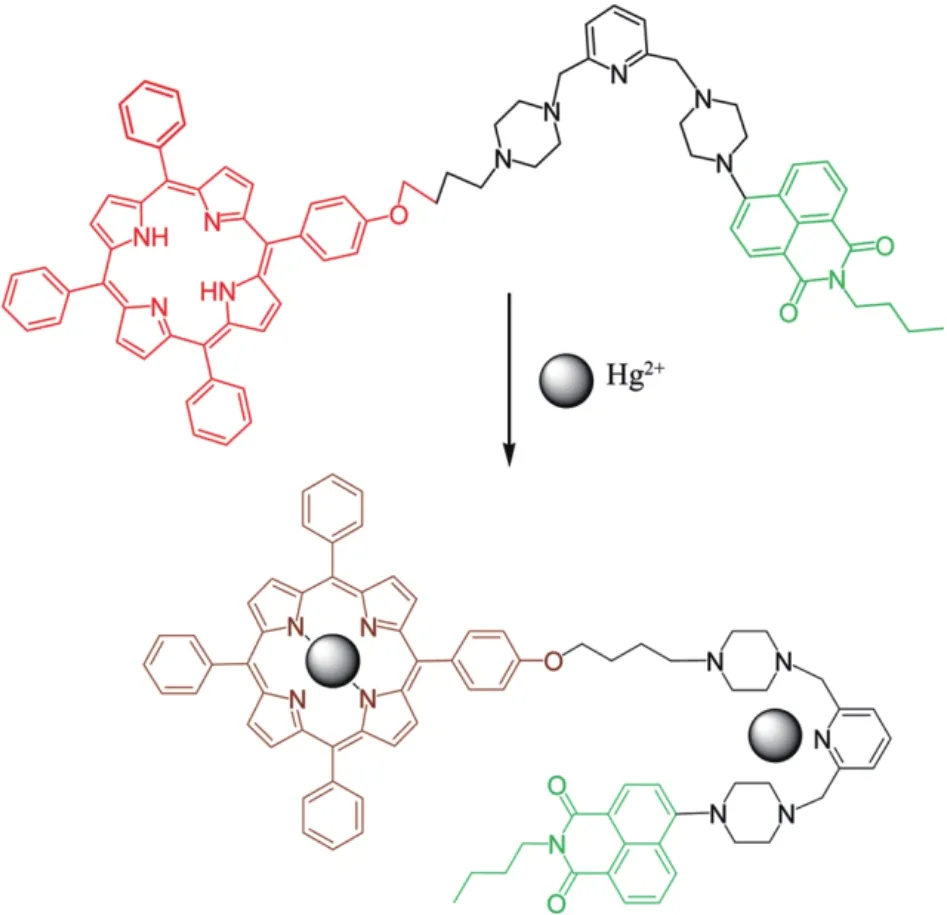
图3 探针1与Hg2+结合机理示意图[27]
2.2 Hg2+与抗体、蛋白质及酶的互作
2.2.1 Hg2+与抗体的互作 经典的抗原-抗体生物传感器以抗体作为识别元件,利用了抗原-抗体的特异性结合性质。受限于自身的粒径,金属离子往往作为半抗原,需要与配体螯合才能被抗体识别[28]。此外,由于抗体对环境要求苛刻,在实际样品检测中可能产生不可逆的变性,因此已逐渐被化学传感器及其他生物传感器所替代。
2.2.2 Hg2+与蛋白质的互作 MerR是一种转录调节蛋白,控制多种金属离子的外排系统。MerR在溶液中以稳定的二聚体形式存在,在无目标金属离子存在的情况下,MerR可以与相应启动子序列特异性识别结合。当识别特定的目标金属离子(Hg2+)或有机分子时,与MerR蛋白结合的dsDNA的发生畸变,即该启动子的回文序列中碱基对被破坏,dsDNA解链[29]。2006 年,Wegner等[30]设计了包含了 MerR蛋白的结合序列的dsDNA序列,并将两个芘分子单体分别嵌入DNA的两条链中,位于启动子DNA序列中间被MerR蛋白识别的部位。在无Hg2+条件下,MerR蛋白与dsDNA结合,芘二聚体分子在480 nm处发射荧光。当加入Hg2+后,MerR蛋白与Hg2+结合,引发DNA畸变,在380 nm处发射芘单体荧光。该传感器的检测限为1×10-8mol/L,且在其他金属离子存在的条件下表现出有良好的选择性。
2.2.3 Hg2+与酶的互作 2007年,Frasco等[31]研究了无机汞抑制胆碱酯酶的机制。实验表明,不同的生物体中的乙酰胆碱酯酶与Hg2+作用会产生不同的作用效果。利用动力学,X射线晶体学和动态光散射等方法,证明当酶中存在对Hg2+敏感的游离的巯基时,微摩尔范围的Hg2+对胆碱酯酶会产生不可逆的抑制作用。Torpedo californica乙酰胆碱酯酶将有潜力作为检测Hg2+污染的标记物或的生物传感器组分。
2.3 Hg2+与核酸的互作
与蛋白质相比,核酸DNA易于进行化学合成且具有较低的合成成本并且高度稳定、高度可编辑。利用核酸对Hg2+检测的方法主要可以分为利用富含T碱基的DNA探针、利用DNAzyme及利用Hg2+的适配体序列3种类型。
2.3.1 Hg2+与胸腺嘧啶的互作 早在1952年,Katz[32]就发现 10-3mol/L HgCl2可以引起 DNA 溶液黏度显著降低,并于1963年提出Hg2+与胸腺嘧啶以 T-Hg2+-T 的方式结合[33]。其后,核磁共振[34-35]、紫外可见光谱[34]及X射线晶体学[36]等技术被广泛应用于胸腺嘧啶与Hg2+结合的性质的探究。圆二色谱和DNA溶解曲线证明T-Hg2+-T之间的稳定性强于A-T配对[37]。21世纪以来,研究人员利用T-Hg2+-T结构,建立了大量检测Hg2+的核酸传感器,或将该结构用于Hg2+诱捕,单核苷酸多态性(Singlenucleotide polymorphism,SNP)检测等[38]。随着对核酸与Hg2+互作性质的深入探究发现,除胸腺嘧啶外,其他碱基也可以与Hg2+结合形成特定的结构。Ono等[39]发现具有T-C错配的双链在加入Hg2+后,一定程度上也能形成稳定的双链结构。
2.3.1.1 基于T-Hg2+-T结构的光学传感器 2004年,Ono等[39]设计了最早的基于T-Hg2+-T结构的寡脱氧核苷酸(ODN)的传感系统。如图4所示,核酸序列D-ODN-F的3′端和5′端上分别标记了荧光基团(Fluorescein,F)和猝灭基团(Dabcyl,D)。寡核苷酸序列由富含胸腺嘧啶的Hg2+结合序列和连接序列两部分组成。在Hg2+存在下,胸腺嘧啶残基与Hg2+结合,连接ODN的结合序列,形成末端标记相互靠近的发夹结构。这个过程中,F和D间发生荧光共振能量转移(Fluorescence resonance energy transfer,FRET),相对于无Hg2+状态下的线性结构,发夹结构的荧光被显著猝灭,形成“关”型核酸传感器。该传感器的检测限(LOD)为 4×10-8mol/L,并在(4.0-10.0)×10-9mol/L范围内,荧光强度与Hg2+的浓度存在良好的线性关系。由于T和Hg2+之间的作用具有特异性,该传感器不易受到其他重金属离子的干扰,但该方法的灵敏度较差,检测限远高于美国环境环保署对饮用水中Hg2+浓度的限制,且若体系中存在其他类型的猝灭剂,该传感器可能出现假阳性结果。
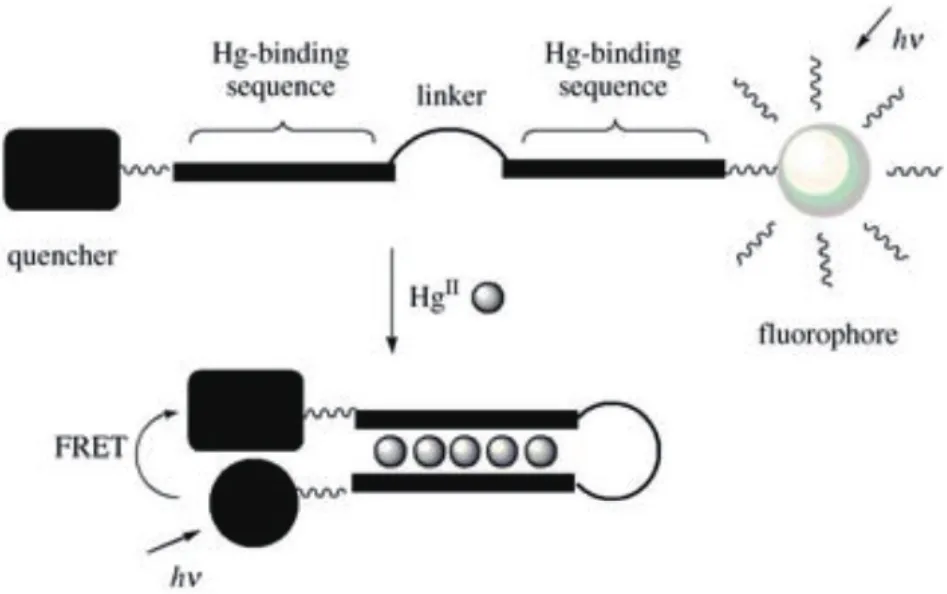
图4 T-Hg2+-T结构促发发夹结构形成示意图[39]
为了解决这些问题,此后利用T-Hg2+-T结构搭建的核酸传感器通过循环放大或改变信号输出方式等增强传感器的灵敏度。2017年,Lee等[40]通过指数链替代方式实现Hg2+的灵敏检测。如图5所示,该核酸传感器依赖于Hg2+触发的eSDA,通过Hg2+的循环使用和SDA I、SDAⅡ两个循环,使Hg2+的检测限降低至2.95×10-12mol/L,并成功实现了自来水中Hg2+的检测。
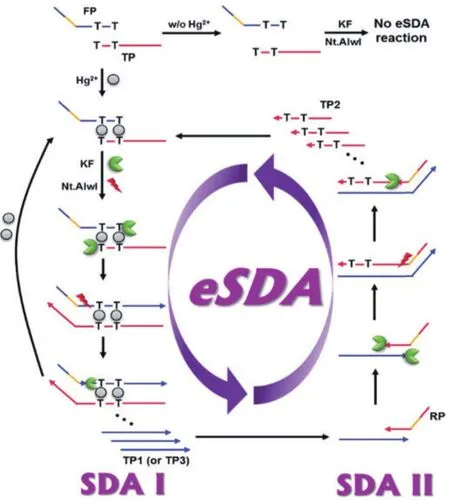
图5 基于eSDA循环的Hg2+检测示意图[40]
在基于T- Hg2+-T结构设计的检测Hg2+的光学传感器中,还有一大类用到了核酸修饰的金纳米颗粒。AuNPs在核酸生物传感器中的作用常常是作为一个平台嫁接DNA的自组装层和参与信号转化[41]。基于单链DNA(ssDNA)与AuNPs表面的静电吸引作用,卷曲的ssDNA可以在高离子强度的溶液中稳定AuNPs胶体,使溶液保持红色。利用Hg2+对核酸链中T碱基对的亲和性,通过形成稳定的T-Hg2+-T结构,实现ssDNA向双链DNA(dsDNA)的转化。近年来,检测Hg2+的核酸传感器在此基础上又有新的发展。AuNPs常与电化学或荧光法结合在一起以提高反应的灵敏度。
Yu等[42]建立了基于杂交链反应(HCR)和AuNPs检测Hg2+的高灵敏荧光比色/双模传感器(图6)。该传感器中,AuNPs不但可以作为光学信号的输出元件,还具猝灭荧光信号的作用。基于HCR放大效应,该核酸传感器的检测限达到1×10-9mol/L。此外,比色法与荧光法相结合还可增加传感器的使用范围。其他基于金的纳米材料,如AuNRs和AuNSs等也用于Hg2+的检测。Wang等[43]在富含胸腺嘧啶DNA存在的条件下实现了GNRs端到端的组装。该方法的线性区间为1-15×10-6mol/L。
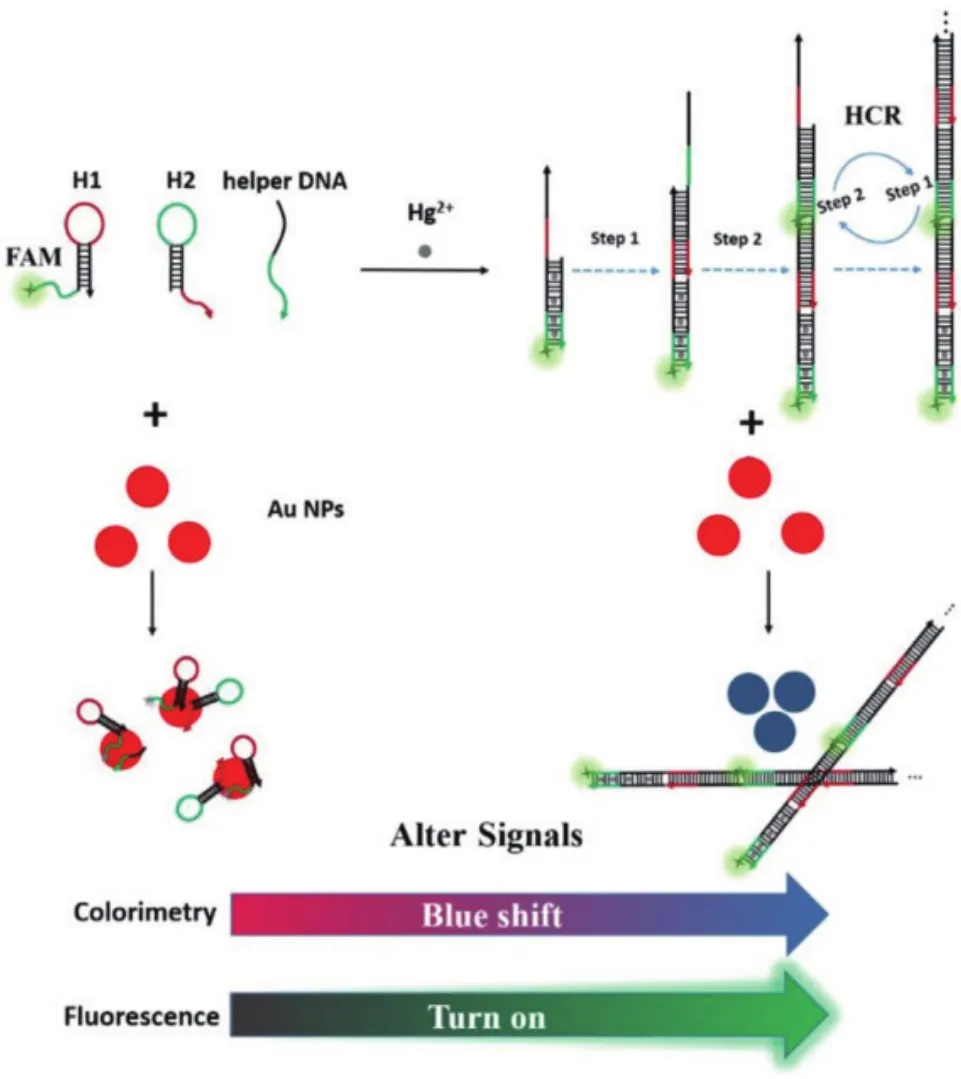
图6 基于AuNPs和HCR的Hg2+荧光传感器示意图[42]
金纳米星(AuNSs)与表面增强拉曼光谱(SERS)结合也可以实现Hg2+的检测[44]。在Hg2+存在的条件下,Hg2+与ssDNA 中的T-T碱基对自组装形成AuNS二聚体结构。表面增强拉曼光谱的信号取决于AuNS二聚体自组装的程度。该方法在Hg2+浓度为0.002-1 ng/mL的范围内呈线性关系,其检测限为0.8 pg/mL(图 7)。
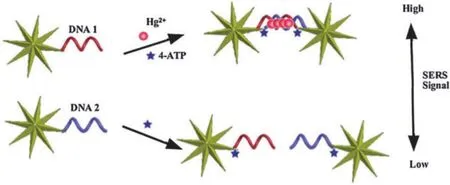
图7 基于金纳米星二聚体的Hg2+检测示意图[44]
2.3.1.2 基于T-Hg2+-T结构的电化学传感器 与其他方法相比,电化学法具有选择性较好,分析速度快,简便廉价,易于实现自动化等特点。检测Hg2+的电化学传感器往往利用T- Hg2+-T结构引起DNA结构变化而导致的电信号变化来实现Hg2+的定量检测。Qiu等[45]将AuDENs与电化学结合,通过血糖仪的信号输出,建立了turn-on的Hg2+核酸传感器,实现了Hg2+的灵敏检测。该方法的检测限为4.2×10-12mol/L,并在 1.0×10-11mol/L-1×10-7mol/L nmol 之间存在良好的线性关系。Xiong等[46]利用富T的发夹DNA探针建立了双信号的电化学比率传感器(图8)。该检测方法得到Hg2+浓度线性范围为5×10-10mol/L-5.000×10-6mol/L,检出限为 8×10-11mol/L,远低于美国环境环保署对饮用水中Hg2+浓度的限制。更重要的是,在体系中加入半胱氨酸和Mg2+可以使该电化学生物传感器实现循环利用。
Xie等[47]在电化学中引入末端脱氧核苷酸转移酶(Terminal deoxynucleotidyl transferase,TdT) 和Nt. BbvCI剪切酶实现了信号的循环放大,进一步降低了Hg2+的检出限。如图9所示。在Hg2+的存在下,富胸腺嘧啶的DNA(HP1)可以部分折叠成双链结构通过并暴露出其黏性末端。该黏性末端与3′-PO4修饰且固定在电极表面HP2形成双链。Nt. BbvCI识别双链中的切割位点,将杂交复合体中的HP1从电极中释放出来。伴随着酶的切割过程,HP2的3′-OH被暴露,借助TdT酶和dATP延伸形成带负电荷的DNA单链。在静电作用下,ssDNA与带正电的Ag+结合,在加入硼氢化钠还原剂后,金属银可原位沉积在电极表面并输出电化学信号。在最佳条件下,该核酸传感器的检测限达到3×10-12mol/L,在实际中也有很好的应用前景。
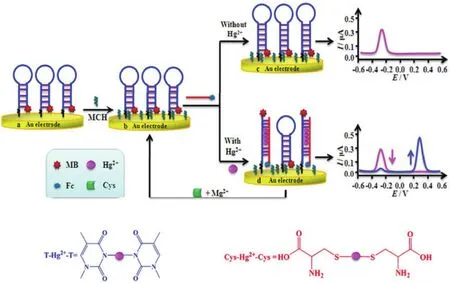
图8 比率电化学传感器检测Hg2+示意图[46]
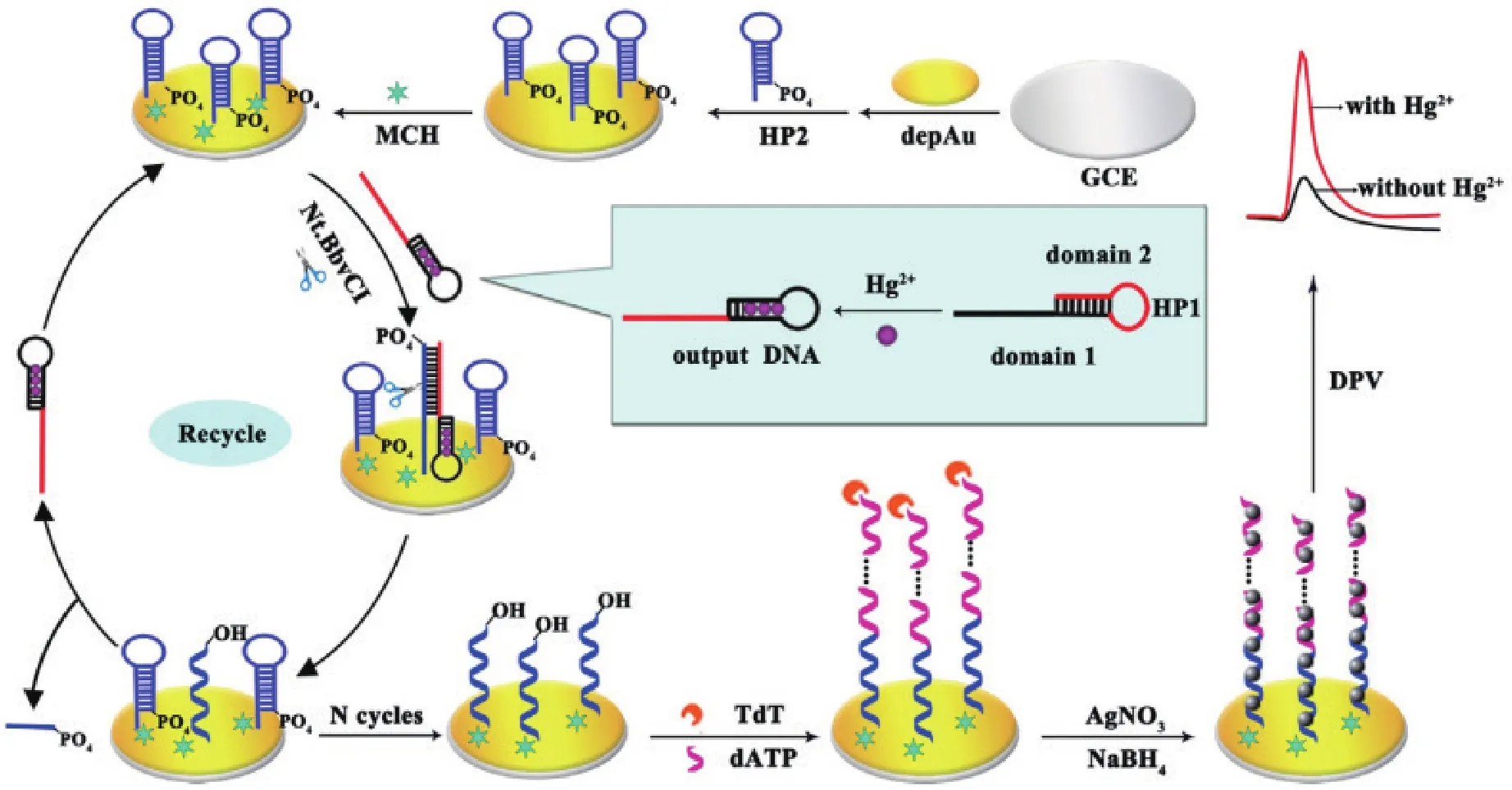
图9 基于原位沉淀AgNPs与聚合酶介导的循环放大反应检测Hg2+示意图[47]
2017年,Amiri等[48]利用电化学的方法,建立了高选择性的非标记适配体传感器,进一步提高了电化学传感器的灵敏度,实现了zmol 级别的Hg2+检测,并宣称向实现单原子检测的梦想更近了一步。如图10,巯基标记的ssDNA通过Au-S相互作用自组装在金电极的表面。ssDNA与其互补的cDNA序列的结合,或加入Hg2+后双链的解构,这两种信号均通过[Fe(CN)6]3-/4-氧化还原探针利用微分脉冲伏安法(DPV)检测出来。在这个传感器中,Hg2+与T碱基形成T-Hg2+-T结构是实现特异性检测的关键。该传感器的检测范围是5×10-15mol/L-5.5×10-11mol/L,检测限为6×10-16mol/L。
2.3.2 Hg2+与脱氧核酶的互作 1981 年,Cech 等[49]发现了RNA的催化活性,并将其命名为核酶(Catalytic RNA,RNAzyme,ribozyme)。核酶催化细胞内的多种反应,如对靶标RNA进行切割,从而控制基因的表达[50]。自然状态下,受限于刚性双链结构,DNA并没有表现出类似的催化活性[51]。1994年,合成第一个具有活性的脱氧核酶(Catalytic DNA,DNAzyme,deoxyribozyme)[52]。脱氧核酶能催化许多反应,包括催化RNA和DNA的切割和连接[52-54],化学修饰[55]等。我们将常见的DNAzyme按功能分为类过氧化物DNAzyme和依赖金属离子的DNAzymes。
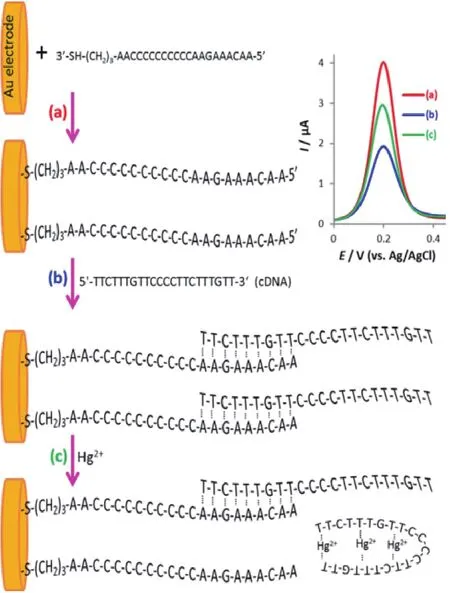
图10 利用适配体检测Hg2+的电化学传感器示意图[48]
利用DNAzyme实现Hg2+的检测主要有3种基本思路。第1种利用G-四链体结构,即富含鸟嘌呤的DNA序列结合hemin(氯高铁血红素)形成具有过氧化物酶的活性DNAzyme,在 H2O2存在的条件下,将ABTS2-氧化产生可溶的绿色产物ABTS-从而实现可视化检测;第2种利用通过SELEX筛选技术得到的以Hg2+作为辅因子的DNAzyme对含有RNA的底物链进行切割,通过对切割产物的检测实现对Hg2+的检测;第3种即利用对其它金属离子具有特异性的DNAzyme,通过增加T-T错配或修饰碱基,或通过对底物链的改性,实现对Hg2+的识别。
作为一种非常规的DNA立体结构,由富G序列构成的G四链体具有特殊的物理化学性质。在核酸传感器中,G四链体往往被用作免标记的信号输出单元。G-四结构用于检测包括金属离子在内的小分子技术已经相当成熟和完善[56]。多数利用G-四链体核酶检测Hg2+的方法仍用到了T-Hg2+-T这一结构。其基本原理在富G序列中引入T-T错配位点,由Hg2+指导G-四链体空间结构的形成。由于G-四链体催化显色反应的能力与其空间结构密切相关,从而实现Hg2+的检测。例如,Li等[57]设计了含有T碱基的寡核苷酸AGRO100作为识别Hg2+和催化显色反应的核酶。在无配位阳离子时,AGRO100呈现柔软的单链结构。在加入K+后,该核酸序列结合氯高铁血红素形成具有过氧化物酶活性的Hemin-G-quadruplex。若调整金属离子的加样顺序,即在K+之前先加入Hg2+,由Hg2+介导形成的T-Hg2+-T结构将抑制AGRO100折叠形成G-四链体,此时Hemin-G-quadruplex不能形成,不能催化H2O2-ABTS反应。这个过程通过紫外-可见吸收光谱法进行表征。该方法的检测限为5.0×10-8mol/L,并具有良好的特异性。
多数天然核酶在碱性金属离子或过渡金属粒子存在的情况下具有活性。金属离子在核酶中的作用主要有两个,一是帮助DNA或RNA形成功能化的结构;二是直接参与化学反应。2007年,Vannela等[58]通过体外筛选得到了具有RNA切割活性、以Hg2+为辅因子的DNAzymes。筛选得到的核酸分子在序列上展现出惊人的相似性。27条独立的序列按照序列的相似性被分为3类。其中,16条被划分在Family-Im中,共同含有AATTCCGTAGGTCCAGTG保守序列。Family - IIm和IIIm中分别包含7和4条序列。当汞浓度为500 μmol/L时,DNAzyme的切割效率最大。
2008年,Hollenstein等[59]筛选出经修饰的DNAzyme 10-13实现了Hg2+的检测。其结构如图11所示。利用咪唑基与Hg2+互作的性质确保Hg2+的螯合和催化反应的发生。经修饰的DNAzyme 10-13的速率常数Kobs为(0.037±0.002)min-1(Hg2+的浓度为5 mmol/L)。在没有任何二价金属离子或仅有氯化镁时,DNAzyme 10-13在42 h内没有表现出明显的(<10%)切割,具有良好的选择性。
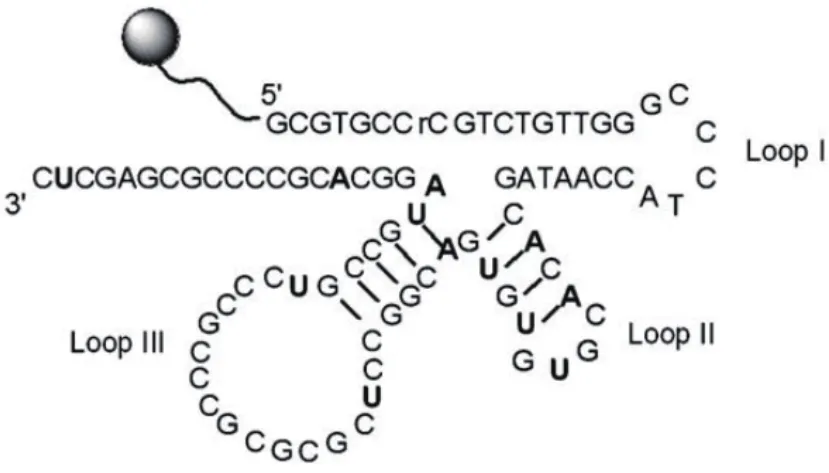
图11 特异性识别Hg2+的DNAzyme 10-13序列及结构示意图[59]
虽然以Hg2+作为辅因子切割RNA的DNAzyme已有报道,但由于该种类型的核酶易受到其他金属离子,尤其是Cu2+和Zn2+的干扰,为了提高检测的特异性,基于经过修饰或改性的其他金属离子DNAzyme生物传感器应运而生。这些DNAzyme包括39E,Ce13d、GR5及17E等。
2007年,Liu等[3]将金属离子与DNAzyme的结合位点与荧光信号分开标记,以39E DNAzyme(特异性识别UO22+)为前体,利用T-T错配识别Hg2+,设计并优化了EHg5T DNAzymes,实现了Hg2+的定量检测(图12)。由于39E只有在UO22+存在时才有活性,而UO2
2+与其他常见的金属离子不同,在自然环境中,其离子强度很低,因此该核酶受到的干扰很小。EHg5T DNAzymes中包含了5个T-T错配,相比较没有加入Hg2+的阴性对照组,阳性组在加入Hg2+后,酶活性明显的增强,其速率常数为 0.61 min-1。
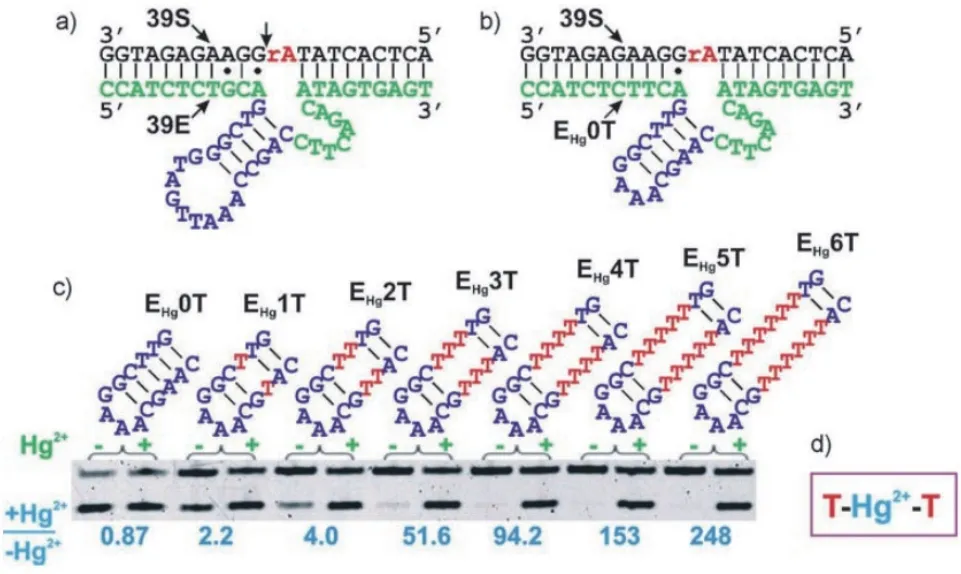
图12 T-Hg2+-T介导的特异性DNAzyme结构示意图[3]
提高DNA与Hg2+亲和性的方法从上述传感器中可见一斑:一是在核酸序列中引入多个T碱基,通过T-Hg2+-T结构捕获Hg2+;二是在DNA序列中引入特殊的修饰碱基。这两种方法都存在一定的缺陷:T-Hg2+-T结构的形成易受环境中的离子成分(尤其是Cl-)的干扰;而特殊的修饰碱基往往难以商业合成或价格昂贵[60]。基于此,Huang和Liu等[61]设计了同时检测多种金属离子的DNAzyme传感器。为增加核酸与Hg2+的亲和性,他们在DNA中引入硫元素,即采用硫代磷酸酯(PS)修饰DNA底物链,将磷酸二酯键(PO)中的非桥接氧原子替换为S原子,从而增加DNAzyme对巯基金属如Hg2+,Cd2+,Pb2+的亲和力。对于PS底物链,Ce13d、GR5、17E及39E DNAzyme均表现出与PO底物链不同的性质,其特异性识别的金属离子如表1所示。
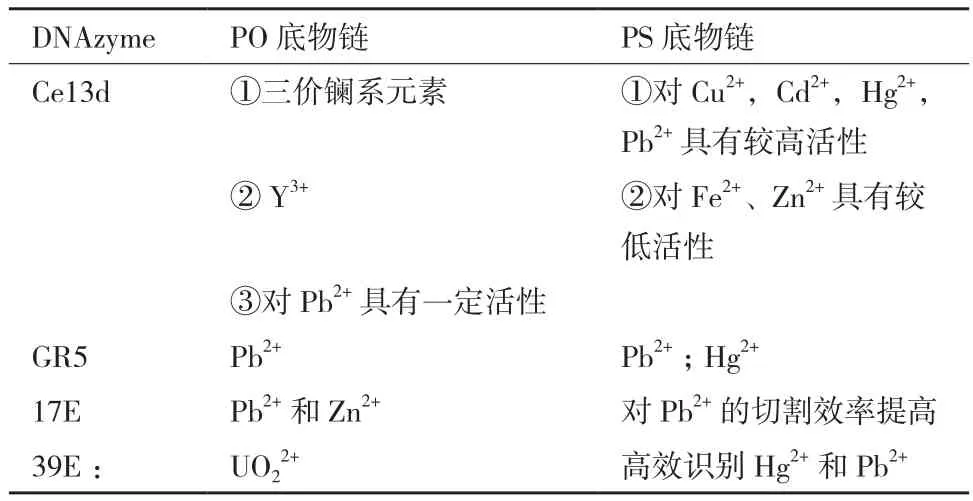
表1 GR5、17E以及39E DNAzyme对PO、PS底物链切割性质差异
通过Ce13d和GR5对PS和PO底物链切割活性不同设计如图13的金属离子筛选阵列,最终将金属离子分为3类:不能使Ce13d发挥活性的Mg2+、Mn2+及Fe2+等过渡金属;在Ce13d作用下,对PO底物链切割效率更高的镧系和Y3+金属离子和对PS底物链切割效率更高的Cd2+,Hg2+,Pb2+亲硫金属。对Cd2+、Hg2+和Pb2+的一步筛选则由GR5 DNAzyme完成。该阵列可实现对多种金属离子的筛选和对Cd2+、Hg2+和Pb2+的定量检测,具有良好的灵敏度和特异性。
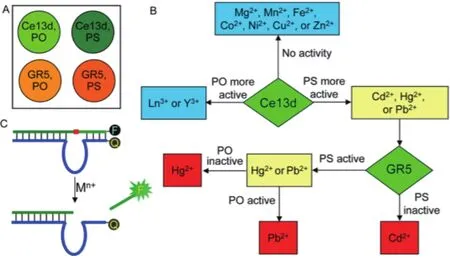
图13 利用Ce13d、GR5 DNAzymes检测Hg2+,Pb2+,Cd2+流程示意图[61]
3 其他检测Hg2+的方法
3.1 Hg2+介导的脱硒、水解反应
之前介绍的许多生物传感器利用了Hg2+与S原子或N原子的共价或非共价亲和性。然而,S和N原子经常被用作选择性识别的反应位点,很多金属离子如Cu2+、Zn2+、Ni2+及Pb2+等可能会对上述传感器产生干扰。为了提高传感器的特异性,Hg-Se相互作用也被用于搭载Hg2+的监测传感器。2009年,Tang等[62]设计了有机硒荧光探针(FSe-1),该荧光探针可与Hg2+发生不可逆的脱硒反应,并对Hg2+表现出高的灵敏度和选择性。FSe-1的合成及其与Hg2+发生脱硒反应的原理如图14所示。脱硫反应的最终结果是产生荧光素Hg-Se。该反应的最低检出限为1.0×10-9mol/L,并实现了RAW 264.7 细胞中(小鼠巨噬细胞株)Hg2+的检测。
同年,Santra等[63]利用Hg2+促进荧光素衍生芳基乙烯基醚水解的性质,建立了一种对甲基汞和无机汞离子特别敏感的荧光探针,解决了多数传感器不能检测甲基汞,或对甲基汞灵敏度较低的问题。其中,探针1的设计是基于汞离子促进的乙烯基醚1的水解反应,其反应路径为乙烯基醚1羟汞化生成相应的半缩醛中间体,后者分裂形成乙醇2和乙醛3。Hg2+促进乙烯基醚的水解反应在甲基汞(CH3HgX)存在时也能发生。乙烯基醚1的荧光信号非常弱,而乙醇2可以产生强烈的荧光信号。该反应可以实现水溶液中甲基汞和无机汞离子的检测。
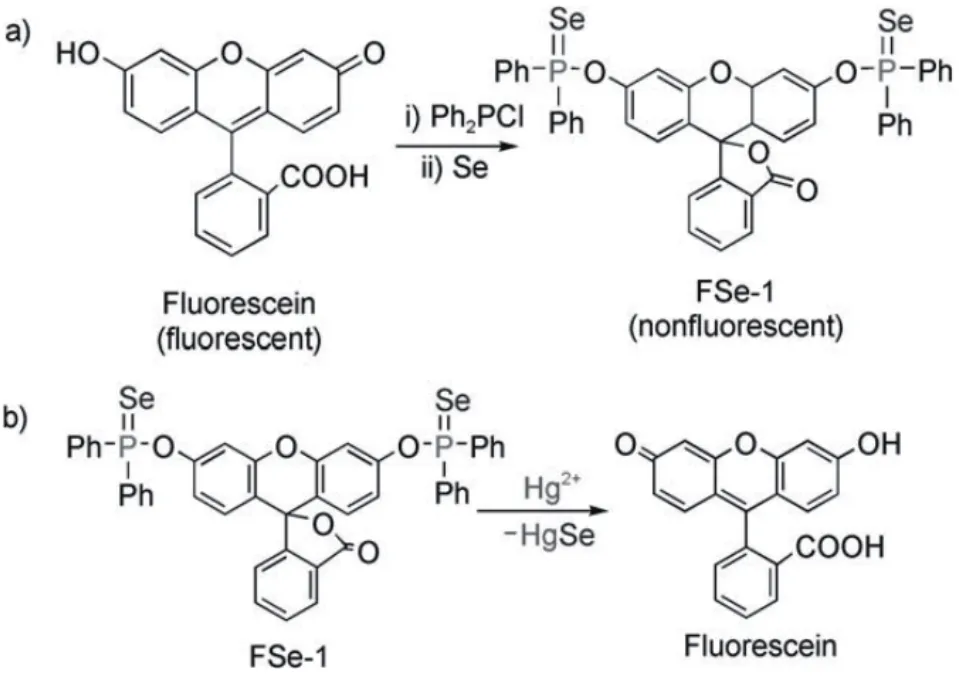
图14 FSe-1与Hg2+发生脱硒反应示意图[62]
3.2 利用转基因微生物检测Hg2+
微生物传感器的设计原理是将受严格调控的启动子连接到一个敏感的报告基因上。在环境中发现的该类型的启动子多来源于生活在重金属以及有机化合物污染条件下的细菌中。能够在受污染的环境中生存的细菌,其基因常会编码的抗性系统,且抗性系统的基因受到严格的调控。Virta等[64]利用于转基因微生物设计了检测Hg2+的生物传感器。在该传感器中,转座子Tn21的mer启动子控制萤火虫荧光素酶基因,萤火虫荧光素酶基因作为报告基因,大肠杆菌MC1061作为宿主。实验结果表明,在1×10-19mol/L-1×10-12mol/L的区间内,所产生的荧光信号强度与Hg2+的浓度有关。该方法的最低检出浓度为1×10-16mol/L,且即使在其他离子超Hg2+百万倍的浓度条件下,对Hg2+的测量结果不会造成干扰,具有极强的特异性。
4 结语
Hg2+可随大气、海洋环流发生全球性迁移,并通过化学转化或生物转化形成强蓄积性和高危害的甲基汞,对动物、植物和人类健康产生深远的影响。因此,如何实现Hg2+的快速、灵敏检测,是科研工作者广泛关注的话题。Hg2+的检测方法经历了由仪器分析到传感器检测的发展。常用于搭载Hg2+传感器的元件包括荧光基团、核酸、纳米粒子、转基因微生物、肽、蛋白质、酶等。
Hg2+的荧光传感器分为 “关”和“开”两种类型。利用Hg2+的荧光猝灭性质或利用Hg2+与特殊基团互作产生荧光,实现了Hg2+的定量检测。常用的荧光物质包括金属纳米粒子和化学基团两种。蛋白质、DNA常用于搭建检测Hg2+的生物传感器。蛋白质既包括抗体、转录调节蛋白,还包括酶。Hg2+与核酸互作的最常见形式是形成T-Hg2+-T结构,此外,DNA可作为脱氧核酶催化DNA、RNA等物质的切割,实现Hg2+定量检测。Hg2+还可以介导水解、脱硒等反应,或作为不利的环境因素诱导微生物激活抗性基因,实现Hg2+的检测。
目前,生物传感器越来越多的取代化学传感器或仪器分析法被应用到汞离子检测中,极大地缩短了汞离子的检测时长。但常见的生物传感器检测限较高,容易受到其他金属离子的干扰,且重复性较差。因此,只有少数生物传感器用于实际样品的检测。未来可将多种类型的特异性化学基团修饰在生物传感器中,从而提高生物传感器的灵敏度和特异性。