BCG免疫对2型糖尿病小鼠血糖和免疫应答的影响①
王 辛 宁唤唤 翟佳佳 康 健 柏银兰 周 洁
(空军军医大学西京医院内分泌科,西安710032)
糖尿病(Diabetes mellitus,DM)是一组由多病因引起的以慢性高血糖为特征的代谢性疾病。目前我国成人糖尿病的患病率为10.9%[1],其中2型糖尿病(T2DM)占糖尿病患者90%以上,但其发病机制尚未阐明。研究显示T2DM是一种自身免疫性和炎症性疾病[2],是一种“慢性低度炎症状态”,认为炎症、免疫与T2DM 的发病密切相关。Duncan等[3]研究发现,唾液酸、血清黏液蛋白、白细胞介素(Interleukin,IL) 、C反应蛋白等水平升高与T2DM 的发生相关,提出“炎症学说”,即当肥胖、游离脂肪酸和晚期糖基化终末产物增加,激活天然免疫产生大量的细胞因子,如TNF-α、IL-6等,诱导胰岛β细胞凋亡和干扰胰岛素信号转导,引起胰岛素分泌减少和胰岛素抵抗,最终引起糖尿病。
卡介苗(Bacillus Calmette-Guérin vaccine,BCG)是世界范围内应用最广泛的结核病疫苗。BCG对固有免疫和适应性免疫均具有调节作用[4]:增强巨噬细胞吞噬作用,分泌趋化因子和细胞因子;促进树突状细胞(Dendritic cell,DC)活化、成熟和迁移,提高其抗原提呈能力,促进细胞因子分泌,增强细胞免疫;诱导B淋巴细胞产生大量免疫球蛋白,其中IgA促进吞噬作用,IgG增强细胞介导的细胞毒作用;刺激CD4+和CD8+T细胞增殖,CD4+T细胞分化产生大量Th1和Th2型细胞因子。BCG对免疫系统的调节作用,使其成为一种重要的佐剂,是常用的弗氏完全佐剂的主要成分。在临床上,卡介苗灌注治疗已成为浅表性膀胱癌最重要的免疫疗法[5]。
研究显示,1型糖尿病(T1DM)患者接种BCG后,可诱导TNF-α产生,使自身反应性T细胞选择性死亡,并促进调节性T细胞增殖,有助于修复胰岛细胞,促进胰岛素分泌[6]。目前在国外已经进入1期临床试验阶段[7]。BCG免疫对2型糖尿病的免疫调节作用未见报告,本文探究BCG免疫对小鼠2型糖尿病模型的血糖和免疫应答的影响,为2型糖尿病防控提供新思路。
1 材料与方法
1.1材料
1.1.1实验动物及分组 4周龄SPF级C57BL/6J雄性小鼠24只,购于空军军医大学(原第四军医大学)动物实验中心。小鼠随机分为4组(n=6):正常对照组(Normal)、糖尿病组(DM)、免疫组(BCG)、免疫糖尿病组(BCG+DM)。
1.1.2菌株 将BCG(ATCC 35734)接种于7H9培养液中,在37℃培养3周,收集细菌沉淀,保存于-80℃。使用前采用平板计数法计算活菌数,重复3次。
1.1.3试剂与仪器 链尿佐菌素(Streptozotocin,STZ)购于美国Sigma公司。血糖仪及试纸为德国罗氏的卓越型血糖检测系统(检测范围0.6~33.3 mmol/L即10~600 mg/dl),超过检测上限的记录为33.3 mmol/L。小鼠高糖高脂饲料购于北京博爱港商贸中心,配方:65%小鼠维持饲料,10%猪油,20%蔗糖,2.5%胆固醇,1%胆酸钠。细胞因子ELISA检测试剂盒、荧光标记的抗CD4 mAb、抗CD8 mAb为美国ebiosicence产品。
1.2方法
1.2.1BCG免疫 免疫组小鼠采用尾静脉注射方法接种BCG,剂量为5×104CFU/100 μl/只;对照组注射 100 μl生理盐水。
1.2.22型糖尿病小鼠模型的建立[8]BCG免疫6周后,糖尿病组、免疫糖尿病组喂高糖高脂饲料。高糖高脂饲料喂养6周后,正常对照组、糖尿病组及免疫糖尿病组小鼠禁食不禁水14 h,正常对照组小鼠腹腔注射柠檬酸缓冲液,糖尿病组及免疫糖尿病组小鼠腹腔注射STZ 50 mg/kg体重,连续注射3 d。1周后,小鼠尾静脉采血测量随机血糖3次,血糖值大于11.1 mmol/L的小鼠表明模型建立成功。糖尿病组、免疫糖尿病组小鼠继续喂养高糖高脂饲料12周。观察小鼠一般状况,每周测量小鼠体重。
1.2.3空腹血糖 每间隔2周各组小鼠禁食不禁水8 h,尾静脉采血,使用罗氏血糖仪检测小鼠空腹血糖水平。
1.2.4口服葡萄糖耐量试验(Oral glucose toleran-ce,OGTT)[9]小鼠禁食不禁水14 h,尾静脉采血测量空腹血糖(0 min)后,按 2 g/kg体重葡萄糖溶液灌胃,记录30 min、60 min及120 min时血糖值。
1.2.5小鼠脾淋巴细胞分离及体外刺激培养 无菌分离小鼠脾脏,加入4 ml RPMI1640培养液,研磨成匀浆,1 500 r/min离心5 min,弃上清,加入ACK红细胞裂解液 5 ml裂解2 min后,加入5 ml RPMI1640培养液,充分混匀,终止裂解,1 500 r/min离心5 min,细胞沉淀加入5 ml RPMI1640培养液洗涤并离心后,用含10%FCS的RPMI1640完全培养液重悬细胞,3%台盼蓝染色并计数。调整细胞浓度为107个/ml,接种96孔板100 μl/孔。实验组分别加入刺激抗原BCG菌体蛋白100 μl(终浓度为25 μg/ml)、ConA 100 μl(终浓度为3 μg/ml),对照组加入100 μl RPMI1640完全培养液。
1.2.6小鼠脾淋巴细胞增殖实验 脾淋巴细胞分离和抗原刺激同上,BCG抗原刺激组培养68 h、ConA抗原刺激组培养44 h时,分别加入20 μl/孔的MTS(5 mg/ml),继续培养4 h,酶标仪检测OD490。脾淋巴细胞增殖指数SI=OD490(实验组-空白对照)/ OD490(阴性对照-空白对照)。
1.2.7小鼠脾淋巴细胞CD4+与CD8+T细胞所占百分比的分析 取2×106个无菌分离的小鼠脾淋巴细胞,加入PE标记的抗CD4 mAb及FITC标记的抗CD8 mAb,避光4℃孵育30 min,PBS洗涤2 次。200 μl 固定液固定,流式细胞术检测CD4+与CD8+T细胞百分比。
1.2.8脾淋巴细胞因子分泌水平检测 BCG抗原刺激组培养72 h,ConA抗原刺激组培养48 h后,收集各组抗原刺激后的脾淋巴细胞培养上清,ELISA试剂盒分别检测上清中细胞因子的含量。按照说明书提前一天包被需检测的抗体,100 μl/孔,4℃过夜,PBST洗涤,加入封闭液200 μl/孔,室温孵育1 h,加入待检测样品和标准品100 μl/孔,室温孵育2 h,PBST洗涤,加入生物素标记抗体工作液100 μl/孔,室温孵育1 h,PBST洗涤,加入辣根过氧化物酶标记亲和素工作液100 μl/孔,室温孵育30 min,PBST洗涤,加入TMB显色液100 μl/孔,待颜色出现变化,立即加入终止液,用酶标仪检测OD450。
1.3统计学方法 利用SPSS18.0统计软件进行分析,多组数据比较用单因素方差分析,两组比较用t检验,P<0.05时具有统计学意义。
2 结果
2.1体重 糖尿病组、免疫组和免疫糖尿病组小鼠一般状况观察:进食、饮水和活动与正常组小鼠相比无显著异常。小鼠体重均呈上升趋势,各组间差异差异无显著统计学意义(图1)。
2.2空腹血糖 在13周时糖尿病组小鼠和免疫糖尿病组小鼠随机血糖超过11.1 mmol/L,表明造模成功(图2A)。糖尿病组小鼠14周空腹血糖显著升高,达到(14.70±2.03)mmol/L(P<0.001),高血糖水平持续到24周(15.63±3.90)mmol/L。免疫糖尿病组小鼠空腹血糖在14周达到高峰,为(7.85±0.81)mmol/L,但其峰值仅是糖尿病组的53%。24周空腹血糖降至(4.33±0.52)mmol/L,显著低于糖尿病组(P<0.01)。正常对照组和免疫组空腹血糖无明显升高(P>0.05)(图2B)。
图1 小鼠体重变化Fig.1 Body weight changes of mice
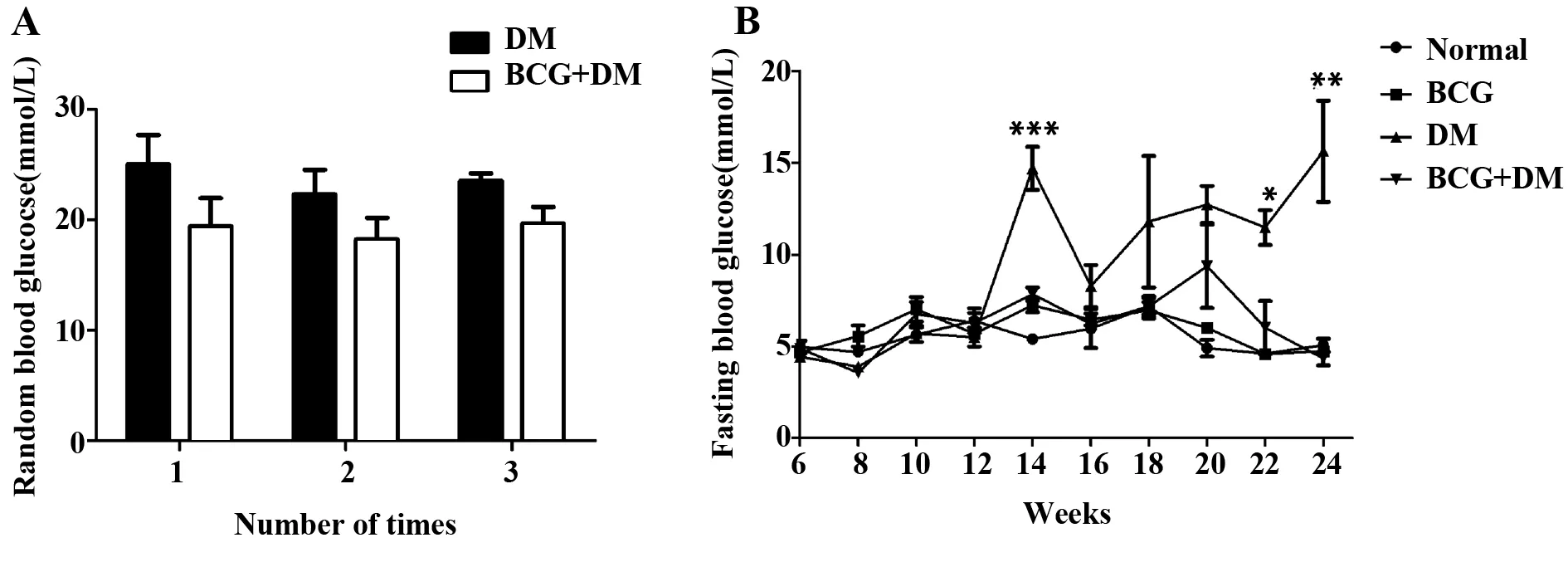
图2 小鼠随机血糖和空腹血糖变化Fig.2 Random blood glucose and fasting blood glucose changes in miceNote: A.Random blood glucose in mice at 13 weeks;B.Fasting blood glucose in mice.DM group compared with BCG+DM group,*.P<0.05,**.P<0.01,***.P<0.001.
2.3口服葡萄糖耐量(OGTT)试验 24周进行OGTT试验,糖尿病组小鼠空腹血糖为(15.63±3.90)mmol/L, 葡萄糖溶液灌胃后血糖立即上升,120 min后血糖仍高达(24.57±1.33)mmol/L, 显著高于正常对照组(P<0.001)。免疫糖尿病小鼠空腹血糖与正常对照组持平,葡萄糖溶液灌胃30 min后有升高趋势,但是与正常对照组无差异;灌胃60 min后高于正常对照组(P<0.01),120 min后虽然仍高于正常对照组(P<0.05),但显著低于糖尿病组(P<0.05);表明BCG免疫抑制糖尿病小鼠空腹和糖负荷后的血糖水平。免疫组小鼠血糖与正常对照组无明显差异(P>0.05),表明BCG免疫对正常小鼠糖负荷后的血糖水平不产生影响(图3)。
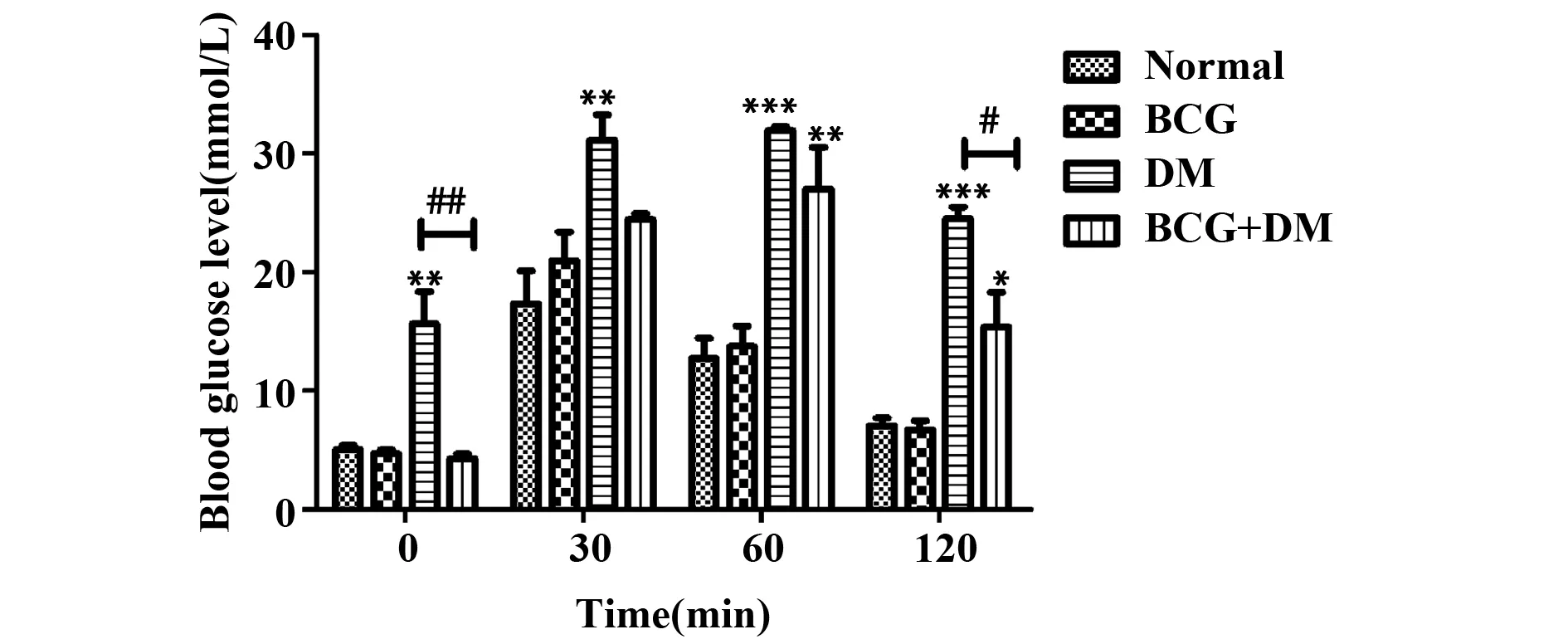
图3 小鼠口服糖耐量试验结果Fig.3 Results of oral glucose tolerance test in miceNote: Compared with normal group,*.P<0.05,**.P<0.01,***.P<0.001;comparison of tagged groups, #.P<0.05,##.P<0.01.
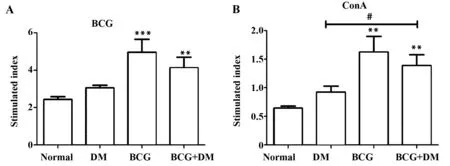
图4 各组小鼠脾淋巴细胞增殖指数(SI)Fig.4 Spleen lymphocytes proliferation of mice(SI)Note: A.Stimulated index(SI) of splenic lymphocytes stimulated by BCG protein;B.Stimulated index(SI) of splenic lymphocytes stimulated by ConA protein.Compared with normal group,**.P<0.01,***.P<0.001;comparison of tagged groups, #.P<0.05.

图5 小鼠脾淋巴细胞CD4+与CD8+T细胞所占百分比Fig.5 Percentages of CD4+ and CD8+ T cells in splenic lymphocytesNote: Compared with normal group,**.P<0.01,***.P<0.001;comparison of tagged groups, #.P<0.05,##.P<0.01.
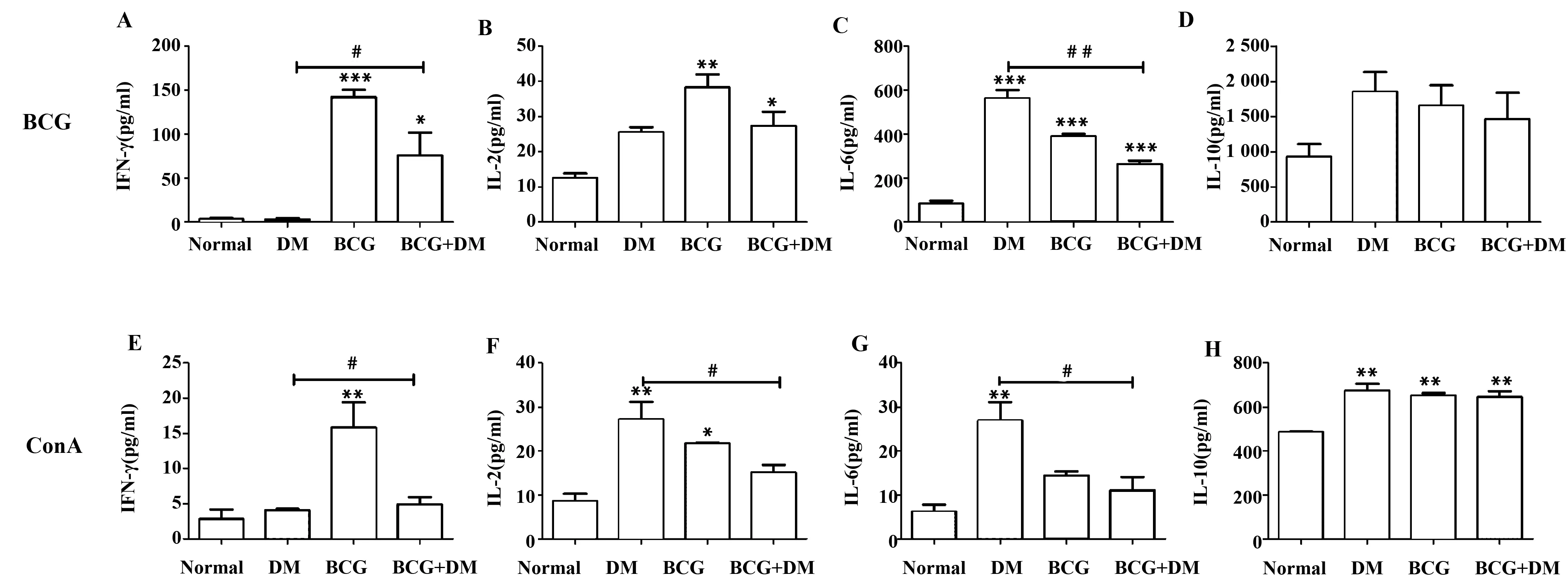
图6 各组小鼠脾淋巴细胞细胞因子分泌水平Fig.6 Cytokines production of mice splenic lymphocytesNote: A-D.Splenic lymphocytes stimulated by BCG protein;E-H.Splenic lymphocytes stimulated by ConA protein.Compared with normal group,*.P<0.05,**.P<0.01,***.P<0.001;compared of tagged groups, #.P<0.05,##.P<0.01.
2.4小鼠脾淋巴细胞增殖 BCG、ConA抗原刺激后,与正常小鼠相比,免疫组和免疫糖尿病组小鼠脾淋巴细胞增殖差异均有显著统计学意义(P<0.01);ConA刺激下,免疫糖尿病组脾淋巴细胞增殖显著高于糖尿病组(P<0.05)(图4)。
2.5小鼠脾淋巴细胞CD4+T细胞与CD8+T细胞所占百分比 与正常组相比,免疫组和免疫糖尿病组小鼠CD4+T细胞和CD8+T细胞百分比显著升高(P<0.01),CD4+T细胞与CD8+T细胞之和亦显著升高(P<0.01)。免疫糖尿病组显著高于单纯糖尿病组(P<0.05)。而各组间CD4+T细胞与CD8+T细胞比值无明显变化(图5)。
2.6脾淋巴细胞因子分泌水平 BCG抗原刺激后,免疫组及免疫糖尿病组小鼠脾淋巴细胞Th1型细胞因子IFN-γ分泌显著高于正常对照和糖尿病组(P<0.001,P<0.05)。ConA抗原刺激后,免疫糖尿病组小鼠脾淋巴细胞IL-2分泌显著低于糖尿病组(P<0.05)。BCG、ConA抗原刺激后,糖尿病组小鼠脾淋巴细胞分泌Th2型细胞因子IL-6显著增加(P<0.001,P<0.01),与之前研究糖尿病患者血清中IL-6显著升高相一致[10],而BCG免疫糖尿病小鼠IL-6水平显著低于糖尿病组(P<0.05)。各组间IL-10分泌水平差异无统计学意义(P>0.05)(图6)。
3 讨论
小鼠模型是研究T2DM发病机制常用的动物模型。本研究采用高糖高脂饮食联合多次低剂量腹腔注射STZ方法构建2型糖尿病模型:通过高糖高脂饮食诱导小鼠胰岛素抵抗后,再注射低剂量STZ损伤胰岛功能,引起血糖升高,模拟T2DM的发病过程[11]。该方法是目前国内外制作糖尿病动物模型最常用的方法[12]。本研究中糖尿病组和免疫糖尿病组小鼠均在13周成模,整个实验观察期间,糖尿病组小鼠始终维持高血糖状态。该造模方法操作简单,成模率高,而且STZ对胰岛β细胞有特异性杀伤作用,因此该模型也可用于糖尿病发病机制的研究。
T2DM是一种自身免疫性和低度炎症性疾病[13],其特征性的促炎性细胞因子释放,如TNF-α、IL-6、IL-1β等共同作用产生细胞毒性,诱导胰岛β细胞凋亡;同时炎症因子干扰胰岛素信号转导的丝氨酸/苏氨酸激酶如c-JUN氨基末端激酶(JUK)、核因子(NF-κB)抑制物激酶(IKK)等,导致胰岛素抵抗。在T2DM发病机制中IL-6是一个重要的炎性因子,其低峰度表达时促进胰岛素分泌[14],高峰度表达时则会损伤胰岛β细胞,诱导TNF-α、IL-1β、IL-2产生增加[15,16],激活caspase通路和NF-κB通路促进细胞凋亡[17,18],从而损伤胰岛细胞,减少胰岛素分泌。此外,IL-6增加脂肪细胞的脂肪分解和游离脂肪酸的释放,从而破坏线粒体和葡萄糖转运蛋白2(GLUT2)的功能,进而使胰岛素敏感性降低[19]。研究发现,糖尿病组小鼠脾淋巴细胞分泌IL-6、IL-2均较正常对照组有所升高,尤其是IL-6显著升高(图6),证明T2DM发病机制确实与免疫反应及炎症相关。
BCG为减毒活疫苗,具有很强的非特异性免疫刺激作用,可刺激CD4+T和CD8+T细胞增殖,同时是一种Th1型免疫反应的诱导剂,它可刺激Th1淋巴细胞的发育和大量巨噬细胞聚集、活化,抑制Th2型免疫反应。本研究发现BCG免疫可使糖尿病小鼠脾淋巴细胞增殖增加,CD4+和CD8+T细胞同时增高,Th1型典型细胞因子IFN-γ分泌增加,而Th2型细胞因子IL-10不升高。值得注意的是,BCG免疫可抑制糖尿病组Th2型细胞因子IL-6的升高,在此作用下,BCG免疫糖尿病组血糖升高幅度低于糖尿病组,不仅如此,BCG免疫糖尿病组小鼠维持高血糖的时间明显短于糖尿病组。综上,BCG免疫调节机体免疫状态,抑制了糖尿病炎性因子的升高,进而减轻了炎性因子对胰岛细胞损伤和对胰岛敏感性的影响,使血糖升高的趋势和强度减弱。
T2DM是一种免疫、炎症相关疾病,大量炎性因子参与破坏胰岛细胞功能,并在胰岛素抵抗中起到重要的作用。现已证明,糖尿病患者长时间处于高血糖状态无疑会促进多种并发症的发生发展。本研究结果显示,T2DM的发生发展与炎性因子水平相关,而BCG免疫可抑制炎性因子如IL-6的水平,减轻胰岛炎性反应和改善胰岛素抵抗,从而抑制T2DM的发生和发展。因此,本研究结果具有潜在的临床意义:BCG可作为免疫佐剂,延缓T2DM及其并发症的发生发展。BCG调节糖尿病免疫应答的具体机制值得进一步深入研究。

