下调动脉粥样硬化斑块中TRPC5的表达对人巨噬细胞凋亡的影响及机制研究
闫博阳 赵津璋 陈 虹
(黑龙江省佳木斯市中心医院,佳木斯154002)
动脉粥样硬化(Atherosclerosis,AS)是常见的一种动脉硬化类型,是引起多种心血管疾病发生的病理基础,具有发病率高、致残率高和死亡率高的特点,由其导致的心脑血管疾病已成为目前威胁人类健康及诱发死亡的一个主要疾病,且近些年的发病率和死亡率呈上升趋势[1]。巨噬细胞凋亡是引起AS斑块不稳定的主要细胞成分,在其病变过程中发挥重要作用。有研究发现,早期和晚期AS中巨噬细胞凋亡结果是不同的,在AS病变早期巨噬细胞凋亡可降低病变面积,而晚期的巨噬细胞凋亡可促进心血管疾病的发生[2,3]。有研究发现,经典瞬时受体电位(Transient receptor potential canonical,TRPC)通道调节的细胞可参与AS发生的生理病理过程,TRPC5为TRPC家族的一个成员,可参与血管平滑肌细胞(Vascular smooth muscle cell,VSMCs)细胞的增殖、收缩、迁移、肥大等病理生理过程,加速AS的发展进程[4]。巨噬细胞凋亡调控的信号具有复杂的网络体系,在氧化低密度脂蛋白(ox-LDL)等各种刺激因子作用下,丝氨酸苏氨酸激酶(Serine/threonine kinase,AKT)、丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPK)等信号均可参与调控巨噬细胞凋亡[5]。TRPC5基因对ox-LDL刺激巨噬细胞凋亡的影响还未可知。因此,本研究首先检测了AS斑块TRPC5的表达,利用RNA干扰TRPC5的表达,通过ox-LDL与TRPC5的siRNA同时处理离体培养的巨噬细胞,检测细胞的增殖凋亡情况,并检测对凋亡相关蛋白及AKT信号通路的影响。
1 材料与方法
1.1试剂与仪器 胎牛血清、RPMI1640培养基均购自美国Sigma公司;TRPC5-siRNA及NC-siRNA由上海生工合成;LipofectamineTM2000转染试剂盒、总RNA提取试剂盒、逆转录试剂盒均购自美国Invitrogen公司;实时荧光定量PCR试剂盒:Power SYBR Green PCR Master Mixg购自美国ABI公司;二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒及蛋白提取试剂盒购自美国Nerck Millipore公司;细胞计数试剂盒(Cell Counting Kit-8,CCK8)购自碧云天生物技术研究所;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙锭(PI)细胞凋亡试剂盒、流式细胞仪均购自美国BD公司;TRPC5、含半胱氨酸的天冬氨酸蛋白水解酶3(Cysteinyl aspartate specific proteinase 3,Caspase-3)、丝氨酸苏氨酸激酶(Serine/threonine kinase,AKT)、磷酸化的丝氨酸苏氨酸激酶(Phosphorylated Serine/threonine kinase,p-AKT)抗体购自美国Cell Signaling Technology;实时荧光定量PCR仪购自瑞士Roche;酶标仪购自美国Bio-Rad公司。
1.2方法
1.2.1模型建立 实验组选取SPF级5周龄的ApoE-/-小鼠52只,体重18~22 g,对照组选择相同年龄及体重范围的SPF级ApoE-/-小鼠52只,均购自南京君科生物工程有限公司。实验组小鼠采用含有15%的猪油和1%胆固醇的高脂饮食,以建立AS模型,对照组小鼠正常饲喂,饲料及饮水不限,温度18~20℃,相对湿度为40%~70%。饲喂20周后,测定血液总胆固醇含量,总胆固醇含量高出对照组6~10倍,且有AS斑块形成为建模成功,如无斑块形成则继续饲喂直至AS模型预评达标。取对照组和实验组小鼠的AS斑块组织,用于TRPC5基因表达检测。
1.2.2TRPC5基因表达检测 RNA提取试剂盒提取组织中的总RNA,反转录为cDNA,以GAPDH为内参基因,通过实时荧光定量PCR对TRPC5基因表达进行定量。TRPC5 F:5′-ACAAAAAGGTCAACTACTC-ACCG-3′,R:5′-CAGTGGCATAGTCCCCCT-TCT-3′;产物长度126 bp,GAPDH F:5′-AACTGCTTAGCAC-CCCTGGC-3′,R:5′-ATGACCTTGCCCACACAGCCTT-3′。产物长度200 bp,反应条件如下:95℃预变性30 s,1个循环,PCR反应,95℃ 5 s,60℃ 5 s,40个循环反应结束,得到Ct值,根据Ct均值,GAPDH 为内参,采用2-ΔΔCt法计算。实验重复3次。
1.2.3人巨噬细胞培养 THP-1人单核细胞株购自上海艾研生物科技有限公司;细胞在37℃,5% CO2培养箱中用RPMI1640培养基培养(含胎牛血清),根据实验需要传代。以每孔105个细胞将传4~6 代的细胞接种至6孔板中,细胞生长约90%融合时,加入浓度为1 μg/ml的PMA溶液(999 μl的DMSO中加入PMA原液1 μl),按照每孔中加入7.5 μl/ml 培养基,加入至培养基中。24 h后细胞贴壁,证实巨噬细胞诱导成功[6]。
1.2.4细胞分组及siRNA转染 细胞分为对照组、NC组、TRPC5-siRNA、ox-LDL组和TRPC5-siRNA+ox-LDL组。对照组细胞无特殊处理,NC组和TRPC5-siRNA分别转染合成的无干扰作用的siRNA及具有干扰TRPC5表达的siRNA,转染浓度为100 nmol/L,ox-LDL组加入50 μg/ml的ox-LDL,x-LDL+TRPC5-siRNA组分别加入TRPC5-siRNA及50 μg/ml的ox-LDL。细胞转染参照LipofectamineTM2000转染说明。培养箱内6 h后,更换成新的培养液继续培养。
1.2.5TRPC5、Caspase3、AKT、p-AKT蛋白表达检测 收集转染24 h的细胞,加入细胞裂解液提取细胞蛋白,BCA法定量蛋白,取40 μg蛋白进行10%的SDS-PAGE电泳,电泳结束后依次进行PVDF转膜、脱脂奶粉封闭,4℃孵育一抗( TRPC5、Caspase3、AKT、p-AKT和内参GAPDH抗体均按照1∶1 000稀释),洗膜,加入1∶2 000稀释HRP标记的羊抗兔二抗,洗膜,暗室中显影、定影。
1.2.6细胞增殖实验 取转染后培养24 h的NC组、ox-LDL组、TRPC5-siRNA组和TRPC5-siRNA+ox-LDL组细胞,每孔加入CCK8液10 μl,37℃孵育4 h,酶标仪562 nm测定各孔的吸光度值(OD)。实验重复3次。
1.2.8细胞凋亡实验 取转染24 h的细胞,根据 Annexin V-FITC/PI细胞凋亡试剂盒检测各组细胞的凋亡情况。实验重复3次。

2 结果
2.1TRPC5基因在AS中的表达 提取AS斑块中总RNA,通过RT-PCR及Western blot两种方法检测TRPC5基因的表达,结果如图1所示,对照组及AS组TRPC5的mRNA表达分别为0.960±0.170、4.611±1.040,蛋白表达分别为0.196±0.018、0.788±0.089,TRPC5基因在AS组中的表达显著高于在对照组的表达(tmRNA=6.001,PmRNA=0.004;t蛋白=11.292,P蛋白=0.000)。
2.2TRPC5在巨噬细胞中的表达 各组细胞中TRPC5的蛋白表达检测结果如图2和表1所示,与对照组比较,NC组TRPC5的蛋白表达无明显变化(P>0.05),TRPC5-siRNA组TRPC5的蛋白表达显著降低(t=5.053,P=0.001),ox-LDL组TRPC5的蛋白表达显著升高(t=14.592,P=0.000);TRPC5-siRNA+ ox-LDL 组TRPC5的蛋白表达显著低于ox-LDL组(t=19.645,P=0.000),高于TRPC5-siRNA组(t=3.731,P=0.004)。

图1 TRPC5基因在AS中的表达Fig.1 Expression of TRPC5 gene in ASNote: A.RT-PCR was used to detect the expression of TRPC5 in AS plaques;B.Western blot was used to detect TRPC5 protein expression in AS plaque;compared with the control group,*.P<0.05.
2.3TRPC5基因对经ox-LDL刺激的巨噬细胞增殖的影响 巨噬细胞经ox-LDL和TRPC5-siRNA处理后,CCK8检测各组细胞的增殖情况,结果如表2 所示,与对照组比较,NC组细胞增殖无明显变化(P>0.05),TRPC5-siRNA组细胞增殖显著升高(t=
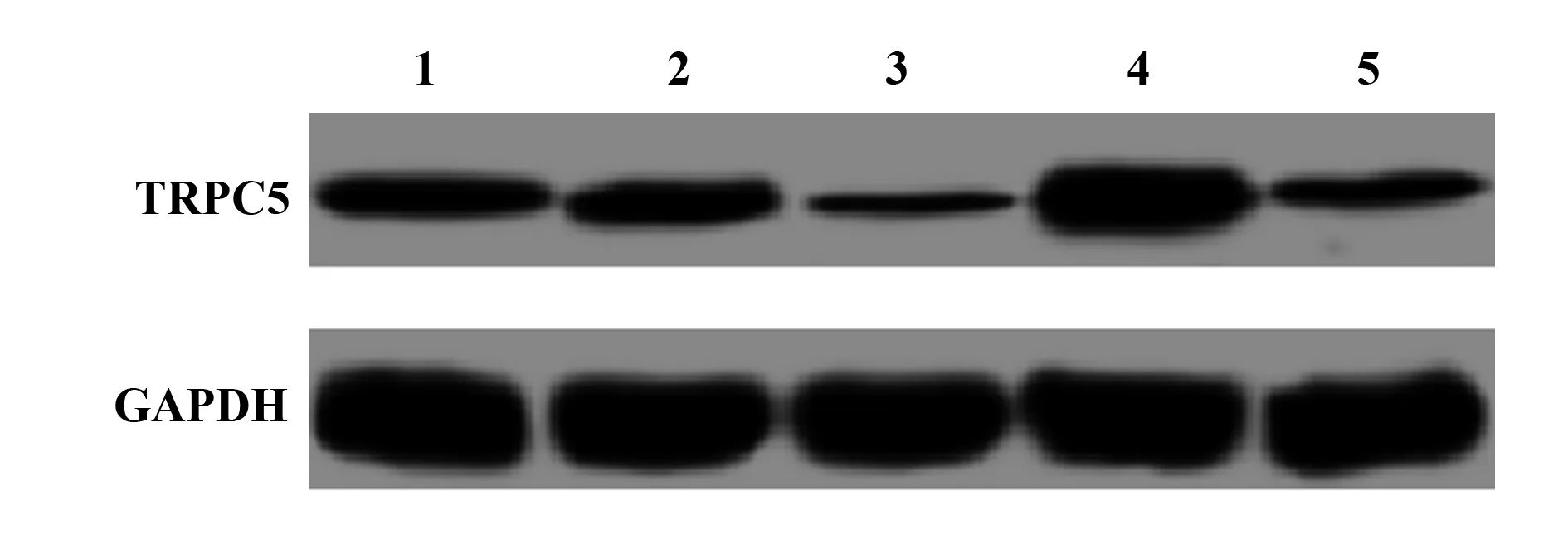
图2 TRPC5基因在巨噬细胞中的表达Fig.2 Expression of TRPC5 gene in macrophagesNote: 1.Control group;2.NC group;3.TRPC5-siRNA group;4.ox-LDL group;5.TRPC5-siRNA+ox-LDL group.
表1TRPC5基因在巨噬细胞中的表达
Tab.1ExpressionofTRPC5geneinmacrophages

Groups Relative expression of TRPC5 protein Control0.202±0.018NC0.218±0.022TRPC5-siRNA0.095±0.0111)2)ox-LDL0.511±0.0471)2)TRPC5-siRNA+ox-LDL0.174±0.015F112.344P0.000
Note:Compared with the control group,1)P<0.05;compared with the TRPC5-siRNA+ox-LDL group,2)P<0.05.
表2TRPC5基因对经ox-LDL刺激的巨噬细胞增殖的影响
Tab.2EffectofTRPC5geneonproliferationofmacrophagesstimulatedbyox-LDL
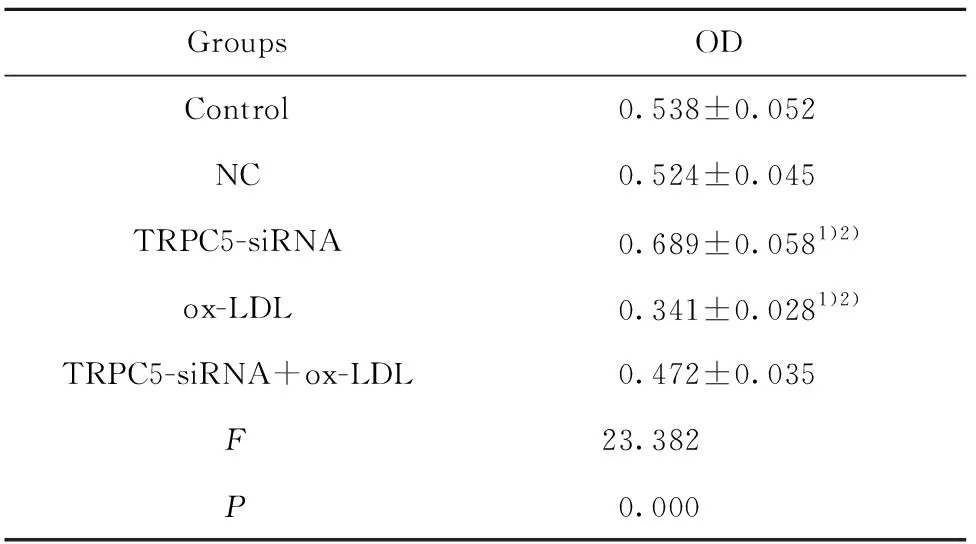
GroupsODControl0.538±0.052NC0.524±0.045TRPC5-siRNA 0.689±0.0581)2)ox-LDL 0.341±0.0281)2)TRPC5-siRNA+ox-LDL0.472±0.035F23.382P0.000
Note:Compared with the control group,1)P<0.05;compared with the TRPC5-siRNA+ox-LDL group,2)P<0.05.
4.114,P=0.002),ox-LDL组细胞增殖显著降低(t=5.368,P=0.000);TRPC5-siRNA+ox-LDL组细胞增殖显著高于ox-LDL组(t=3.269,P=0.005),低于TRPC5-siRNA组(t=5.913,P=0.000)。
2.4TRPC5基因对经ox-LDL刺激的巨噬细胞凋亡的影响 流式细胞术检测各组细胞凋亡率结果如图3和表3所示,与NC组比较,TRPC5-siRNA组细胞凋亡率显著降低(t=8.042,P=0.000),ox-LDL组细胞凋亡率显著升高(t=9.650,P=0.000);TRPC5-siRNA+ox-LDL组细胞凋亡率显著低于ox-LDL组(t=11.049,P=0.000),高于TRPC5-siRNA组(t=6.643,P=0.000)。
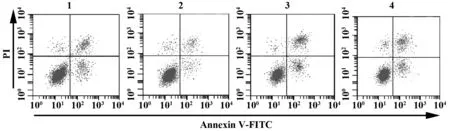
图3 TRPC5基因对经ox-LDL刺激的巨噬细胞凋亡的影响Fig.3 Effect of TRPC5 gene on apoptosis of macrophages stimulated by ox-LDLNote: 1.NC group;2.TRPC5-siRNA group;3.ox-LDL group; 4.TRPC5-siRNA+ox-LDL group.
表3TRPC5基因对经ox-LDL刺激的巨噬细胞凋亡的影响
Tab.3EffectofTRPC5geneonapoptosisofmacrophagesstimulatedbyox-LDL
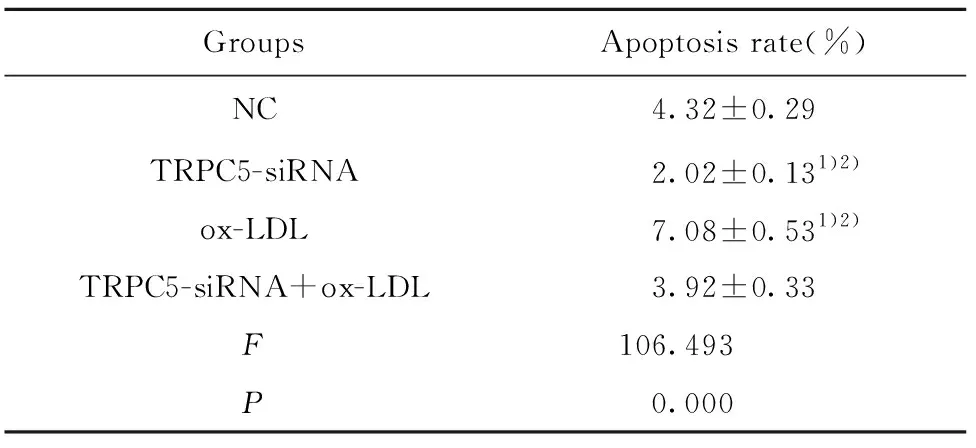
GroupsApoptosis rate(%)NC4.32±0.29TRPC5-siRNA2.02±0.131)2)ox-LDL7.08±0.531)2)TRPC5-siRNA+ox-LDL3.92±0.33F106.493P0.000
Note:Compared with the control group,1)P<0.05;compared with the TRPC5-siRNA+ox-LDL group,2)P<0.05.
2.5TRPC5基因对经ox-LDL刺激的巨噬细胞Caspase3、AKT和p-AKT蛋白表达的影响 通过Western blot检测各组细胞中凋亡蛋白Caspase3及AKT和磷酸化的AKT的蛋白表达,结果如图4和表4所示,与NC组比较,TRPC5-siRNA组Caspase3蛋白表达显著降低,p-AKT蛋白表达显著升高(tCaspase3=6.645,PCaspase3=0.000;tp-AKT=10.973,Pp-AKT=0.000),ox-LDL组Caspase3蛋白表达显著升高,p-AKT蛋白表达显著降低(tCaspase3=7.884,PCaspase3=0.000;tp-AKT=4.135,Pp-AKT=0.003)。TRPC5-siRNA+ox-LDL组Caspase3蛋白表达显著低于ox-LDL组,高于TRPC5-siRNA组(t1=8.785,P1=0.000;t2=5.744,P2=0.000),p-AKT蛋白表达显著低于TRPC5-siRNA组,高于ox-LDL组(t1=6.918,P1=0.000;t2=8.190,P2=0.003)。

图4 TRPC5基因对经ox-LDL刺激的巨噬细胞Caspase3、AKT和p-AKT蛋白表达的影响Fig.4 Effect of TRPC5 gene on expression of Caspase3,AKT,and p-AKT protein in macrophages stimulated by ox-LDLNote: 1.NC group;2.TRPC5-siRNA group;3.ox-LDL group; 4.TRPC5-siRNA+ox-LDL group.
表4Caspase3、AKT和p-AKT的蛋白相对表达量
Tab.4ProteinrelativeexpressionofCaspase3,AKTandp-AKT

GroupsProtein relative expressionCaspase3AKTp-AKTNC0.222±0.0180.542±0.0520.097±0.010TRPC5-siRNA0.104±0.0121)2)0.528±0.0480.235±0.0231)2)ox-LDL0.362±0.0321)2)0.533±0.0540.045±0.0081)2)TRPC5-siRNA+ox-LDL0.206±0.0200.530±0.0510.148±0.016F71.3980.04482.853P0.0000.9870.000
Note:Compared with the control group,1)P<0.05;compared with the TRPC5-siRNA+ox-LDL group,2)P<0.05.
3 讨论
AS是一种慢性进行性疾病,是常见的对人类身体健康最具危害性的疾病之一,具体的发病机制还未明确[7]。ox-LDL已被证实是诱导AS发生的主要危险因素,已有研究表明其刺激巨噬细胞、内皮细胞、血管平滑肌细胞及树突状细胞后,能引起细胞发生凋亡、迁移等变化[8-11]。在AS的发展过程中,巨噬细胞的增殖及凋亡过程均存在调节作用,其功能和数量改变可影响AS发展进程[12,13]。目前关于AS中ox-LDL对巨噬细胞凋亡的影响已有研究。研究显示,miR-1在AS斑块中表达升高,ox-LDL刺激巨噬细胞可引起miR-1表达升高,过表达miR-1可增加ox-LDL刺激的巨噬细胞凋亡,从而参与AS发展过程[14,15];ox-LDL可呈时间及剂量依赖促进TRB3在巨噬细胞中的表达,抑制TRB3的表达可降低ox-LDL对细胞增殖的抑制作用和凋亡的促进作用[16,17]。TRPC家族成员TRPC1、TRPC4和TRPC5在VSMCs中有大量表达,TRPC5具有脂质离子亚型受体特性,可被ox-LDL中的1-磷酸鞘氨醇成分激活[18,19]。有研究发现,阿托伐他汀可通过下调TRPC5表达延缓AS进程[20]。目前关于TRPC5对巨噬细胞凋亡的影响及机制还未清楚。
ApoE-/-小鼠是目前已公认的作为研究AS药理学及发病机制等方面最经典的一个模型,其AS发病机制与人类该病的形成过程一致[21]。因此,本研究通过建立ApoE-/-小鼠AS模型,检测到AS斑块中TRPC5的表达升高,这说明TRPC5可影响AS的发展。RNA干扰能高效、特异地抑制目的基因表达,是目前研究基因功能有效的方法,已得到广泛的应用[22,23]。本研究中通过RNA干扰技术沉默TRPC5的表达,检测沉默TRPC5表达对ox-LDL刺激的巨噬细胞增殖凋亡的影响,发现ox-LDL刺激后巨噬细胞增殖显著降低,凋亡增加,而抑制TRPC5表达后可缓解这一效应。这提示TRPC5可调节巨噬细胞的增殖凋亡,从而影响AS的发展进程。
Caspase家族在细胞凋亡过程中发挥重要作用,均以酶原这种无活性的形式存在,Caspase3是该家族中的关键酶,处在Caspase级联反应下游,作为凋亡者执行者之一,活化的Caspase3可使凋亡进入不可逆阶段[24-26]。有研究显示,ox-LDL可通过激活内皮细胞Caspase3的活性,降低Bcl-2活性,从而促进细胞的凋亡[27,28]。AKT是一种丝/苏氨酸蛋白激酶,分子量约为60 kD,处于PI3K/AKT通路的中心环节,是PI3K的一个直接靶基因,物理刺激、生长因子、细胞因子等都可通过使PI3K激活而活化磷酸化的AKT,活化的AKT可直接催化Caspase3,从而使其失去活性,抑制Caspase3的促凋亡作用[29,30]。研究发现,巨噬细胞凋亡过程中AKT信号途径起了关键作用,AKT活性增加可抑制巨噬细胞的凋亡[31]。本研究中,为了检测TRPC5表达对ox-LDL刺激的巨噬细胞Caspase3及AKT信号通路的影响,通过Western blot检测Caspase3、AKT及p-AKT的蛋白表达,发现ox-LDL刺激可上调Caspase3表达,下调p-AKT的表达,而抑制TRPC5表达后可缓解这一效应。本研究提示TRPC5可通过激活AKT信号通路影响巨噬细胞的增殖凋亡,对凋亡的调节方式是抑制Caspase3表达。
综上所述,TRPC5基因在动脉粥样硬化斑块中表达升高,下调 TRPC5表达可减弱ox-LDL对巨噬细胞增殖的抑制作用和凋亡的促进作用,机制是激活AKT信号通路。对凋亡的调节方式是抑制Caspase3表达。本研究提示TRPC5基因可影响动脉粥样硬化发展进程,有望为该病进一步研究提供新的靶点,值得进一步进行深入研究。

