表面蛋白EpCAM检测循环肿瘤细胞缺陷的研究进展
谢瑞芝,黎必非,练殊,李书慧,贾力
福州大学肿瘤转移预警和预防研究所,福州 350116
肿瘤患者的病死率与疾病诊断的时期有关,90%以上的肿瘤患者死亡是由于发生了肿瘤转移[1-4]。早在十多年前,就有学者提出了肿瘤细胞可以在早期生长过程中脱离原发肿瘤,具有较弱的侵袭能力[5];但是目前肿瘤分期程序和高分辨率影像技术对肿瘤转移的探测均不够敏感,不能探测到肿瘤进程中的关键步骤:肿瘤微小转移或者早期肿瘤侵袭[6]。多年来,很多用于探测外周血循环肿瘤细胞(circulating tumor cell,CTC)的程序被开发,但其敏感度和特异度均不高[7-11]。直到20世纪70年代中期,一个检测CTC的重大发现:上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)以不同水平在上皮细胞和上皮肿瘤细胞中表达,Ep-CAM也存在于血液细胞中[12],后续研究也证实了这个发现[13-14]。之后Riethmüller团队开创首个Ep-CAM富集方法,并联合逆转录聚合酶链反应用于肿瘤患者的CTC检测[15]。后来CellSearch自动化系统获得了广泛关注,该系统已经被美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于转移性乳腺癌、结肠癌、前列腺癌中CTC的检测[16]。目前,以EpCAM为基础的CTC检测方法是应用最普遍的CTC检测方法之一。值得注意的是,很多证据表明,CTC由上皮肿瘤细胞、上皮-间充质转化(epithelial-mesenchymal transition,EMT)细胞、混合(上皮和EMT阳性)肿瘤细胞、不可逆EMT阳性肿瘤细胞、循环肿瘤干细胞(circulating tumor stem cell,CTSC)组成,具有多相性[8,17-20],并不是所有的肿瘤细胞都有EpCAM表达。在EpCAM表达水平较低、非上皮表型CTSC和经历EMT的情况下,以EpCAM为基础的检测方法无法检测到CTC。这个检测方法的灵敏度和特异度均较低,可能会低估CTC,尤其是CTSC和EMT阳性肿瘤细胞在肿瘤转移中的重要性。
1 CTC
CTC是多种类型的细胞,包括单细胞或者细胞群落。肿瘤细胞逃逸到循环系统以线状或者块状出现,1天内1 g肿瘤组织中有100万个细胞进入血液[10,21],但是只有极少数具有高度活性、转移潜能的肿瘤细胞在循环系统中可以存活,相互聚集形成微小癌栓,并在一定的条件下发展为转移病灶[21-23]。来源于原发肿瘤细胞(图1)或者转移器官并散布在外周血管的CTC具有高度异质性,有强大的形成转移病灶的能力[24-26]。CTC的分子特性被认为是一个实时“液体活检切片”,可能有利于肿瘤患者治疗的动态监测及个体治疗,这些足以见证CTC在肿瘤发生和转移中所扮演的重要角色[21,24,27]。假设在造血运输期间靶向CTC,在转移高峰期和末期有效地抑制CTC,可以降低肿瘤患者的发病率和病死率。
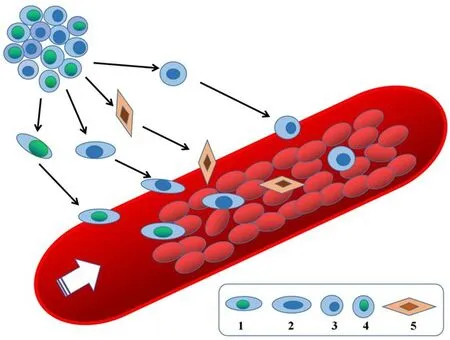
图1 外周血循环中的原发肿瘤细胞亚群
利用CTC的物理性质和生物学特性从大量的血液细胞中分离CTC,生物学特性主要应用于抗体免疫学,识别肿瘤相关抗原(正向选择)或者普通的白细胞分化群(cluster of differentiation,CD)抗原中的CD45(负向选择)[10]。正向选择是EpCAM抗体只分离表达EpCAM抗原的细胞[28],这种方法的缺点是无法检测表达水平较低的EpCAM、EpCAM-和非上皮表型CTC如CTSC和EMT阳性细胞,并且它们与抗体的分离需要外界破坏CTC表面EpCAM受体与EpCAM抗体之间的离子键,所以正向选择分离的CTC的生存能力下降。通过物理方法或者负向选择的上皮、非上皮显性的CTC、CTSC、EMT阳性肿瘤细胞可以生存,但是所有通过物理方法和负向选择分离的循环细胞不一定来源于肿瘤,它们可能来源于正常的血管、基质细胞、间充质细胞、干细胞及其他在循环系统中很少存在的宿主细胞[7,11]。因此,通过物理方法和负向选择分离CTC是混合的,需要进一步纯化才能使用,而正向选择可以分离出高纯度的、来源于肿瘤的CTC。
由于多重内在和外在因素作用,导致CTC数量少,可塑,基因型和表型可变,CTC的探测仍然存在技术挑战。CTC数量非常少并且多相,鉴定CTC及分析其特性需要富集和探测相结合,并且应用敏感度和特异度强的分析方式。对大量的细胞用不恰当的分离技术,不仅阻碍了对CTC的生物性质的理解,也阻碍了对CTC的精细分析和功能研究。
2 EpCAM用于检测CTC的缺陷

图2 EpCAM的结构与构象模型

表1 不同肿瘤细胞中的EpCAM表达情况
EpCAM是一种由314个氨基酸组成的I型跨膜糖蛋白,相对分子质量为39~42,是同种抗原的上皮细胞间的黏附分子。这种糖蛋白可以被识别,如相对分子质量为40的糖蛋白可以被单克隆抗体17-1A识别(图2),该抗体也称为ESA、Ber-EP4、MH99、 AUA1.MOC31、323/A3、KS1/4、GA733、HEA125等[29],EpCAM 由 Litvinov 团队命名[30]。在一些健康成年人的正常组织和器官中,EpCAM高表达,并且大多数肿瘤有EpCAM表达,上皮组织的肿瘤通常呈EpCAM强阳性,非上皮组织的肿瘤呈EpCAM阴性,间充质肿瘤仅显示弱阳性或者偶有弱阳性[8,31]。在不同肿瘤组织中EpCAM表达情况不同(表1)[32],并且不同肿瘤组织中EpCAM表达情况差异显著[30,32]。
为了从血样中一次性分离CTC,EpCAM抗体受到了重点关注。CellSearch系统的缺陷是灵敏度相对较低:在每毫升只有一个CTC且纯度低的情况下,只有少部分的转移癌患者检测CTC呈阳性[19,28,33]。依据Seldinger导丝穿刺法[34],一个新的、以EpCAM为基础的、从未经处理的血样中分离CTC的单步富集方法被报道[35]。这个装置可以成功地分离肿瘤各时期的CTC,包括未确诊的肿瘤早期远处转移,这种应用于生物体内的方法的优点是可以以较大的血液样本去捕获CTC,特别是对于CTC较少的早期肿瘤患者,每次需要获取大量的肿瘤患者的血液,才可以做到实时、动态、准确地监测肿瘤发展情况[18,36]。尽管以EpCAM为基础的富集方法具有很大的潜力,但是灵敏度和特异度较低,因此基于EpCAM检测CTC的方法还存在缺陷。
2.1 CTC存在多相性
CTC是由混合型细胞组成,包括上皮肿瘤细胞、EMT细胞、混合(上皮和EMT阳性)肿瘤细胞、不可逆EMT阳性肿瘤细胞和CTSC。因此,以Ep-CAM为基础的检测方法无法检测到EpCAM低表达的CTC、CTSC、EMT阳性和EpCAM-细胞。CSC是具有干细胞特性的肿瘤细胞的罕见亚型,不同的亚型有不同的功能属性,并且在肿瘤进展中具有多样性,因此表面标志物并不能明确地富集所有的CSC。到目前为止,研究人员已经确定了一些表面标志物,可以从大多数肿瘤类型的原发性肿瘤组织中富集各种CSC[17,26,37]。由于CSC的高度异质性及大多数常规抗肿瘤疗法根除患者体内CSC的能力有限,所以复发初始阶段的CSC必须被捕获和表征[17,33]。
数据显示,即使通过CellSearch系统,仍有三分之一的转移性乳腺癌患者使用传统的EpCAM方法无法检测到CTC[38-39],并且在转移性乳腺癌患者中仅三分之一的患者CTC中EpCAM+的事实也验证了这一点[40-41],另外大部分患有神经内分泌肿瘤、结直肠癌、非小细胞肺癌等的患者无法检测到CTC[42]。CSC 可以表达转录因子,如 TWIST、SNAIL、SLUG转录因子均可以引起EMT[43],EMT过程可能引起EpCAM的动态表达[17,32,37]。与其他EMT阳性细胞一样,CTSC可能也会下调包括Ep-CAM在内的标志物的表达水平和上调多种间质细胞标志物的表达水平。CTC具有多相性,包括上皮肿瘤细胞、EMT阳性肿瘤细胞和CTSC,这些细胞共同存在于外周血中,不同肿瘤细胞的EpCAM表达水平不同,以EpCAM为基础的检测方法无法检测到表达水平低的EpCAM和非上皮表型CTC,如CTSC、EMT阳性细胞和EpCAM-细胞。
2.2 EpCAM的动态表达
EpCAM被发现后的很长一段时间内,在整个肿瘤研究进展中EpCAM的稳定表达是不容置疑的事实,直到一个关于EpCAM动态表达的文章[31,44]发表后,才发现如果仅依据单独的EpCAM作为CTC的捕获抗原,会错过对相关CTC的捕获。数据表明,在肿瘤细胞转移进入血液的过程中EpCAM表达下调,与原发性肿瘤或者转移肿瘤相比,每个细胞的EpCAM分子表达量明显降低(400 000vs49 700),肿瘤细胞EpCAM的下调阻碍了CTC的捕获[28,31-32]。此外,处理小鼠时心脏注射和静脉注射高表达的EpCAM肿瘤细胞后仅30 min EpCAM表达开始下调,注射4 h已经检测不到EpCAM的表达[18]。这个结果揭示了CTC中EpCAM表达变化迅速,似乎依赖于与体内器官或者内皮表面的联系。实验证明,在EpCAM高表达的结肠癌细胞转移进入血液后,EpCAM表达水平明显降低,并且通过CD44+和CD47+可以成功分离CTC[18,45-46]。相关研究显示,尽管在原发性肿瘤中EpCAM高表达,但是在食管癌患者的骨髓中检测到的弥散性肿瘤细胞的数量减少,并且三分之二的食管癌患者有携带EpCAM-的散播肿瘤细胞(disseminated tumor cell,DTC)[44,47]。
2.3 存在不可逆的EMT阳性肿瘤细胞
当发现EMT过程使肿瘤细胞出现纺锤形,具有流动性、去极化、抗失巢凋亡、免疫逃逸、转移特性时,依赖上皮标志物的检测方法的缺点就更加明显。EMT是CTC和DTC表面EpCAM表达下调的重要触发因素,可以下调上皮标志物(EpCAM、细胞角蛋白)的表达水平以及上调多种间充质细胞标志物的表达水平[17,48-49]。另外,基于体内外研究验证,CTC作为上皮肿瘤细胞进入脉管系统后,血小板衍生生长因子促使其转变为EMT阳性肿瘤细胞,可见肿瘤细胞进入血液后也可能发生EMT[43,46],而进一步分化的CSC EMT表型的亚群在肿瘤恶化中的作用仍然不确定[50]。CTC具有多相性,其中CTSC的亚群经历了EMT过程并固定在间充质细胞中,不会转变为上皮细胞表型[17-18]。因此,在肿瘤研究以及其他检测CTC中EMT阳性细胞存活率的研究中,区分这两类EMT阳性细胞对确认正确的表型十分重要。
最新研究发现,CTC中肿瘤细胞和CSC的EMT转变发生在侵袭前和转移扩散前[48,51-52]。转移性非小细胞肺癌、转移性乳腺癌、前列腺癌晚期患者与早期乳腺癌患者相比,转移性CTC表达EMT相关蛋白的概率较高,如波形蛋白、纤连蛋白、钙黏附蛋白-N和钙黏附蛋白-O[52-54]。临床认为,相比于乳腺癌早期,CTC的EMT标志物在肿瘤转移中出现的频率更高,而且相比于单独使用上皮标志物,EMT标志物可以更好地预测恶性转化[55]。因此对于接受同源造血干细胞移植和大剂量的化学治疗的转移性乳腺癌患者,与EMT相关的标志物同样可以作为检测CTC的标志物[48]。最近出现一个新的标志物——细胞表面波形蛋白,用于乳腺癌患者和结直肠癌患者EMT阳性的CTC检测[56]。在对58例转移性乳腺癌患者的试验研究中,发现相比于EpCAM,细胞表面波形蛋白抗体显示出更加优异的灵敏度和特异度[17]。
3 小结
仅依靠基于细胞表面EpCAM表达水平的免疫亲和富集方法,CTC中的EpCAM-、EMT阳性细胞和CTSC细胞会被遗失。使用EpCAM抗体的研究方法可能会低估CTC、EMT阳性和CTSC的重要性,尤其是EpCAM在肿瘤转移中的重要性。有必要对CTC的分离技术作进一步的研究,更重要的是自动CellSearch系统不能作为所有新的CTC检测技术的参考标准。一种类型的CTC通常同时表达多个表面生物标志物并且一个生物标志物有多种类型,单一CTC生物标志物的技术不足以高效、特异地捕获CTC,而多种多样的抗体缀合物可以同时识别并结合具有更强亲和力的细胞表型的生物标志物,双抗体缀合物可以灵敏、特异地捕获目标CTC,无论是体外静态还是体内动态条件[57-59]。EpCAM-乳腺癌细胞系高频表达CD146(与不良预后有关的原发乳腺癌的子标志物),为了检测Ep-CAM+的CTC,提倡联合使用CD146抗体和Ep-CAM抗体[60]。同样,联合使用EpCAM抗体和细胞角蛋白抗体可以检测EpCAM-或低表达角蛋白的CTC。最近,黏附分子CD49f(整合素α6亚单位)抗体与细胞角蛋白抗体联用已被证实可以增强与EMT关联的CTC检测的效果[61]。充足的证据显示,其他上皮CTC的标志物包括CD176、表皮生长因子受体(epidermal growth factor receptor,EGFR)、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)和黏蛋白1(mucin 1,Muc1),CTSC 表面标志物有 CD26、CD44、CD133和CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4),循环EMT阳性肿瘤细胞表面标志物有波形蛋白、纤连蛋白、钙黏附蛋白-N和钙黏附蛋白-O[18]。因此,未来的研究应该是将EpCAM抗体与上皮CTC、CTSC、EMT阳性肿瘤细胞表面标志物的抗体结合,以达到最好的检测效果。同时通过吐温-20处理去除对EpCAM的掩蔽,可以有效地提高捕获乳腺癌患者EpCAM低表达的CTC的能力[62]。CTC检测的灵敏度取决于EpCAM抗体,所以建议同时使用不同的EpCAM抗体[18,63]。利用上皮肿瘤细胞、CTSC、EMT阳性和杂交细胞亚型表面的生物标志物,可以提高基于EpCAM富集CTC方法的灵敏度及特异度。

