CAR-NK的构建及其在抗肿瘤联合治疗中的研究进展△
刘沙,梁皓,肖向茜,盛望
北京工业大学生命科学与生物工程学院药物所,北京 100124
尽管肿瘤疗法迭代更新,但如何根治肿瘤依旧是世界性难题。除了传统的手术治疗、放疗和化疗外,免疫疗法由于可以实现精准的靶向治疗而受到广泛关注。嵌合抗原受体(chimeric antigen receptor,CAR)的概念最早由Gross等[1]于1989年提出,之后逐渐应用于肿瘤治疗。嵌合抗原受体T细胞(chimeric antigen receptor engineered T cell,CAR-T)在临床试验中取得了良好的肿瘤治疗效果[2],尤其是在血液肿瘤方面,Porter等[3]报道了经CAR-T治疗难治性慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)患者的病情完全缓解(complete response,CR)。迄今为止,ClinicalTrials.gov网站上已有200余项有关CAR-T的临床研究的注册信息。美国食品药品监督管理局(Food and Drug Administration,FDA)分别于2017年8月、10月批准两项CAR-T疗法用于肿瘤治疗,分别是tisagenlecleucel[4]和axicabtagene ciloleucel[5],这两项成果的成功商业化,使2017年在CAR-T的发展进程中具有里程碑式的意义。然而,由于异源T细胞易引发移植物抗宿主病(graft-versus-host disease,GVHD),所以患者一般只能采用自体T细胞进行CAR修饰后再进行回输,这使临床CAR-T应用步骤繁琐且价格高昂;此外,CAR-T疗法在实体瘤治疗方面效果不佳。由于固有免疫系统中的自然杀伤(natural killer,NK)细胞是一种天然抗肿瘤细胞,因此,一些研究人员开始尝试利用CAR结构修饰NK细胞(简称CAR-NK)。本综述将梳理近几年CAR-NK研究的相关进展,以及其与其他肿瘤疗法联合应用的效果,展望CAR-NK疗法的未来。
1 CAR-NK的构建
CAR的结构一般由3个区域组成:①细胞外结构域,衍生于单克隆抗体(monoclonal antibody,mAb)的单链可变区片段(single chain variable fragment,scFv),可将免疫细胞(T细胞或NK细胞)定向到肿瘤相关抗原(tumor-associated antigen,TAA),不需要进行抗原提呈;②跨膜结构域;③细胞内结构域,衍生于T细胞受体(T cell receptor,TCR)/CD3[6]。
1.1 细胞外结构域的设计
传统的细胞外结构域是可以与TAA进行特异性结合的scFv。由于鼠源scFv在人体内可能会引起细胞介导的排斥和致敏,或者引起人抗小鼠抗体(human anti-mouse antibody,HAMA)效应[7],因此,许多研究人员采用人源scFv,如抗CD19的FMC63抗体[8]、抗CD20的Leu-16抗体[9]、抗人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的FRP5抗体[10]以及抗上皮细胞黏附分子(epithelial cell adhesion molecule,Ep-CAM)的MOC31抗体[11]等。
为了提高CAR-NK对肿瘤细胞的特异性识别效果,可以将细胞外结构域设计为NK细胞表面活化性受体的配体,如NK细胞2族成员D(natural killer group 2 member,NKG2D)[7]。在肿瘤的免疫监视中,NKG2D和NKG2D的配体(NKG2D ligand,NKG2DL)发挥关键的作用[12]。NKG2DL包括MHCI类链相关蛋白A(MHC classIchain-related A,MICA)、MICB等,在许多肿瘤细胞和被病毒感染的细胞表面被上调[13]。死亡相关蛋白10(death-associated protein 10,DAP10)是 NKG2D 的接头蛋白[14],为了产生更好的细胞信号转导效果,Chang等[15]利用IRES序列,在CAR结构中将DAP10与NKG2D进行共表达,并测试了CAR-NK细胞对多种不同恶性肿瘤细胞系的活性,结果表明CAR-NK细胞杀伤急性淋巴细胞白血病(acute lymphocytic leukemia,ALL)和前列腺癌的效果更佳。
1.2 细胞内信号区
CD3ζ是最经典的细胞内信号区,含有3个免疫受体酪氨酸活化基序(immunoreceptor tyrosinebased activation motif,ITAM)[16]。Töpfer等[17]对比了DAP12和CD28-CD3ζ作为细胞内信号转导域的抗肿瘤效果。在体外实验和小鼠模型中,DAP12和CD28-CD3ζ除可以特异性裂解前列腺癌细胞之外,与传统结构的CAR-NK细胞相比,加入DAP12信号结构域的CAR结构,增强了CAR-NK细胞对前列腺癌细胞特异性的细胞毒性。这项工作首次证明了含单一ITAM的DAP12-CAR与含3个ITAM的基于CD3ζ的CAR结构,具有相同的起始下游信号的能力。
2 CAR-NK在实体肿瘤中的探索研究
在实体瘤中,目前已发表了针对乳腺癌[18-19]、卵巢癌[19]、胶质瘤[20-21]、乳腺癌脑转移[22]、神经母细胞瘤[23]等的CAR-NK临床前研究(表1)。表皮生长因子受体(epidermal growth factor receptor,EGFR)及表皮生长因子受体Ⅲ型突变体(epidermal growth factor receptor variant typeⅢ,EGFRvⅢ)在大部分的胶质母细胞瘤(glioblastoma,GBM)中过表达。Genßler等[21]利用NK-92细胞系构建可以特异性识别EGFR、EGFRvⅢ或共同表位的3种CAR-NK细胞。在携带表达EGFR、EGFRvⅢ或两种受体的颅内GBM异种移植物的免疫缺陷小鼠模型中,用双特异性CAR-NK细胞进行治疗优于用相应的单特异性细胞治疗,小鼠的生存期明显延长,并可减少免疫逃逸。
3 CAR-NK在肿瘤联合治疗中的应用
3.1 CAR-NK与化疗药物的联合应用
3.1.1 CAR-NK与普通化疗药物的联合应用 目前晚期卵巢癌患者的治疗策略通常是手术之后施行化疗[24]。顺铂是卵巢癌化疗的一线药物,然而顺铂不能杀死肿瘤干细胞(cancer stem cell,CSC),CSC的快速分化增殖导致肿瘤复发[25]。CD133是CSC上的TAA之一,其高表达与卵巢癌的化疗耐药性相关,可缩短患者的无进展生存期和总生存期[26]。Klapdor等[27]将CD133作为靶点,构建第3代CAR-NK92细胞。这些CAR-NK细胞显示出特异性杀伤CD133+卵巢癌细胞和原代卵巢癌细胞的能力。实验结果表明,先使用顺铂进行化疗,再注射NK细胞进行抗肿瘤联合治疗,可以获得最强的杀伤效果,而且顺铂不影响CAR-NK的细胞毒性和细胞活力[27]。
3.1.2 CAR-NK作为纳米化疗药物的活载体 传统的静脉注射一般需要输注全身毒性的剂量以保证对肿瘤细胞的杀伤效果[28]。为了降低全身毒性,使用免疫细胞作为载体将抗肿瘤药物直接输送到肿瘤部位的概念受到了关注[29]。紫杉醇(paclitaxel,PTX)是一种传统的化疗药物,与游离态相比,其纳米粒子制剂增强了向肿瘤部位的运输,并且降低了全身毒性[30]。有文献报道,NK细胞表面可以检测到高水平的游离巯基[31]。Siegler等[19]将PTX包载于人工合成的交联多层脂质体囊泡(crosslinked multilamellar liposomal vesicle,cMLV)纳米颗粒内,cMLV通过存在于其表面脂质双层上的功能基团——马来酰亚胺,与NK细胞表面上巯基发生稳定缀合,从而利用CAR-NK细胞的靶向性,将包载着PTX的cMLV运输到肿瘤细胞附近,发挥细胞免疫和化疗的联用效应。结果证明,将CAR-NK当作“活载体”靶向运输PTX,可以特异性增强在HER2+、CD19+过表达的卵巢癌、乳腺癌两种肿瘤模型中的抗肿瘤效力,而且cMLV(PTX)的缀合不影响CAR-NK细胞的迁移[19]。
3.2 CAR-NK与酶抑制药的联合应用

表1 CAR-NK在治疗实体肿瘤方面的临床前研究
3.2.1 CAR-NK与酪氨酸激酶抑制药的联合应用研究表明,一些酪氨酸激酶抑制药(tyrosine kinase inhibitor,TKI)可以调节肿瘤微环境,增强CAR-T细胞的抗肿瘤免疫应答效果。卡博替尼(cabozantinib)是一种于2016年4月被美国FDA批准用于治疗晚期肾细胞癌(renal cell carcinoma,RCC)的TKI[32]。Kwilas等[33]报道卡博替尼可以抑制髓源性抑制细胞(myeloid-derived suppressor cell,MDSC)和调节性 T(regulatory T,Tr)细胞的功能,并与抗肿瘤免疫疗法产生协同作用。Zhang等[34]的研究表明,靶向EGFR的CAR-NK92细胞具有很高的特异性杀伤RCC细胞的能力,而用卡博替尼处理则可以增加RCC细胞膜表面EGFR的表达,减少程序性死亡受体配体1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD-L1)的表达,从而增强CAR-NK细胞的抗肿瘤作用。
3.2.2 CAR-NK与组蛋白去乙酰化酶抑制药的联合应用 组蛋白去乙酰化酶抑制药(histone deacetylase inhibitor,HDACI)可以修正与肿瘤相关的表观遗传的异常改变[35],罗米地辛(romidepsin)是其中一种,可以抑制人胃癌、肺癌和乳腺癌的移植瘤细胞。Chu等[36]研究了抗CD20-CAR修饰的NK细胞单独或与罗米地辛联合应用抗伯基特(Burkitt)淋巴瘤的效果,结果发现罗米地辛在Burkitt淋巴瘤细胞中,显著诱导MICA、MICB的表达,可以增强CAR-NK的特异性细胞毒性,两者联合应用产生了比单独疗法更佳的抗肿瘤效果。
3.3 CAR-NK与溶瘤病毒的联合应用
溶瘤病毒(oncolytic virus,OV)是一类对肿瘤细胞具有选择性杀伤作用的病毒,肿瘤细胞被OV感染后,会发生免疫原性细胞死亡(immunogenic cell death,ICD),释放免疫原性物质,激发机体的免疫应答[37]。溶瘤性单纯疱疹病毒-1(oncolytic herpes simplex virus-1,OHSV-1)是第1种基因工程OV,基因组结构非常稳定,已经被用于多种肿瘤治疗[38],但是Han等[39]报道OHSV作为单一药物治疗肿瘤,效果并不好,原因可能在于OHSV的治疗激活了患者NK细胞对感染细胞的免疫应答,最终抑制了病毒的复制。乳腺癌脑转移在转移性乳腺癌患者中很常见,且预后不良。Chen等[22]对NK-92细胞进行了靶向EGFR的CAR修饰,在体外和小鼠颅内乳腺癌模型中分别测试EGFR-CAR改造的NK-92细胞、OHSV-1及其联合的抗乳腺癌脑转移的效果。在体外,与乳腺癌细胞共培养时,EGFRCAR改造的NK-92细胞显示出增强细胞毒性和提高γ干扰素(γ-interferon,IFN-γ)表达水平的效果,而在与OHSV-1联合应用后则可以检测到更强烈的细胞杀伤效果;在小鼠模型中,与单一疗法相比,CAR-NK细胞与OHSV-1联合治疗可以更有效地杀伤MDA-MB-231肿瘤细胞,显著延长荷瘤小鼠的寿命。出于安全的考虑,NK-92细胞在临床使用前需要经过1000 cGy(1 cGy=0.01 Gy)的照射[40]是被公认的,CAR-NK的效应虽强烈但有限,通常2天内都是细胞毒性的峰值;而OHSV-1由于需要复制,4天后逐渐起效,抗肿瘤反应缓慢但裂解效应时间长,因此,Chen等[22]认为肿瘤内注射CAR-NK后的3天内输注OHSV-1才能达到最佳的抗肿瘤效果。
4 CAR-NK的临床研究现状
尽管ClinicalTrials.gov网站上已有200余项有关CAR-T的临床研究被注册,但是截止至2018年2月,采用CAR-NK的临床试验仅有8项(表2),涉及血液肿瘤及实体瘤的治疗,NK细胞的来源包括原代NK细胞及NK-92细胞系等。
M.D.安德森癌症中心资助的临床试验(NCT03056339)中的CAR结构是其中最复杂的,采用了包含表达诱导型胱天蛋白酶9(inducible caspase 9,iC9)基因以及细胞因子白细胞介素-15(interleukin-15,IL-15)基因的CAR结构——iC9/CAR 19/IL15。构建的CAR-NK细胞可以自行产生IL-15,支持细胞的存活和增殖[41],而且可以在需要的时候通过药理学活化来表达自杀基因,清除CAR-NK细胞。
这8项临床实验中,4项由来自中国的博生吉医药科技(苏州)有限公司资助,且这4项CAR-NK临床研究均采用NK-92细胞系,该细胞系于1994年被建立[42],是一种均质细胞系[7],与传统的CART疗法中采用的获取患者自体T细胞进行体外扩增的方法相比,该细胞系的使用,可以极大地减少工作量并降低成本。
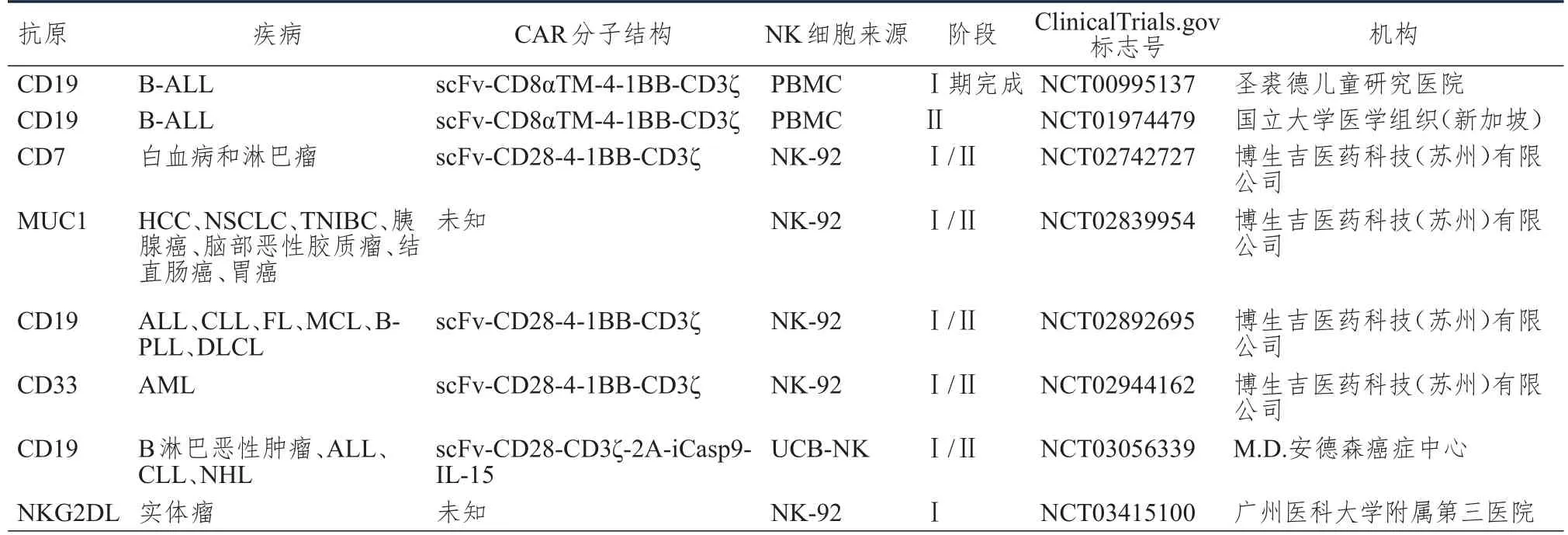
表2 目前ClinicalTrials.gov网站上已注册的CAR-NK临床试验
NCT03415100是2018年1月新注册的一项CAR-NK临床试验,运行机构是同样来自中国的广州医科大学附属第三医院,依旧采用NK-92细胞系,靶向NKG2DL。
5 展望
肿瘤免疫疗法为肿瘤患者带来了新的希望,随着各个课题组研究的深入,CAR-NK作为后起之秀将为肿瘤治疗带来新的发展。
开发更高效、更安全的非病毒转染技术,可能是一个改进方向。与慢病毒转染相比,逆转录病毒转染具有更高的转染率,但潜在的插入突变的风险也更高[43],可能会引发X连锁重度联合免疫缺陷病(X-linked severe combined immunodeficiency disease,X-SCID)等;而电穿孔在技术上更简单,可以避免病毒载体的使用以及肿瘤基因激活和插入突变的相关风险[44],但是利用这种方法表达的CAR分子是暂时性的。因此,对于CAR-NK的进一步应用,亟待开发更高效的转染方法。
文献报道,CAR-T和免疫检查点封锁(immune checkpoint blockade,ICB)联合应用产生了良好的效果,如Cherkassky等[45]的实验表明:阻断程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)/PD-L1,可以使接种了胸膜间皮瘤的原位小鼠模型中的CAR-T细胞恢复效应功能。除此以外,靶向GD2的CAR-T细胞与贝伐珠单抗(bevacizumab,BEV)对人神经母细胞瘤的治疗效果显著[46]。随着CAR-T技术的更新和临床经验的积累,将CAR-NK细胞与其他抗肿瘤疗法联合应用,是未来肿瘤治疗的另一个研究方向。
CAR-NK细胞作为一种治疗难治性恶性肿瘤的免疫治疗方法,虽然存在诸多不足,但其具有巨大的潜力,当前的临床研究将有助于CAR-NK技术进一步发展和完善。

