解聚素-金属蛋白酶17在锯齿状结直肠癌中的表达及其意义
赵凤娟 宋淑莉 王志刚 姬永娟
结直肠锯齿状息肉(serrated polyp,SP)的组织学特征是隐窝上皮呈锯齿状,在既往研究中SP被认为是没有恶变潜能的增生性息肉(hyperplastic polyps,HP)[1]。然而,最近的研究发现SP中的无蒂锯齿腺瘤(sessile saw-tooth adenoma,SSA)被认为是20%~30%结直肠癌(colorectal cancer,CRC)的前体病变,尤其在近端结肠和直肠癌中[2]。研究认为超过90%的结直肠癌是髓样、微乳头状、黏液样、锯齿状或印戒细胞,其中锯齿状腺癌(serrated adenocarcinoma,SAC)的5年生存率显著低于常规结直肠癌病理分型[3]。 解聚素-金属蛋白酶 17(ADAM17),又称肿瘤坏死因子-α转化酶(TACE),是新近发现的ADAM蛋白家族的成员,可在大多数组织中表达,并在炎症、肿瘤生长和血管生成过程中显著上调[4]。在肿瘤发生和发展过程中发挥重要作用。本研究拟通过检测ADAM17在锯齿状结直肠癌组织和正常组织中的表达以初步探讨ADAM17在锯齿状癌变途径中的作用机制。
资料与方法
一、一般资料
回顾性分析2016年4月至2018年4月期间我院行结肠镜或手术所取得的病理标本120例。其中结直肠癌组织60例,正常结直肠黏膜组织60例。在所有结直肠癌组织中,男性37例,平均年龄(55.3±6.4)岁。结肠癌45例,直肠癌15例。病理结果中高分化23例,中分化25例,低分化12例。
二、入选标准
1.纳入标准
①年龄≥18岁;②美国东部肿瘤协作组(ECOG)评分为0~2分;③结合术前影像和术后病理明确诊断为结直肠癌;④有完整的临床及随访资料。
2.排除标准
①合并其他部位恶性肿瘤;②病理诊断不明确或无法评估;③术前影像学或术中临床资料不全。
三、主要试剂
Trizol试剂和逆转录试剂盒购自美国thermo公司,鼠抗人ADAM17单克隆抗体购自武汉优尔生商贸有限公司,鼠抗人GAPDH抗体购自美国Proteintech公司,即用型链霉素抗生物素蛋白-过氧化物酶免疫组化超敏试剂盒(小鼠)购自福州迈新公司,二氨基联苯胺(DAB)显色剂购自上海嵘崴达实业公司。
四、方法
所有组织标本均经10%甲醛固定,常规石蜡包埋后由陕西超英生物科技有限公司制作成组织芯片。
1.免疫组化检测ADAM17
对上述组织芯片按免疫组化SP试剂盒说明书进行免疫组化染色。二甲苯脱蜡、乙醇水化、抗原修复,正常血清室温下封闭20 min,加入1:100稀释的山羊抗人ADAM17单克隆抗体,PBS替代一抗作为阴性对照,室温过夜。加入1:50稀释的HRP标记链霉亲和素-生物素DAB显色,苏木精复染。免疫组化染色结果由2名病理医师在不知悉病理资料情况下对每个点进行染色评价及分级计分。判断标准:无阳性着色为0分,淡黄色为1分,黄或淡褐色为2分,深褐色为3分。阳性细胞计分标准:<5%为0分,5% ~25%为 1分,25% ~50%为 2分,50% ~75%为3分,≥75%为4分。总分=分级计分×阳性细胞计分。根据ADAM17蛋白表达水平,总分<3为阴性表达,总分≥3为阳性表达。
2.荧光定量(PCR)检测ADAM17的表达
提取细胞总RNA并逆转录生成cDNA,引物均采用Primer 5设计软件设计,ADAM17基因引物的上游引物序列为 5′-AGA GCT GAC CCA GAT CCC AT-3′, 下游引物序列为 5′-TAC TCT CTT CCC CTC TGC CC-3′。内参照基因GAPDH的上游引物序列为5′-CCC CTT CAT TGA CCT CAA CT-3′, 下游引物序列为 5′-ATGAGTCCTTCCACG ATA CC-3′。qRT-PCR反应条件为:95℃预变性15 min,94 ℃ 15 s,55 ℃退火 30 s,70 ℃延伸 30 s,40个循环。PCR目的产物大小213 bp,内参产物420 bp。
3.Western blot检测ADAM17的表达
取12 μL PCR反应产物于2%琼脂糖上电泳分析。将目的条带ADAM17的灰度与内参条带GAPDH的灰度比作为ADAM17的相对表达量。用5%脱脂牛奶在室温下封闭2 h,加入一抗1:100稀释,4℃下孵育过夜。用洗涤液(TBST)洗膜3次,加人辣根过氧化物酶(HRP)标记的二抗(1:5 000稀释)室温孵育2 h,再用TBST洗膜3次,最后用化学发光试剂发光,在凝胶成像系统上拍照分析。
四、统计方法
所有数据用SPSS 23.0统计学软件包处理。计量资料以x±s表示,符合正态分布的计量资料组间比较采用独立样本t检验,不符合正态分布的计量资料组间比较采用非参数检验;计数资料以%表示,采用χ2检验。所有检验以双侧P<0.05为差异有统计学意义。
结 果
一、免疫组化结果
ADAM17在结直肠癌组织中表达的阳性率为75.0%(45/60),在正常黏膜组织中的阳性率为21.7%(13/60),差异具有统计学意义(χ2=34.171,P<0.001)。ADAM17主要表达在细胞内和基底外侧质膜上(图1),也可以在梭形细胞、大多数内皮细胞和血管平滑肌细胞等基质细胞表达(图1B)。在远离肿瘤的正常结肠黏膜中,ADAM 17在隐窝上皮细胞、血管、黏膜肌和固有肌细胞中表达(图1C)。
二、Western blot结果
结直肠癌组织中ADAM17的相对表达量为0.65±0.2,显著高于正常黏膜组织的0.29±0.1(t=12.471,P < 0.001),图 2。
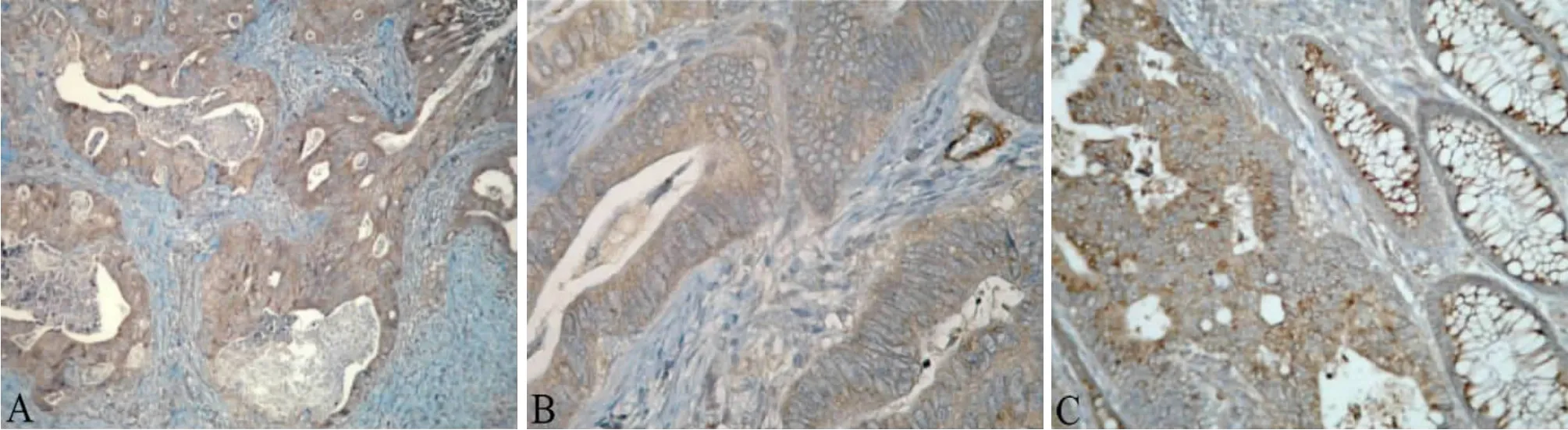
图1 ADAM17在结直肠癌组织与癌旁正常组织中的表达情况[A肿瘤细胞在质膜和细胞质内均有较强的免疫染色(×200);B结肠癌间质中也有部分血管免疫染色(×400);C肿瘤细胞染色强度高于隐窝上皮细胞正常黏膜(×200)]

图2 结直肠癌与正常黏膜中ADAM17的表达(T为结直肠癌组织,N为正常黏膜组织)
三、ADAM17在结直肠癌组织中的表达与临床病理的关系
ADAM17在结直肠癌组织中的表达水平与肿瘤浸润深度(P < 0.001)、血管侵犯(P=0.001)、淋巴侵犯(P=0.001)、远处转移(P=0.001)相关,见表1。与其他病理资料之间的差异无统计学意义 (P>0.05)。
讨 论
从分子遗传角度来看,结直肠癌(CRC)可通过两种不同的途径发生:染色体不稳定(chromosomal instability,CIN)和微卫星不稳定(microsatellite instability,MSI)[5-6]。CIN的特征是染色体水平的改变,其中微卫星稳定(microsatellite stability,MSS)表型已被认为是CIN表型[5]。而MSI是由错配修复基因mlh1启动子区域的DNA甲基化引起[6]。MSI的特征在于BRAF的突变和CpG岛甲基化表型[7]。锯齿状结直肠癌的来源目前认为是锯齿状通路(增生性息肉-锯齿状腺瘤-SAC通路),随着锯齿状通路的提出,有关其分子机制已经被广泛研究[8-10]。这种癌起源于锯齿状息肉,如无蒂锯齿腺瘤(SSA)和传统锯齿腺瘤(TSA)[8]。SSA产生的SAC具有CpG岛甲基化或表型高、BRAF突变阳性、微卫星不稳定性高等分子特征,因此被认为是MSI表型结直肠癌的前体病变[9]。由TSA产生的SAC是由于CpG岛甲基化物表型低,KRAS突变阳性,并显示微卫星稳定性或低微卫星不稳定性[10]。既往研究证实,ADAM17在结直肠癌中强烈表达,并与EGFR共同表达[11]。此外化疗可以激活ADAM17,诱导生长因子凋亡、生长因子受体活化以及生成耐药性[12]。因此,本研究旨在评估ADAM17在结直肠癌和不同腺瘤中的表达情况,初步探讨其做为结直肠癌患者预后标记物的可能性。
针对靶向治疗药物的疗效预测,主要受突变状态的制约。如抗表皮生长因子受体(EGFR)的单克隆抗体对于有 KRAS、NRAS、BRAF和 PIK3CA突变的患者疗效欠佳[13]。EGFR配体被合成为跨膜前体,可以被细胞表面蛋白酶切割,特别是去整合酶和金属蛋白酶(ADAM)家族成员[14]。ADAMs将膜相关蛋白转化为可溶性效应物,同时快速降低表面表达水平。其中ADAM17最初被认为是控制肿瘤坏死因子(TNF)的主要释放酶,可以切割EGFR的配体以及其他细胞表面蛋白,进而可以释放多种生长因子、受体和黏附分子[15]。最新的研究证实,ADAM17是一种涉及EGFR、TNFR反式激活和白介素-6信号传导的质膜脱辅酶[16],有多达76种蛋白质被证明是ADAM17释放的活性底物,因此可以广泛参与到细胞的癌变、增殖、分化及凋亡过程[17-19]。此外,研究还发现ADAM17基因的高表达是各种癌症类型的不良预后因素,并且与肿瘤的发生和发展密切相关,如乳腺癌、前列腺癌、胃癌、结直肠癌、肝细胞癌和卵巢癌等[18-19]。本研究结果表明,ADAM17基因和蛋白在结直肠癌组织中表达高于正常结直肠黏膜和腺瘤组织,对ADAM17表达与结直肠癌临床病理学特征的分析显示,ADAM17高表达与肿瘤的浸润深度、血管侵犯、淋巴转移以及远处转移密切相关。这与既往研究相似[20]。

表1 结直肠癌组织中ADAM17的表达与临床病理的关系
目前,有关ADAM17在结直肠癌侵袭和转移中的作用机制尚不明确。有研究认为,ADAM17控制许多底物的释放,包括几种前EGFR配体[15]。尽管其他ADAM17和底物的作用在肿瘤发展方面仍然不确定,但越来越多的证据表明EGFR配体对结肠癌发展起重要作用[19-20]。还有研究认为,ADAM17的定位和活性由4个半LIM结构域蛋白2(FHL2,一种参与多种蛋白质相互作用的LIM结构域蛋白)调节[21]。这种相互作用涉及到721-739位ADAM17的氨基酸序列。与野生型巨噬细胞相比,FHL2缺陷型巨噬细胞释放ADAM17底物TNFR-1和TNFR-2的能力较低,提示ADAM17和FHL2之间存在物理和功能相互作用[21-22],这意味着FHL2在ADAM17的调节中起作用。研究也证实,ADAM17/FHL2信号轴在结直肠癌中比在腺瘤和正常结肠黏膜中更频繁,提示这些蛋白在结直肠癌发生的最后阶段相互作用。此外,Mustafi等[23]利用结肠癌的遗传和化学模型,首次证明Adam 17是调节EGFR配体释放的主要酶,具有促癌作用。并且发现CXCL12-CXCR4轴作为上游信号激活ADAM17,这为Adam17作为结肠癌预防的潜在治疗靶点奠定了基础。随着已鉴定的ADAM 17底物的数量增加,越来越多的证据表明ADAM17在几乎所有细胞功能中都有作用。由于这种酶无处不在,控制ADAM-17活性的机制仍需进一步研究。
总之,结合既往研究,ADAM17在结直肠癌中高表达,并与肿瘤的浸润深度、血管侵犯、淋巴转移以及远处转移密切相关。表明ADAM17可能是结直肠癌的一个有前途的治疗靶点和预测性生物标记物。但有关ADAM17在结直肠中的作用机制和信号通路仍有待进一步研究。

