肾综合征出血热的流行特征及防治措施研究进展*
彭靖尧,蔡同建,凌 华,张 敏,赵 华,毛德强 综述,黄 为△ 审校
(1.重庆市疾病预防控制中心 400042;2.陆军军医大学军事预防医学院军队流行病学教研室,重庆 400038)
肾综合征出血热(HFRS)是一大类主要引起肾脏损伤疾病的统称,其中包含高丽出血热(KHF)、流行性肾病(NE)、流行性出血热(EHF),以前HFRS还被叫做鼠病毒肾病。我国一直习惯于使用“流行性出血热”这个名称。这类疾病的主要临床表现是出血、发热、休克、恶心等[1]。HFRS是由汉坦病毒(HV)引起,HV主要以鼠类为宿主携带并传播[2]。最早的HFRS病例报道在1913年的海参崴,随后传播至世界各地,截至目前,全世界五大洲累计70多个国家都有关于HFRS的报道[3]。此病在亚洲和欧洲多发,并且起病急,病死率高,对人们的健康造成严重危害[4-5]。俄罗斯曾报道HFRS发病数在其人畜共患疾病中占有很大比重。我国是HFRS累计病例最多的国家,报道了全世界90%以上的病例,且全国各省(直辖市、自治区)均有病例报道。本文对近年来国内外关于HFRS的各方面研究进行综述。
1 流行病学
1.1流行概况
1.1.1HFRS地理分布 关于HFRS的流行病学研究显示,HFRS的发病与地理条件有着很大关系,属于自然疫源性疾病。特别是由野鼠携带病毒引起的HFRS更是存在明显的地区性。能够为野鼠提供良好栖息地的区域(比如森林、荒草地等)是HFRS的潜在疫区,由家鼠引起的HFRS往往发生在鼠害严重的地区。HFRS病例虽然在全世界多个地区都有报道,但是主要集中在我国以及与我国毗邻的韩国和俄罗斯,这3个国家报道病例占了全世界报道病例的绝大多数[6]。受HFRS影响最严重的是我国,1955年,我国内蒙古地区的铁路工人中出现HFRS的暴发流行,随后加强了对HFRS的研究,在之后的一段时间证实东北地区、南方地区、中部地区以及西北地区都存在HFRS的流行。近年来,有HFRS病例报道的地区已经遍及中国31个省(直辖市、自治区),其中近年来报道病例数最多的省份是黑龙江省[7]。
1.1.2HFRS流行的季节性 大量的研究发现,不同地区HFRS的流行都有着明显的季节特点[8]。王芹等[9]在HFRS的相关研究中指出了此病发病每年有两个高峰期,分别是每年5月和11月,并且11月的发病高峰要高于5月的发病高峰。
1.1.3HFRS发病人群特点 人群对于HV是普遍易感的,但HFRS病例主要是青壮年,并且男性发病数远多于女性(男性是女性的2~5倍)。此外,国内的相关研究指出此病发病有明显的职业特点,以农民为主[10],国外也有报道指出此病的发病人群主要为农村居民[11],这是由于本病是由鼠类宿主携带病原传播,接触到鼠类的机会是此病发病的重要因素。
1.2疫情分布 HFRS绝大多数病例集中在我国,其他国家报道HFRS疫情主要集中在20世纪80年代,比较典型的是英国报道的由实验室动物引起的HFRS疫情[12]。近年来国外关于HFRS疫情的报道较少,笔者查到报道病例人数较多的国家是2002年的克罗地亚,报道发病人数200例[13];比利时、法国、德国、荷兰和卢森堡在2005年的报道,自1990年以来,共有1 114例确诊病例[14],2011年阿尔巴尼亚的东南部地区也有相关报道。作为HFRS的重灾区,我国的疫情形势在上世纪80年代最为严重,发病人数最多的年份(1986年)达到11.5万,这之后发病人数开始下降,发病人数由90年代初的6万降到1999年4万左右,2000年后发病人数平稳下降,2010年至今发病率一直稳定在1/10万以下。在病死率方面,20世纪70年代以前,我国的HFRS的病死率一直维持在8%~10%,随后由于治疗水平的提高,病死率迅速降低,直至近些年HFRS的病死率为0.69%[9]。
2 病原学特征
2.1病原的发现 早在20世纪40年代,国外研究人员就证实HFRS是由病毒引起,但一直没有成功分离到病毒。1978年,韩国学者李镐汪等,才首次分离到引起HFRS的病毒(HV);1981年,我国以及俄罗斯、日本的研究人员也分离到该病毒。布尼亚病毒科的HV,除了引起HFRS外,还会引起汉坦病毒肺综合征(HPS),但我国尚无HPS疫情报道[15]。
2.2HV病原学
2.2.1HV基因组 HV的基因组为单股负链分节段RNA,包含有3个不同片段,分别是S、M、L片段。其中S片段编码核衣壳蛋白(NP),NP大约含有430个氨基酸,在感染细胞中表达过量、含量最多,且具有较高的免疫原性和抗原性。有相关研究认为HV的人体细胞免疫应答与NP蛋白密切相关[16]。M片段可编码糖蛋白前体(GPC),GPC含有约1 150个氨基酸,GPC分别在内质网和高尔基体中完成两次糖基化,被切割然后裂解成G1和G2糖蛋白,HV的生物活性主要决定于G1和G2,HV的生物活性又决定其致病特点。L片段编码RNA多聚酶,RNA多聚酶含有2 100多个氨基酸,具有核酸内切酶、复制酶、转录酶的活性,关系着HV的复制和转录。
2.2.2HV的理化性质 HV对有机溶剂高度敏感,能被丙酮、苯、氯仿等快速灭活,相对稳定于4~20 ℃环境中,56 ℃ 1 h或者100 ℃ 1 min可很快被灭活,对紫外线敏感,以上方法灭活HV后,其抗原性保留。
2.2.3HV的分型 由于近些年各国对于HV进行大量研究,越来越多HV亚型被发现,现已知的HV至少可以分为42个基因型/血清型。其中已证实22个型别可对人类致病,可以引起HFRS的有7个型别,可引起HPS的有15个型别,其他10个型别的HV是否引起人类疾病尚不清楚[17]。HV按照宿主动物划分,可以分为4个类群:棉鼠亚科相关病毒、食虫目相关病毒、鼠亚科相关病毒和田鼠亚科相关病毒。我国发现引起HFRS的HV主要是田鼠亚科和鼠亚科相关病毒。与鼠亚科相关的HTN和SEO两种型别的HV是我国HFRS的主要流行型,在我国广泛分布,其中HTN型的HV有9个亚型,SEO型HV可以分为4~6个亚型。HTN型引起的病例病情严重,SEO型引起的病例病情较轻[18]。此外,我国近年来还发现HV的其他型别,均是从鼠类宿主体内分离得到,目前还未发现人感染这些型别的HV,见表1。
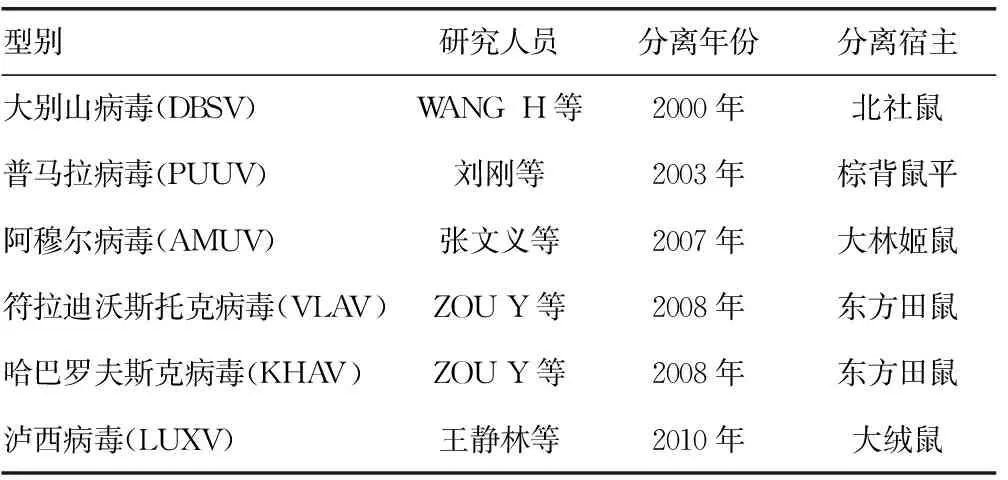
表1 我国新发现HV型别及宿主动物
3 宿主动物及传播途径
3.1宿主动物 能够携带HV的宿主动物种类繁多。目前已发现173种不同的陆栖脊椎动物可以携带HV,众多的动物宿主中,小型啮齿类动物是引起HFRS的主要宿主动物[19]。在我国,能够携带HV引起HFRS的啮齿类动物主要有分为3大类,分别是野鼠类(黑线姬鼠、大林姬鼠、黑线仓鼠、普通田鼠、大足鼠、黄胸鼠)、家鼠类(褐家鼠、小家鼠、黑家鼠)及实验室动物(大白鼠、小白鼠)。其中野鼠类以黑线姬鼠为主,家属类以褐家鼠为主,实验动物以大白鼠为主。近年来有人从家畜的多个内脏器官中检测到HV抗体,并分离得到病毒。这些研究说明家畜对HV易感,可以作为HFRS的播散宿主,而家畜与人的生活密切相关,应引起重视。
3.2传播途径 HFRS的传播途径可以分为3类,即动物源性传播(主要是鼠类传播)、垂直传播和螨媒传播。HV在鼠类宿主体内可长时间存在,不引起鼠类宿主症状,这期间HV可以在鼠类宿主体内大量增殖并通过宿主排泄物排向外界环境中,这是动物源性传播成为HFRS的主要传播途径的主要原因。此外,人与人之间传播HV的实例罕见,阿根廷南部曾经有过1例相关报道。
3.2.1动物源性传播 动物源性传播的HFRS按照其传播的具体方式又可分为接触传播、消化道传播和呼吸道传播3种传播方式。(1)接触传播。经伤口最容易进行HV传播,有实验表明,HV接种黑线姬鼠,一段时间后,可以在其血液、尿液、粪便中检出不同滴度的HV。上述各种标本中HV可以通过破损表皮继续感染其他实验动物。在实际报道病例的相关研究中,鼠类接触史已经证实成为HFRS发病的重要危险因素[20]。(2)呼吸道传播。HV在鼠类动物宿主体内感染可以持续数周甚至几个月,这期间HV经过大量的繁殖后可以达到极高水平,这种高水平的HV随宿主的排泄物排到外界环境中,可形成含高浓度HV的气溶胶,高浓度的气溶胶又可以通过呼吸道感染人类及鼠类宿主动物。已有通过呼吸道引起的HFRS暴发的相关报道[21]。同时国内外都有研究人员从饲养动物(用于HV实验的动物)的实验室空气中分离到HV。(3)消化道传播。早期韩国学者的相关研究显示,HV接种黑线姬鼠后,其唾液和腮腺可以检测到HV的特异抗原,后续的一些研究也证明HV经口或者灌胃感染实验鼠后,处死实验鼠,可从其肺部组织及脑组织中分离到HV。此外,啮齿动物喜食同类尸体,这也成为HV在宿主间传播的重要因素。
3.2.2虫媒传播 和布尼亚病毒科的其他4个属的病毒一样,HV具有虫媒传播特征,国内外研究已证实螨媒能够传播HV[22]。
3.2.3垂直传播 孕妇感染HV后,可经胎盘感染胎儿,造成胎儿死亡,可从胎儿脏器分离到HV。人工感染实验室怀孕的小鼠,在胎鼠体内,也能分离到HV。
4 HFRS的防治
关于疾病的各方面研究都是为疾病的防治提供依据,以便于更好地制订防治措施。纵观国内外对于HFRS的各项研究工作,关于HFRS的防治,包括HFRS的疫情监测、宿主动物防控、免疫防护3大类措施。
4.1HFRS的疫情监测 包括人间疫情和鼠间疫情监测
4.1.1HFRS的人间疫情监测 对HFRS人间疫情的监测有助于对疫情及时掌握、及时分析处理和预判其发展趋势。全球90%以上的HFRS病例都在我国,我国的人间疫情监测意义重大。20世纪80年代起,我国先后建立了48个HFRS监测点,通过大量的人间疫情监测工作,弄清了HFRS发病和死亡特点、人群特征、分布特征、季节性以及流行趋势[7,23]。多年的持续监测工作显示,目前我国HFRS疫情形势已相对稳定,由于治疗条件的改善,病死率已经控制在1%以下[9,24]。近年来,随着分子生物学实验室技术的飞速发展,HFRS的疫情监测有了新的检测手段,可以从基因水平分析和解释HFRS疫情,同时也为防治措施提供了新的依据[25-26]。
4.1.2鼠间疫情监测 HFRS鼠间疫情的监测主要是对鼠类宿主进行监测,包括鼠类宿主的种类、数量以及其HV感染情况,常使用鼠密度和带毒率来描述监测结果。相关研究表明,HV可以以隐性感染长期存在于鼠类宿主体内,鼠密度或者带毒率的增加都可能成为HFRS暴发的原因,鼠类的活动有明显的区域特点,对于那些适宜鼠类栖息繁殖的地区,尽管没有HFRS暴发疫情,也应加强鼠间疫情的监测,防患于未然。此外,国外曾有报道实验室鼠类引起的HFRS疫情[12],因此对于实验室鼠类宿主也应该进行监测。
4.2宿主动物防控 对HV动物宿主鼠和蜱的防控是预防HFRS的有效措施。在鼠类活动频繁的季节进行灭鼠和灭螨工作以达到消灭HFRS传染源的目的,通过整理环境、改善生活和工作场所环境,减少与HV宿主接触的机会进而切断传播途径。
4.3免疫防护 人体感染HV后可以获得稳定且持久的免疫力,很少发现有二次感染的病例,这一特点决定了免疫防护成为防治HFRS的重要手段。针对这个特点,国内外成功研制并上市了用于防治HFRS的疫苗(如鼠脑灭活疫苗、细胞纯化疫苗),这些疫苗接种人体后可产生保护性抗体持久免疫HV,在HFRS的防治工作中已经起到了重要作用[27]。但是,以上灭活疫苗存在的共性问题是引起人体的免疫反应较弱,且诱导产生的保护性抗体滴度较低。因此,国内外做了大量关于HFRS新型疫苗的研究,包括HV基因工程亚单位疫苗、HV载体疫苗、HV核酸疫苗[28]。相关研究表明,HV基因工程亚单位疫苗可很好地刺激和诱导体液免疫和细胞免疫,产生高水平的特异性抗体[29]。HV载体疫苗在诱导机体免疫应答的作用上优于早期的灭活疫苗,但其严重缺点是由于载体的使用而降低了疫苗本身的效力。HV核酸疫苗诱导的免疫应答不仅能有效保护同型HV感染,还能对其他型别的HV感染产生交叉保护[30]。近年来,有人研制出HV的气溶胶疫苗,这种疫苗可以通过鼻黏膜给药,这种新型疫苗便于实现规模化的生产,简化了接种过程,有利于人群免疫工作的开展。
5 HFRS研究工作的展望
从历史上首次报道HFRS至今已有100多年历史,期间人类对HFRS的认知从陌生到恐惧,从恐惧到了解,再到对HFRS的深入研究。目前人类对HFRS的研究极具深度和广度,从最初的单一病例研究到人群监测,从血清学水平研究到目前分子生物学技术研究的广泛应用。我国由于受HFRS影响最为严重,对HFRS进行了大量的研究工作,基于这些大量的研究,已经建立了一整套系统的、完善的、科学的方法来对HFRS进行监测及防控,稳定控制了我国的HFRS疫情。人类史上每次与某种疾病的斗争都是持续且相对长期的,但最终人类都迎来了全面的胜利,比如天花和鼠疫,都是经过激烈斗争后最终被消灭或是有效控制。随着人类社会飞速进步和发展,民众素质不断提高,对疾病的研究不断深入,对疾病的防治手段和措施不断完善,HFRS及其他严重影响人类健康的疾病将会被人类有效地控制直至消除。

