新疆南疆牛乳头状瘤病毒1型SY-12株的基因鉴定及分析
*
(1 塔里木大学生命科学学院, 新疆 阿拉尔 8433003)(2 塔里木大学动物科学学院, 新疆 阿拉尔 8433003)
牛乳头瘤病是由牛乳头瘤病毒(Bovine papillomavirus,BPV)引起的一种肿瘤性疾病[1]。临床上主要表现为患病处有突出体表外的乳头状赘生瘤体,多以1岁左右牛感染发病且表现明显。在牛乳头瘤病毒基因型中,BPV-Ⅰ型和BPV-Ⅱ型可跨种间传播,给动物健康造成影响[2,3]。
因乳头瘤病毒基因型多达13种以上,而临床诊断、病理学检查只能作出初步判断,且无法鉴定病毒基因类型。本研究在临床诊断、组织病理学观察基础上,以乳头状瘤病毒衣壳蛋白L1基因的通用引物MY11/MY09[4]对采集的疑似乳头瘤病料样本进行基因分型鉴定。
1 材料
1.1 实验材料
1.1.1 实验样品的采集
本研究所采集病料来源于新疆南疆某养殖户患病牛,经临床诊断初步确诊后以手术方式收集体表赘生瘤样品,一份保存于10%甲醛溶液中,另一份置于50%的甘油磷酸缓冲液并-20 ℃保存备用。
1.1.2 主要试剂
D2000 Marker、2×Tap PCR Master Mix、T载体连接试剂盒、普通琼脂糖凝胶回收试剂盒、质粒小提取试剂盒、6×loading Buffer、溴化乙锭(EB)购自天根生化科技(北京)有限公司;组织DNA提取试剂盒E.Z.N.A.Tissue DNA Kit购自Omega公司;琼脂糖(西班牙Biowest)、LB培养基(固、液)、氨苄青霉素购自宝信生物技术有限公司;其余耗材和试剂为国产或进口的分析纯。
1.2 实验方法
1.2.1 病理组织学观察
取10%甲醛固定的体表赘生瘤,经修块处理后,脱水、透明、浸蜡、包埋、切片、贴片、脱蜡、H.E.染色、脱水、透明、封片后在光学显微镜下观察[5]。
1.2.2 引物设计
选取通用引物MY11/MY09作为BPV基因分型扩增引物,提交引物序列至生工生物工程(上海)股份有限公司并合成。引物序列参见表1。

表1 引物序列
1.2.3 病料处理
取-20 ℃保存的体表赘生瘤体样品,经研磨处理后以每管20~30 mg做为标准,于1.5 mL灭菌清洁的离心管中分装,做好标记-20 ℃冻存备用。
1.2.4 病料样品DNA的提取
具体提取步骤参照Omega公司E.Z.N.A.Tissue DNA Kit试剂盒说明进行,核酸检测仪内检测收集的DNA核酸浓度,封口,标记,-20 ℃保存备用。
1.2.5 PCR检测体系
采用50 μL PCR扩增反应体系:模板DNA 5. 0 μL,ddH2O 18. 0 μL,2×Tap Master Mix 25. 0 μL,引物Primer MY11 1. 0 μL,引物Primer MY09 1. 0 μL,混匀后瞬时离心。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s;47. 5 ℃退火30 s;72 ℃延伸1 min;35个循环,72 ℃延伸10 min。PCR扩增产物经1. 0%琼脂糖凝胶电泳检测,确定扩增片段大小。
取部分PCR产物,1. 0%琼脂糖凝胶电泳检测目的条带,拍照。将剩余PCR样品全部点样,切胶回收,回收步骤参照天根生物技术有限公司普通琼脂糖凝胶回收试剂盒说明书进行。
1.2.6 T载体连接和产物转化感受态细胞
取纯化产物参照天根T载体连接试剂盒进行转化连接,提取质粒送至北京金锘锐杰基因科技有限公司测序。
1.2.7 序列分析
经测序的阳性质粒,以3次完全相同的结果为标准,作为测序结果,将测序结果于NCBI数据库中进行在线Blastn比对,比对完成后在DNAStar软件MegAlign中与GenBank中下载的BPV参考毒株进行Clustal W核苷酸同源性比对分析;比对后序列与参考序列的L1基因利用MEGA 6.0软件采用邻近法行系统发育分析,绘制遗传进化树。参考序列参见表2。
2 结果
2.1 临床症状
患病牛右前肢关节处至蹄部可见明显体表赘生瘤体,呈结节乳头状瘤,颜色灰褐色至深褐色,大小不等,于膝关节至蹄部连接成片,质地坚硬,粗糙呈菜花状(图1)。

表2 GenBank中登录的BPV参考株序列

图1 牛乳头状瘤临床症状观察
2.2 病理组织学观察
将采集患病牛的皮肤体表赘生瘤经病理组织切片观察后显示,样品病理切片表皮细胞各层增厚,表皮角质化过度,颗粒细胞部分空泡化,并且存在嗜酸性包涵体(图2)[5,6]。

注:A:箭头所示为细胞空泡化;B:过度角质化
2.3 PCR检测结果
提取患病牛体表赘生瘤体样品DNA,通用引物MY11/MY09进行PCR扩增,经1%琼脂糖凝胶电泳检测出与预期大小相符的约为460 bp的片段(图3)。

注:M:DNA marker D2000;1:空白对照;2:PCR扩增片段图3 PCR扩增结果
2.4 BPV L1基因核苷酸序列同源性分析
以通用引物MY11/MY09扩增得到的序列,经测序后在NCBI中比对,结果表明,该测序序列与BPV-1型参考株的核苷酸同源性达到99%以上,命名为SY-12。与不同基因型的BPV参考株L1基因核苷酸序列同源性如下:与BPV-1型参考株(X02346和AB626705)的核苷酸同源性分别为99. 5%和99. 1%;与BPV-2型参考株(KC878306)和BPV-13型参考株(JQ798171)的核苷酸同源性均为83. 5%;而与BPV-3型参考株(AF486184)、BPV-4型参考株(X05817)、BPV-5型参考株(AF457465)、BPV-6型参考株(AJ620208)、BPV-7型参考株(NC-007612)、BPV-8型参考株(DQ098913)、BPV-10型参考株(AB331651)、BPV-11型参考株(AB543507)、BPV-12型参考株(JF834523)、BPV-9型参考株(AB331650)分别为60. 8%、56. 6%、62. 0%、59. 0%、59. 4%、62. 5%、57. 3%、57. 8%、62. 7%、59. 7%(图4)。
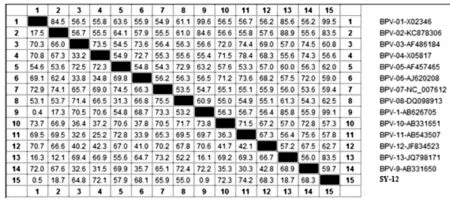
图4 多序列比对
2.5 遗传进化树分析
依据不同的BPV基因型L1基因参考序列,用MEGA6.0软件,采用Neighbor-Joining Method对SY-12与不同基因型BPV参考株进行同源性比较,构建遗传进化树如图5。从图中可以看出SY-12与参考株BPV-01型参考株X02346和BPV-1型参考株AB626705位于同一分支为BPV-1型牛乳头瘤病毒,同时与BPV-02型参考株KC878306和BPV-13型参考株JQ798171位于同一分支上为Delta属;证明SY-12株为BPV-1型乳头瘤病毒;BPV-5型参考株(AF457465)和BPV-8型参考株(DQ098913)位于同一分支上为Epsilon属;BPV-3型参考株(AF486184)、BPV-4型参考株(X05817)、BPV-11型参考株(AB543507)、BPV-10型参考株(AB331651)、BPV-9型参考株(AB331650)、BPV-6型参考株(AJ620208)、BPV-12型参考株(JF834523)位于同一分支上为Xi属;BPV-7型参考株(NC-007612)为未被定义的PV属[7]。

图5 参照部分L1基因构建遗传进化树
3 讨论
新疆南疆某养殖户疑似感染患病牛,经PCR检测、基因序列分析,确定该患牛感染BPV-1。
贺志昊在2014年对新疆北疆地区进行了BPV流行病学的调查,并得出主要流行株为BPV-2[8];王青青2015年检测出新疆南疆BPV-2型[5];史巧芸2015年在海南完成了对BPV-13的研究工作[9];彭昊2016年在广西检测出BPV-1[10];张海2017年在贵州检测出BPV-2型[11];证实在国内,新疆地区存在BPV不同基因型感染。
常规的临床检查并不能完全确定该病的发生,易造成漏诊、误诊情况的发生。L1基因是病毒基因组中保守的基因片段,被广泛用于基因分型。依据L1基因设计简并引物和通用引物常用于检测乳头状瘤病毒感染和基因型鉴定[12]。
参照核苷酸同源性比对分析和系统进化树分析,新疆南疆牛乳头瘤病毒序列SY-12株与BPV-01型参考株(X02346和AB626705)的核苷酸同源性分别为99. 5%和99. 1%,均为BPV-1型,并且与BPV-02型参考株KC878306和BPV-13型参考株JQ798171位于同一分支上为Delta属。通过核苷酸同源性分析发现,本实验发现SY-12株病毒基因型与BPV-01型参考株X02346的核苷酸同源性达到99. 5%,均为Delta属。
通过对新疆南疆BPV-1型SY-12株的基因分型鉴定,为下一步研究BPV-1型全长基因序列奠定基础,为后续新疆南疆地区动物感染乳头瘤病毒流行病学研究及病毒基因数据库的建立具有重要意义。

