重组人神经生长因子真核表达载体构建及其在毕赤酵母中的表达与纯化
黄志立,蒋伟,周烨,沈丽,王妍*
重组人神经生长因子真核表达载体构建及其在毕赤酵母中的表达与纯化
黄志立1,蒋伟1,周烨2,沈丽1,王妍1*
(1. 深圳职业技术学院 应用化学与生物技术学院,广东 深圳 518055;2.吉林大学 分子酶学工程教育部重点实验室,吉林 长春 130012)
研究构建了重组人神经生长因子(Recombinant human nerve growth factor,rhNGF)的一种真核表达载体,并转化毕赤酵母GS115.在hNGF基因序列基础上对其进行毕赤酵母偏好密码子分析与改造,然后构建重组质粒pPIC9K-hNGF,经PCR、酶切及测序验证后,转化酵母,利用遗传霉素筛选出高效表达rhNGF的重组酵母.表达产物经SDS-PAGE分析,结果见一条与hNGF分子质量15.7kDa相当的条带,蛋白表达量约为52.86%.将表达产物经初步纯化和进一步精提后,纯度超过98%.分别以鼠NGF产品和人NGF标准品为对照,利用TF-1细胞/MTS比色法检测NGF活性,结果表明rhNGF具有良好的生物学活性,其活性和比活性分别为5.0U/mL和253U/mg,高于鼠NGF产品(2.6 U/mL,130U/mg),与hNGF标准品相当(5.0 U/mL,250 U/mg).
重组;人神经生长因子;真核载体;毕赤酵母;生物活性
神经生长因子(Nerve growth factor,NGF)是最重要的神经系统生物活性分子之一,具有多种生物学功能,对调节中枢及周围神经元的生长、分化以及对损伤神经的再生修复具有重要意义[1].自1953年发现至今[2],大量的研究表明NGF是保护和治疗神经系统疾病的高效药物,其主要应用的适应证有多种类型的周围神经损伤、面神经炎、中小面积烧伤、帕金森综合症等[3],近来的研究还发现NGF在褥疮、角膜溃疡、青光眼治疗中发挥着积极的作用[4].
目前上市的NGF产品主要从小鼠的颌下腺中提取,但鼠源NGF应用在人类疾病治疗中可能存在诱发免疫反应、鼠源病毒交叉感染等危险,并且生产须依赖活体动物.而人hNGF在人体中含量极少,几乎不可能作为产品的生产来源,因此生产重组基因工程rhNGF是可考虑的主要途径.原核和真核表达系统各有其优缺点,已有的研究表明rhNGF已经在大肠杆菌、酵母、哺乳动物细胞、昆虫细胞以及动物乳腺中获得表达[3],但均存在产量低、成本高、产品活性不稳定等问题,国内至今没有rhNGF产品上市.本课题组长期进行rhNGF的开发及产业化研究,利用多种表达系统来制备hNGF.本实验构建一种可稳定表达天然活性β-NGF的重组表达载体pPIC9K-hNGF,转化至毕赤酵母GS115中,并从该细胞发酵液中分离纯化出具有生物活性的重组人β-NGF,为制备人NGF 提供实验基础.
1 材料与方法
1.1 主要材料、试剂
GS115、DH5α为深圳市大规模细胞培养平台实验室保存;pPIC9K载体购自美国Novgen公司;质粒提取试剂盒、PCR试剂盒为北京索莱宝科技有限公司产品;DNA回收试剂盒为北京百泰克生物技术有限公司产品;T4DNA连接酶、限制性内切酶B I、I、I等购自大连宝生物技术有限公司;蛋白质纯化层析柱均购自GE Healthcare公司;纯化小鼠颔下腺神经生长因子由珠海丽珠集团提供(批号20150305);hNGF标准品购自以色列prospecbio公司.其余试剂均为国产或进口分析纯.引物合成、基因测序和蛋白质谱分析委托上海生工生物工程公司完成.
1.2 hNGF基因的密码子优化及pUC57-hNGF重组载体的构建
于NCBI中查找到的人β-NGF基因序列(NM 002506),利用www.gcua.de网站进行毕赤酵母表达hNGF密码子偏好性分析,将其中毕赤酵母使用频率很低的密码子进行同义替换.同时,为便于后期成熟hNGF蛋白的分离纯化,在hNGF编码基因前添加了肠激酶识别位点(DDDDK)的编码序列.将优化好的序列委托上海生工生物工程公司进行全基因合成,并将其克隆至pUC57质粒上,得到了含有目的基因的重组载体pUC57-hNGF,经测序证实基因序列正确.
1.3 重组质粒pPIC9K-hNGF的构建
以pUC57-hNGF为模板,设计分别带有限制性内切酶B I和I识别位点的引物(表1),采用PCR法扩增hNGF基因.为了便于目的蛋白的纯化,上游引物中还加有编码6×His的序列,使得最终表达hNGF的N端带有6×His标签和肠激酶识别位点.PCR循环反应条件为:94℃变性30s,60℃退火30s,72℃延伸45s,32个循环.将PCR产物用DNA回收试剂盒进行回收,限制性内切酶B I和I进行双酶切并回收酶切片段,用0.8%的琼脂糖凝胶电泳检测.同上操作,将质粒pPIC9K进行双酶切,产物经回收检测后,与目的片段进行连接,产物转化DH5a感受态细胞,在含卡那霉素的平板上筛选到抗性菌落,提取质粒进行PCR和酶切鉴定并测序.
1.4 重组质粒pPIC9K-hNGF转化毕赤酵母及鉴定
提取重组质粒pPIC9K-hNGF,经I酶消化成线性,将产物纯化后备用.取80μL经冰冻山梨醇处理制成的毕赤酵母GS115感受态细胞与5-20μg线性质粒DNA混合,冰育5min,放入电穿孔仪2000V/mm、5ms进行电激.取200μL处理液铺MD平板,30℃过夜培养至菌落长出.挑取单菌落接种于微量测定板中(200μl YPD培养基/孔),轻轻搅动以悬浮细胞,30℃孵育2d后,吸取10μL培养液接种于新的每孔含190μL YPD培养基的微量测定板中,30℃孵育过夜,重复以上操作1次.准备10个YPD平板,分别加入遗传霉素至其终浓度依次为0,0.25,0.5,0.75,1.0,1.5,1.75,2.0,3.0及4.0mg/mL,将微量测定板上每个孔中的菌液分别接种到10个抗性平板的对应区域中,30℃孵育2~5d,待抗性克隆出现.挑取酵母单克隆富集培养,提取酵母染色体DNA,PCR检测阳性重组菌.PCR引物分别为特异引物(上游引物:TATACGGGATCCATGGACGATGATGAC;下游引物:ATACCGCTCGAGTTATCTCACAGCTT)和AOX通用引物(上游引物:GACTGGTTCCAATTGACAAGC;下游引物:GCAAATGGCATTCTGACATCC),PCR循环反应条件为:94℃,30s;50~60℃,30s;72℃延伸1000bp/min,32个循环,产物用0.8%的琼脂糖凝胶电泳进行检测.
1.5 rhNGF的诱导表达和鉴定
接种重组酵母单菌落于25ml的BMGY培养基,28-30℃培养至OD600为2-6.3000r/min,离心5min,弃上清,用约100mLBMMY培养基重悬细胞至OD600约为1,28~30℃震荡培养,每24h向加入甲醇至终浓度为0.5%以保持诱导表达.分别于0,24,48,72,96,120,144h取l mL培养物,离心,取发酵上清液,加入100μL三氯乙酸(TCA),振荡混匀,4℃静置30min,10000r/min离心10min,弃上清,沉淀中加入1mL-20℃预冷的丙酮,剧烈振荡后,4℃,10000r/min离心10min,弃上清,重复丙酮处理步骤1次,样品在室温静置30min后进行SDS-PAGE和质谱分析.

表1 用于扩增hNGF的PCR引物序列
1.6 rhNGF的纯化
将10L培养液低温离心15分钟收集上清液,超滤浓缩;经Ni2+-Chelating Sepharose FF柱层析分离,上样及洗脱流速为10~15mL/min.缓冲液C(20mmol/L TrisCl,0.75mol/L NaCl,pH8.0)充分洗脱平衡,上样后分别用缓冲液C和缓冲液D(20mmol/L TrisCl,0.75mol/L NaCl,pH7.0)各冲洗3~5个柱体积,最后用缓冲液E(20mmol/L TrisCl,0.75mol/L NaCl,pH6.5,0.1mol/L咪唑)为洗脱液,收集的含有目的蛋白的洗脱峰,再经过Sephadex G-25柱层析,缓冲液F(50mmol/L Tris-HCl,pH8.5)收集的含有目的蛋白的洗脱峰,与50mmol/L Tris-HCl(pH8.0),2mmol/L CaCl2,0.2%Tween-20(过滤除菌)等体积混合,按1U肠激酶对20ug融合蛋白加入肠激酶,37℃水浴16h.酶切产物再次经过Ni2+-Chelating Sepharose FF螯合层析,酶切之后的hNGF在流穿峰下来收集,最后经过Sephacryl S-300层析,其中缓冲液为20mmol/L PB(pH6.8),上样及洗脱流速为35mL/min.
1.7 rhNGF的活性测定
将层析收集得到rhNGF蛋白液进行SDS-PAGE电泳.hNGF活性测定采用中国药典四部(2015版)规定的TF-1细胞/MTS比色法[5],对照品分别为小鼠颔下腺神经生长因子(对照1)及hNGF标准品(对照2).细胞初始浓度为3´105个/mL,NGF活力单位起始浓度为15μg/mL,按1/4倍比稀释,培养48 h后分别经MTS染色于490 nm测吸光值,做两参数拟合曲线.
2 结果与分析
2.1 重组质粒pPIC9K-hNGF的鉴定
以pPIC9K-hNGF为模板,利用表1中所示的引物进行PCR鉴定,电泳结果如图1所示.目的基因大小为405bp,从图1中可以看出两个阳性克隆(泳道1、2)PCR扩增出的条带大小位置正确.利用限制性内切酶B I和I对重组质粒进行双酶切鉴定,得到两条片段大小分别为9259bp和398bp,结果与预期相符(图2).将该质粒委托上海生工生物工程公司进行测序,测序结果显示hNGF基因与设计一致,在重组质粒构建过程中没有发生突变.

M:Marker;1-2:Recombinant plasmid

M1-M2:Marker;1:Recombinant plasmid
2.2 毕赤酵母转化子的PCR鉴定
经高浓度遗传霉素筛选得到多拷贝转化子毕赤酵母,提取其染色体DNA进行PCR鉴定,结果如图3所示.使用hNGF特征引物进行PCR扩增,会得到大小约为400bp的条带,图3a中4个转化子均扩增出hNGF基因.使用AOX引物进行PCR扩增的结果,会得到大小约为2000bp和900bp的2条基因,由图3b可看出,4个转化子的PCR检测结果均与预期相符,以上结果表明重组质粒pPIC9K-hNGF成功以插入的方式整合到酵母基因组中.
2.3 重组酵母表达hNGF的SDS-PAGE和鉴定
将所筛选并鉴定后的重组毕赤酵母经甲醇诱导表达后,分别在不同时间取发酵上清液,用TCA-DOC法浓缩约60倍(900μL浓缩为15μL),将浓缩产物进行SDS-PAGE凝胶电泳.图4为分别诱导48h、96h和144h后发酵浓缩液中蛋白电泳图,目的蛋白的分子量约为15.7kDa,在相应位置处有明显条带;图5为表达产物的质谱的分析结果,其分子量为13319.8,与预期相符,说明重组毕赤酵母分泌表达了hNGF.根据电泳扫描分析结果可知rhNGF的表达量约为59.66mg/L发酵液,占总蛋白的52.86%.
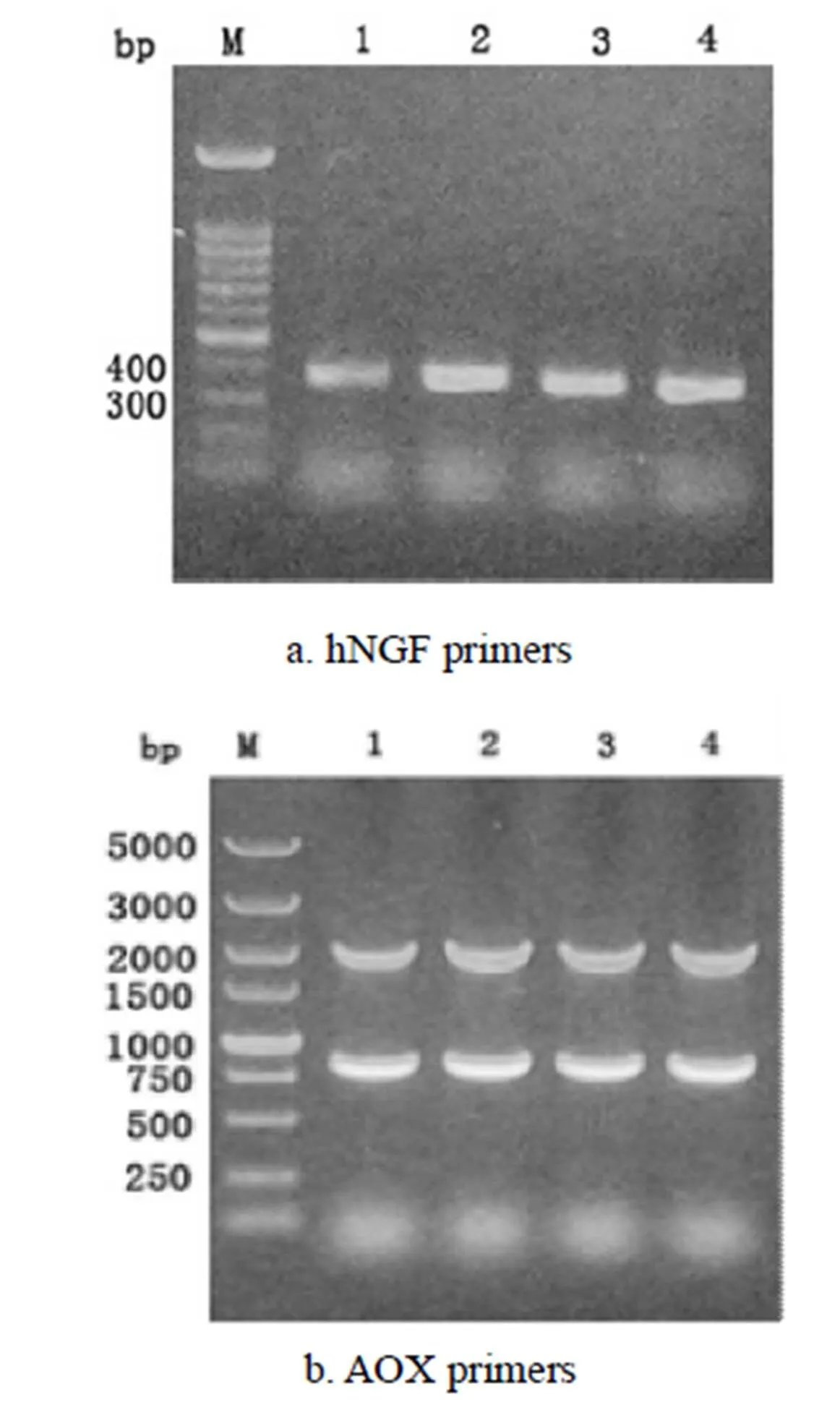
M:Marker;1-4:GS115 transformants
2.4 rhNGF的纯化
将重组酵母经诱导96 h后的发酵液经初步纯化后,采用了包括Ni螯合层析、酶切、脱盐、第二次Ni螯合层析、Sephacryl S-300层析等工艺来精提目的蛋白hNGF.取三批纯化后的hNGF蛋白进行SDS-PAGE电泳,结果如图6所示.从结果看到三批蛋白纯化后的目的蛋白在13.4kDa,表明酶切后成功得到目的蛋白,且纯度分别为98.6%、100%和100%,据中华人民共和国药典三部的规定,其纯度超过95%为合格.
2.5 rhNGF的活性分析
取三批纯化后重组hNGF样品,采用中国药典(2015版)规定的TF-1细胞/MTS比色法测定其活性,分别以小鼠颔下腺神经生长因子(对照1)和hNGF标准品(对照2)为对照,检测过程中发现,rhNGF对细胞增殖有较为明显的促进作用,且随rhNGF活力单位的增加而加速增长,当rhNGF高于一定浓度(500U/ml)细胞增殖出现抑制.经该法检测到的NGF样品的活性结果见表2.

M:Marker;1-3:rhNGF expression of recombinant yeasts in 48,96 and 144h

图5 重组酵母表达rhNGF的质谱分析图谱

M:Marker;1-3:rhNGF after purification
从表2可见,利用本文表达系统表达和纯化的目的蛋白,三批样品的活性分别为4.8U/ml、5.3U/ mL和5.1U/ mL,平均为5.0U/ mL,三批样品的比活性分别为240、265和255 U/mg,平均为253U/mg;而阳性对照品小鼠颌下腺提取的NGF标准品的活性为2.6U/ mL,比活性为130U/mg.hNGF标准品的活性为5.0 U/ mL,比活性为250 U/mg,说明本文经过改构基因表达的NGF活性基本达到基因原型表达的NGF活性水平,同时高于目前上市的动物提取的NGF.

表2 重组hNGF样品和2种对照品的活性结果
3 讨 论
NGF是Rita Levi-Montalcini等人对现代生物学的重要贡献,该成果获得1986年诺贝尔医学生理学奖.NGF是一种多肽蛋白复合物,由数量不等的3种不同的亚基组成,分别为α亚基(2个)、γ亚基(2个)和β亚基(1个),其中β亚基是NGF的活性区,所以NGF现多指β-NGF.β亚单位是一种二聚体,其生物活性取决于三对二硫键,若二硫键结构不正确,NGF的将丧失其生物活性[3].
NGF是各类神经损伤性疾病的高效药物,也是目前唯一可应用于临床的神经系统蛋白质因子,它的适应证随着新的研究还在不断扩大,2017年7月EMA批准了意大利Dompé公司的重组人神经生长因子滴眼液用于中重度神经营养性角膜炎治疗.最近的研究发现,如果以滴眼液的形式给药,可将NGF经视神经传递到视神经节细胞,并可穿过血眼屏障,实验证明通过鼻和眼部局部能够使NGF到达脑部.这些研究为NGF治疗眼部疾病和中枢神经系统疾病提供了新的给药途径,使NGF的医学价值变得更加凸现[4].
鼠NGF与人NGF同源性高,可达90%.鼠NGF提取自小鼠颌下腺,提取工艺简便,NGF活性也较高,故成为第一个上市的NGF.目前国内有四家企业生产鼠颌下腺提取的NGF,分别为“恩经复”(厦门北大之路生物工程公司)、“金路捷”(武汉海特生物制药公司)、“苏肽生”( 北京舒泰神药业)和“丽康乐”(珠海丽珠集团).鉴于鼠NGF与人NGF在蛋白序列上存在10%的差异,容易诱发抗体反应,且存在交叉感染、生产依赖活体动物等缺点,人源性NGF才是药用NGF更合理的来源,而利用基因工程生产rhNGF几乎是开发hNGF药物的唯一选择.
蛋白质的原核和真核表达各有其优缺点.文献[6,7]利用表达rhNGF,但表达的外源蛋白多为包涵体,需要进行体外复性,而NGF中三对二硫键的存在很可能造成复性困难导致生物活性不稳定,这些研究结果与我们早期研究结果相似.文献[8,9]利用CHO细胞,文献[10]利用HEK293细胞均实现了rhNGF在哺乳动物细胞中的表达.此外也有研究报道rhNGF可在昆虫细胞[11]、动物乳腺[12]中表达.哺乳动物细胞在表达rhNGF的研究中具有独特的优势,但比较而言表达量低、成本高,且由于hNGF特殊的分子结构,使得其产业化进程缓慢,至今仍无rhNGF产品上市.
酵母表达系统具有特别的优势,它既能克服原核系统不能对真核生物蛋白翻译后修饰加工的缺陷,又具有易培养、成本低、表达量高等优点,目前国内外相关报道较少.本课题组早在2007年就开展了利用毕赤酵母表达rhNGF的研究[13],人工合成hNGF全基因组片段,构建了重组质粒pPIC9K/rhNGF,转化毕赤酵母,得到具有一定表达量的重组酵母,但表达产物为融合蛋白,且融合蛋白的表达量也只约50%,后续纯化工艺复杂.文献[14]利用人胎盘DNA为模板PCR扩增出hNGF基因,利用pPIC9K载体构建了重组质粒,转化甲醇酵母并对表达蛋白进行了电泳分析,但未就后续的表达进行研究.分析原因以上,可能与酵母表达系统对基因密码子的偏好性有关,人源的NGF基因密码子在酵母细胞里翻译效率不高,导致表达量不理想.因此本研究在已有研究的基础上,对hNGF的基因序列进行了毕赤酵母偏好密码子改造,并且为便于外源蛋白的分离纯化添加了肠激酶识别位点,所构建的重组酵母成功表达了rhNGF,表达量约为59.66mg/L发酵液,占总蛋白的52.86%,其表达量与李景传等人的利用哺乳动物细胞表达hNGF的结果相当[10].所表达蛋白经系列工艺纯化后,纯度超过95%,其活性相当甚至优于市售鼠NGF商品及hNGF标准品.说明本研究中的基因密码子改造在获得了较好的表达量的同时,也未影响表达产品的天然结构和生物活性.与哺乳动物细胞表达结果相比,酵母在发酵和培养成本及工艺上具有明显优势,该研究为rhNGF规模生产和临床应用奠定了良好的实验基础.
[1] Minnone G, De F, Braccilaudiero L. NGF and Its Receptors in the Regulation of Inflammatory Response[J]., 2017,18(5):1028-1035.
[2] Badowska-Szalewska E, Krawczyk R , Ludkiewicz B. The effect of mild stress stimulation on the nerve growth factor (NGF) and tyrosine kinase receptor A (TrkA) immunoreactivity in the paraventricular nucleus (PVN) of the hypothalamus and hippocampus in aged vs. adult rats[J].2015,290(2):346-356.
[3] 沈丽,王妍.神经生长因子的研究及应用进展,微生物学免疫学进展[J].2015,43(6):48-52.
[4] Manni L, Rocco M L, Bianchi P, et al. Nerve growth factor: basic studies and possible therapeutic applications[J]., 2013,31(4):115-122.
[5] 国家药典委员会.中华人民共和国药典(四部,通则)[M].2015:280.
[6] 姜静,姜桂香.来源于和CHO表达系统的重组人β-NGF性质比较[J].中国生物工程杂志,2006,26(2):8-12.
[7] He L B,Wang Y,Wang G.Expression and purification of active recombinant human nerve growth factor from Escherichia coli[J]., 2007,23(2):237-240.
[8] 乐伟,彭璐佳,史权威,等.重组人神经生长因子的高效表达和生物活性评价研究[J].中国药事,2014,28(6):601-606.
[9] 陈勇,蒋琳,杨军,等.人β-NGF真核表达载体的构建及其表达产物的生物活性[J].中国生物制品学杂志,2005,18(6):457-460.
[10] 李景传,薛博夫,袁媛,等.重组人神经生长因子rh-β-NGF真核表达载体的构建及其在HEK293细胞中的表达[J].生物工程学报,2015,31(3):411-420.
[11] 李佳楠,王玲,吕新凯,等.重组人β-神经生长因子在昆虫细胞中的表达、纯化及其生物学活性[J].中国生物制品学杂志,2013,26(3):332-335.
[12] Xiao B,Li Q W,Feng B,et al.High-level expression of recombinant human nerve growth factor beta in milk of nontransgenic rabbit[J].,2008,105(4):327-334.
[13] 王革,王妍,孙海波,等.酵母分泌表达重组人神经生长因子[J].食品与药品,2007,9(1):9-11.
[14] 舒红,任常山.甲醇酵母高表达人神经生长因子的检测及意义[J].中华检验医学杂志,2004,27(1):37.
Construction of Recombinant Human Nerve Growth Factor Eukaryotic Vector and Its Expression and Purification in Yeast
HUANG Zhili1, JIANG Wei1, ZHOu Ye2, SHEN Li1, WANG Yan1
()
In this study, a recombinant plasmid vector was constructed, which can efficiently express human nerve growth factor (rhNGF) inGS115. First, gene sequences of hNGF were modificated based on codon usage bias of. The recombinant plasmid of pPIC9K-hNGF was constructed and its gene sequences were confirmed by PCR, restriction endonuclease digestion and sequencing. SDS-PAGE analysis revealed that the expression product owned a molecular weight of about 15.7 kDa with a protein express amount of 52.86%. After being purified by multiple separate processes, the hNGF protein was yielded with a purity of more than 98%. Biological activities of rhNGF were detected by TF-1 cells /MTS method in contrast with mouse NGF product and hNGF standard sample. Results showed that both biological activities and specific activities of rhNGF (5.0ng/mL, 253U/mg) were superior to mouse NGF product(2.6 ng/mL,130U/mg)and similar to hNGF standard sample(5.0 ng/mL,250 U/mg).
recombinant; human nerve growth factor (hNGF); eukaryotic Vector;; biological activities
10.13899/j.cnki.szptxb.2018.05.007
2018-05-10
广东省教育厅产学研结合资助项目(2012B091100408)和广东省深圳市创新委新兴产业公共技术服务平台资助项目(GGJS20130331152344401)
黄志立(1974-),女,四川兴文县人,副教授,博士,主要从事生物技术应用研究.
王妍,博士,研究员,从事生物制品的研究开发(E-mail:wangsusan@szpt.edu.cn).
R346;Q78
A
1672-0318(2018)05-0041-06

