液相芯片法验证蛋白质免疫印迹试验检测HIV-1结果的敏感性和特异性
李艳 潘彤 李浩龙 孔伟伟 袁玉华
作者单位:300308 天津,天津医科大学总医院空港医院检验科(李艳、袁玉华)
300052 天津,天津医科大学总医院检验科(孔伟伟)
300110 天津,天津市血液中心(潘彤、李浩龙)
目前在临床上血液筛查人类免疫缺陷病毒(human immunodeficiency virus,HIV)最常用的方法为酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)。到目前为止,HIV-1的ELISA试剂已经发展至第4代[1-4]。1983年美国食品药品监督管理局(Food and Drug Administration,FDA)批准了第1个HIV抗体检测试剂,即第1代HIV诊断试剂,用于献血员的筛查,其原理为采用间接ELISA法,用纯化裂解病毒的HIV抗原和部分纯化的抗原检测HIV免疫球蛋白G(IgG)抗体,这种病毒裂解物中不仅含有较多杂抗原,而且抗原的制备和纯化都比较困难,假阳性率和假阴性率均较高,窗口期较长[5]。基因工程技术的快速发展给HIV抗原的获得提供了新的途径,1990年5月HIV第2代诊断试剂面市,它通过间接ELISA法用基因工程重组或合成的HIV多肽抗原检测HIV-1/2的IgG抗体,其制备安全、重复性好,与第1代试剂相比敏感度和特异度均有较大提高[6]。1994年,第3代试剂的反应模式由前两代的间接法改为双抗原夹心法检测标本中的抗体,酶标记物由特异性HIV抗原代替抗人IgG,可检测HIV不同的抗体亚型HIV-1/2/O的IgG/M/A,敏感度和特异度均高于第1代和第2代试剂,改善了O群标本的反应性,窗口期缩短至22 d[5],也是目前国内外HIV检测的主流方法。第4代试剂采用双抗原或抗体夹心法,用重组或合成的HIV多肽抗原、P24单克隆抗体固相包被检测HIV-1/2/O的IgG/M/A抗体、P24抗原,提高了血清阳转前标本的检出率[7],且HIV-1早期筛查的效果优于第3代试剂[8]。
ELISA法检测HIV的敏感度较高,但检测结果易出现假阳性,HIV抗体假阳性受检者不仅要承受巨大的心理压力,而且要承受不必要的治疗,造成医疗资源浪费。对采血机构来说,假阳性结果还会造成大量血液的报废和献血员永久性丢失。
针对目前常规HIV-1的ELISA检测试剂存在的上述问题,我们采用液相芯片法,对蛋白质免疫印迹试验(Western Blot)确认阳性及阴性样本进行HIV-1 gp120、gp41、p24单片段抗原检测抗体分析,现报告如下。
1 材料与方法
1.1 仪器与试剂 Luminex-200(美国Luminex公司);电动涡旋器VSM-3(美国PRO Scientific Inc.);超声仪KQ-700DV型(昆山市超声仪器有限公司);高速离心机(德国Heraus公司);空气浴振荡器(HZQ-C哈尔滨市东联电子技术开发有限公司);Milli-Q纯水系统(日本Millipore公司);Eppendorf微量加样器(美国Eppendorf公司)。HIV-1 gp120、gp41、p24抗原(北京万泰公司);Luminex微球(50#、56#、71#),抗体偶联试剂盒(美国Luminex公司);ELISA初检试剂(HIV抗原抗体诊断试剂盒,北京万泰公司、北京金豪公司),复检试剂(HIV抗原抗体诊断试剂盒,法国生物梅里埃、法国Bio-Rad);生物素化二抗(美国BD公司);SA-PE(美国Ivitrogen公司);96孔板(美国康宁公司);锡箔纸,普通生化试剂(天津联星生物技术有限公司)。受检标本:均来自天津市血液中心。
1.2 检测方法
1.2.1 微球的包被 HIV-1的gp120、gp41、p24蛋白和微球的偶联方法按照美国Luminex公司操作手册进行操作。
1.2.2 液相芯片法检测 采用液相芯片法对经ELISA法初检和复检为HIV-1阳性而Western Blot检测HIV-1确认试验为阴性的样本进行检测:① 加样前用100 μL/孔的分析缓冲液润湿96孔板;② 加入阴性血清和用分析缓冲液稀释25倍的阳性血清(25 μL/孔);③ 加入混匀稀释好的微球(确保 100个 /μL,25 μL/孔);④ 室温震荡培养1 h;⑤ 室温3 500 r/min离心5 min,弃去上清液;⑥ 125 μL/孔洗涤缓冲液洗涤微球,3 500 r/min离心5 min,弃去上清液;⑦ 重复第6步2次;⑧ 加入稀释好的生物素化二抗(2 mg/L,25 μL/孔);⑨ 室温震荡培养1 h;⑩ 室温3 500 r/min离心5 min,弃去上清液;125 μL/孔缓冲液洗涤微球,3 500 r/min离心5 min,弃去上清液;每孔加入20 mg/L SA-PE 25 μL;室温震荡孵育30 min;室温3 500 r/min离心5 min,弃去上清液;125 μL/孔洗涤缓冲液洗涤微球,3 500 r/min离心5 min,弃去上清液;加入125 μL/孔洗涤缓冲液重悬微球,采用Luminex-200检测,Luminex-100软件分析。
1.3 统计学分析 本研究绘制受试者工作特征曲线 (receiver operating characteristic curve,ROC),评估ELISA法和液相芯片法对HIV-1抗体的检测价值。P<0.05为差异有统计学意义。
2 结果
2.1 3种微球截断值 用液相芯片法测定3种微球的cut-off值,即HIV阴性标本的平均荧光强度(mean fluoresence intensity,MFI)+2× 标准差(SD),见表 1。

表1 76份HIV ELISA阴性标本不同免疫微球的截断值
2.2 HIV-1的 gp120、gp41、p24单片段抗原检测不同样本结果 应用液相芯片法对Western Blot确认HIV阳性及阴性样本进行HIV-1 gp120、gp41、p24抗体的分析。结果显示,根据《艾滋病检测技术规范》判定标准,55份Western Blot检测确认HIV-1阳性样本,液相芯片法检测全部为阳性,符合率100%;76份ELISA初检和复检阴性标本HIV-1 gp120、gp41、p24片段检测均为阴性;86份ELISA检测初检和复检为阳性,而Western Blot检测确认阴性样本,其HIV-1 gp120、gp41、p24单片段抗原检测均阴性。见表2。

表2 液相芯片法检测标本HIV-1 gp120、gp41、p24单片段抗原结果
2.3 ROC曲线分析 液相芯片法检测HIV-1抗体的敏感度(100%)和特异度(100%)均较ELISA法检测HIV-1抗体好,两种方法检测HIV-1抗体比较差异有统计学意义(P<0.05)。见图1。
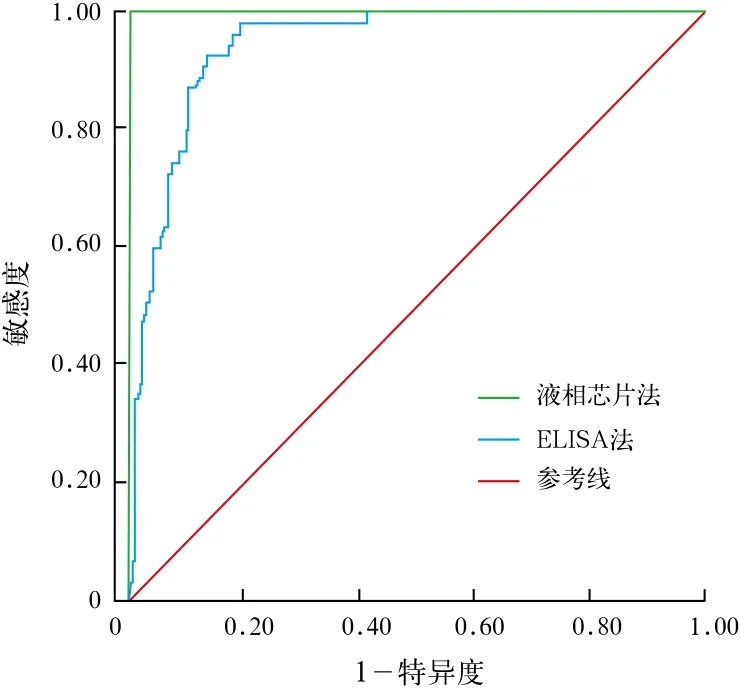
图1 两种方法检测HIV-1抗体的ROC曲线
3 讨论
ELISA法检测HIV抗体造成假阳性的原因是多方面的,如试剂质量(试剂材料的纯度、检测体系的优化)、样本(某些自身免疫性疾病造成的血浆蛋白出现异常)等,都会影响试剂的特异性。
被誉为“后基因组时代芯片技术”的液相芯片技术于20世纪90年代中期开始发展,又称为悬浮芯片技术、多功能悬浮点阵技术、Luminex技术或xMAP技术。液相芯片技术最突出的优点为仅需少量样本即可同时定性、定量检测同一样本中的多种不同目的分子,即多重检测。同时液相芯片技术具有很高的敏感度和特异度,载体微球表面积大,每个微球上可包被10万个捕获抗体或抗原,如此高密度的捕获抗体或抗原保证了能够最大程度地与样本中的抗原或抗体分子结合,提高了检测的敏感度,最低检测浓度可达到0.1 ng/L。每种微球检测100个,将最终读取荧光强度的中值作为结果,这相当于对每个样本重复检测100次,而ELISA法仅为双复孔或三复孔,因此液相芯片法检测结果的准确性和重复性是ELISA法无法比拟的。同时液相芯片法的敏感度也远高于任何现有的分析和诊断方法以及其他芯片法,已广泛应用于国内外科研和临床检测[9-10]。
采用液相芯片法对组成HIV-1 ELISA试剂的主要包被抗原HIV-1 gp120、gp41、p24单片段分别进行检测,Western Blot法确认阳性样本检测符合率为100%;对ELISA法初检和复检阴性标本检测符合率也为100%;对ELISA法检测初检和复检阳性、Western Blot检测确认阴性样本的阴性符合率为100%。说明液相芯片法检测HIV-1的敏感度和特异度均明显高于ELISA检测试剂。
影响试剂敏感度和特异度的因素很复杂,除了HIV-1 gp120、gp41两个片段,还有HIV-2 gp36(第3代试剂)和P24单克隆抗体(第4代试剂)组成的ELISA试剂,已有研究显示HIV-1 ELISA试剂因多个抗原甚至抗体共同包被于微孔板,可能会造成免疫反应的空间位阻,影响检测的敏感度和特异度,而采用液相芯片法则可避免此效应[11],液相芯片法和Western Blot法联合检测可以提高HIV抗体检测的敏感度[12]。设想采用液相芯片技术组成的HIV-1抗体检测系统(如在本检测系统应用前加上HIV-2抗原片段)将成为新一代检测试剂,发展前景良好。

