大鼠骨骼肌卫星细胞诱导分化为胰岛素生成细胞的研究
任宇 梁红宇 楠吉桑漠 刘晓玲
作者单位:010017 呼和浩特,内蒙古自治区人民医院临床医学研究中心
近年来糖尿病发病率在世界范围内呈现明显的上升趋势,已成为继心血管疾病、肿瘤之后第三大慢性非传染性疾病,严重影响人类健康而且给国家和社会带来沉重的经济负担。目前全世界约有3.76亿糖尿病患者,到2030年预计这一数字将达到4.49亿[1]。在我国目前约有9 400万糖尿病患者,糖尿病平均发病率达到4.8﹪以上,已成为目前糖尿病患病人数最多的国家。
随着科技的发展、医学的进步干细胞替代治疗成为糖尿病治疗一项非常重要的策略之一。其中干细胞来源主要包括:(1)全能型胚胎干细胞和诱导型多能干细胞,它们具有分化为胰岛β细胞的能力但受到伦理学的限制且在体内容易形成畸胎瘤[2];(2)专能型胰岛干细胞,能够分化为功能成熟的胰岛β细胞,但目前还没有找到对其进行高效分离、纯化及鉴定的方法[3];(3)多能型间充质干细胞,来源丰富、易于培养,但增殖能力有限而且还存在分化效率低等问题[4-5]。
骨骼肌卫星细胞(muscle-derived satellite cells,MDSCs)是存在于骨骼肌肌膜和基底膜之间的多能干细胞,取材方便、分离方法简单易操作,体外增殖能力强且基因稳定性高[6],细胞免疫原性低适合细胞移植且无致瘤性,基于以上优点MDSCs被认为是未来用于干细胞治疗的理想种子细胞。在体外培养MDSCs的研究中发现MDSCs能够向培养液中分泌趋化因子受体及多种细胞因子如表皮生长因子、血管内皮生长因子、成纤维生长因子等,趋化因子受体能够促使MDSCs向受损的胰岛迁移。以上研究结果表明,利用MDSCs移植促进胰岛β细胞再生的方法是可行的[7]。在前期探索中发现,MDSCs在体外可以定向分化为成骨细胞、成熟肌管细胞、神经细胞等。低糖DMEM+DMSO诱导3 d后MDSCs开始变为圆形并聚集成为胰岛样的细胞团块,更换高糖DMEM诱导10 d后,部分细胞双硫腙染色阳性,说明它们很有可能就是胰岛样细胞团,但是阳性细胞率较低,说明诱导方法仍需进一步改善。因此,本研究将探讨如何高效率地将MDSCs诱导分化为胰岛素生成细胞(insulin producing cells,IPCs)及MDSCs-IPCs功能的完整性,这将为MDSCs移植治疗糖尿病提供新方法、新思路。
材料与方法
一、主要材料
1.实验动物:免疫缺陷(NOD-SCID)小鼠购自北京维通利华实验动物技术有限公司。SPF级Sprague-Dawley(SD)大鼠购自内蒙古大学哺乳动物繁殖生物学与生物技术重点实验室。大鼠胚胎干细胞(embryonic stem cell,ESCs)和 β 细胞购自中科院上海细胞库。
动物伦理声明:本文中所有动物实验由内蒙古自治区人民医院伦理委员会批准,同时遵循国际医学科学组织理事会颁布的《涉及动物的生物医学研究的国际指导原则》。
2.试验试剂及耗材:Ⅳ型胶原酶、Ⅰ型胶原酶、0.25﹪胰蛋白酶、明胶、DMSO等购买于美国Sigma公司;DMEM、PMI、PBS、B27等购买于美国Invitrogen公司;FBS、HS购买于美国Gibco公司;Insulin等抗体购买于美国Abcam公司;100 mm培养皿、6孔细胞培养板、冻存管等均购自美国Corning 公 司;KGF、Noggin、GLP-1、IGF-I、 HGF等细胞因子均购自美国BD公司。
二、方法
1.MDSCs体外分离、纯化与培养:无菌条件下取10日龄大鼠腿部骨骼肌组织5 g并尽可能剔除血液、结缔及脂肪组织等杂物。首先显微镜下用眼科剪将组织剪至1 ~ 2 mm大小,分装入50 ml无菌无酶离心管中,随后加入与组织等体积的含0.1﹪Ⅳ型胶原酶的PBS。然后将离心管置于摇床中37 ℃恒温震荡酶解;60 min后100×g离心5 min弃上清液并加入0.25﹪胰蛋白酶于37 ℃培养箱中静置孵育,20 min后加入FBS中止消化反应并离心弃上清液。最后用MDSCs生长培养基(DMEM/F12+20﹪ FBS+10﹪HS+1﹪青/链霉素)重悬细胞沉淀并经200目细胞筛网过滤,过滤后的细胞悬液经离心后接种于细胞培养板并采用Gharaibeh等[8]报道的差速贴壁法纯化大鼠MDSCs。
2.MDSCs标记蛋白鉴定:以1×105个/ml的密度将纯化后的MDSCs接种于24孔细胞培养板内,待其生长至80﹪汇合时利用免疫组织化学的方法鉴定 MDSCs中 MyoD1、Desmin、PAX7、Myf5和α-Sarcomeric Actinin的表达。其中,二抗为FITC标记,DAPI为细胞核染料,PBS替代一抗作为阴性对照,共聚焦显微镜下同时观察实验组和对照组细胞染色情况。
3.MDSCs 致瘤性分析:为了证明MDSCs在体内应用的安全性首先进行畸胎瘤实验。首先分别收集第5代的大鼠ESCs和MDSCs,PBS重悬细胞沉淀至1×107个/ml,然后取0.5 ml细胞悬液分别注射到6周龄NOD-SCID小鼠腋背部皮下,每组设10个重复。3 ~ 4周后,检测畸胎瘤的形成情况并对瘤体进行HE染色。
4.MDSCs体外诱导分化为胰岛素分泌细胞技术体系的建立:(1)成胰诱导:MDSCs接种于100 mm培养皿中,待其生长至70﹪以上汇合时更换为成胰诱导培养基。成胰诱导第一阶段培养基 RPMI+25 ng/ml Wnt3a+100 ng/ml Activin A 培养1 d后于RPMI+0.2﹪FBS+100 ng/ml Activin A继续培养2 d此时第一阶段的诱导完成。接着进行第二阶段的诱导,更换诱导培养基为RPMI+2﹪FBS+25 ng/ ml KGF(Keratinocyte Growth Factor)培养3 d。第三阶段的诱导培养基为 DMEM+1﹪B-27 + 2 u mol/L Retinoic Acid + 0.25 u mol/L Cyclopamine + 50 ng/ml Noggin,诱导 3 d 后进入第四阶段。第四阶段的诱导培养基为 DMEM+1﹪B-27+10 m mol/L Nictinamide+100 nmol/L GLP-1(Preproglucagon 72-107 amide),继续诱导 3 d。最后进入第五阶段更换诱导培养基为 IMDM+1﹪B27+10 m mol/L Nictinamide+100 n mol/L GLP- 1+50 ng/ml IGF-1(Insulin-like Growth Factor 1)+50 ng/ml HGF(HumanHepatocyte Growth Factor),继续诱导培养3 d。只加入MDSCs基础培养基细胞作为对照组与诱导组在同一条件下进行培养。(2)双硫腙(DTZ)染色:成胰诱导结束后弃掉原培养基,诱导组和对照组细胞同时加入100 : 1(培养基:STZ贮存液)DTZ并置于37 ℃培养箱孵育,15 min后弃去培养基,PBS清洗3次,显微镜下观察不同组别细胞的着色情况。(3)Q-PCR和Western Blot检测C-peptide和Insulin的表达:以β细胞为对照,GAPDH为内参基因,通过Q-PCR和Western Blot分别检测MDSCs-IPCs中C-peptide和Insulin mRNA及蛋白相对表达量。(4)MDSCs-IPCs生物学功能鉴定:以β细胞为对照,首先分别将4×105MDSCs-IPCs或β细胞置于24孔细胞培养板,每孔加入1640培养液平衡培养,12 h后吸出培养液并用无糖无血清1640培养液清洗3次,30 min后吸出培养液并加入低糖、无血清1640培养液继续培养。24 h后留取上清液并加入高糖、无血清1640培养液继续培养。24 h后留取上清液,用ELISA试剂盒检测不同组别胰岛素分泌情况,每组设3个重复孔,重复3次。
三、统计学分析方法
采用SPSS Statistics 19统计软件,SUVmax数据以± s表示,β细胞和MDSCs-IPCs两组间SUVmax比较采用两样本t检验,以P< 0.05为差异有统计学意义。
结 果
一、细胞形态
经Gharaibeh差速贴壁法初次接种细胞2 h后,大部分杂细胞均已贴壁,此时吸出培养液及其中未贴壁细胞并再次移入明胶处理后的6孔细胞培养板中贴壁培养,二次接种的大多数细胞即为MDSCs,呈圆形、折光性强(图1a)。二次接种细胞培养12 ~ 14 h后开始贴壁且呈现梭形或多角形,仍有部分细胞未贴壁,可能为死细胞(图1b);二次接种培养48 ~ 72 h后细胞完全贴壁并逐渐延展为典型的多角形或梭形(图1c)。以上结果表明,MDSCs贴壁时间为48 ~ 72 h,非MDSCs杂细胞在贴壁时间为2 h,通过细胞贴壁时间差即可去除杂细胞保证原代MDSCs的纯度。
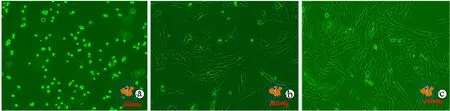
图1 倒置显微镜下观察不同时期原代 MDSCs形态特征(×100)
二、MDSCs标记蛋白的表达
本研究中分离、纯化得到的MDSCs经免疫组化检测均表达 MyoD1、Desmin、PAX7、Myf5和α-Sarcomeric Actinin且蛋白密集于胞浆中,细胞核位于细胞中央DAPI复染呈蓝色,未检测到上述蛋白的表达(图2)。
三、MDSCs 致瘤性
细胞注射3 ~ 4周后,观察到注射ESCs后NOD - SCID小鼠皮下畸胎瘤形成率为85﹪(图3),而注射MDSCs组小鼠皮下无畸胎瘤形成。经石蜡切片、HE染色后发现,畸胎瘤内部可形成类似外胚层来源的表皮组织、类似中胚层来源的肌肉组织和类似内胚层来源的腺体组织。结果表明与ESCs相比,应用MDSCs进行自体细胞治疗在体内没有致癌作用,更加可靠、更加安全。
四、MDSCs 体外诱导分化为IPCs
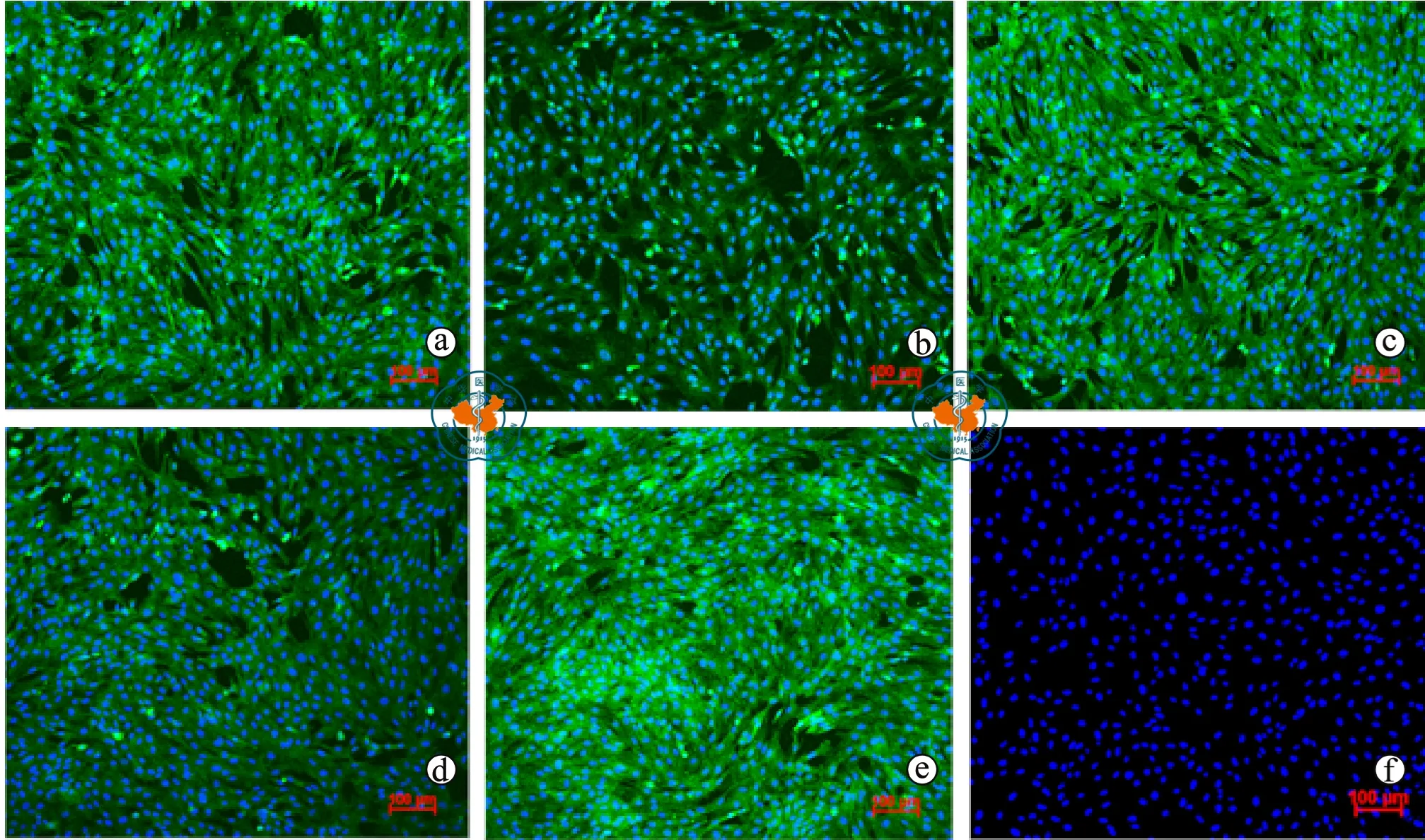
图2 倒置显微镜下观察MDSCs免疫组化染色情况(绿色荧光染色,×100)
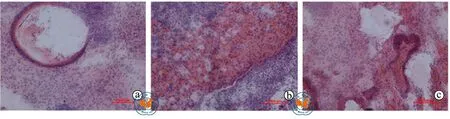
图3 倒置显微镜下观察畸胎瘤三胚层分化情况(HE染色,×200)
在成胰诱导第一阶段MDSCs细胞形态无明显变化,仍为多角形或梭形且细胞核清晰可见。在诱导第二阶段MDSCs迅速增殖并逐渐向一个方向聚集,聚集后的细胞团折光性明显增强。诱导第三阶段细胞形态发生改变,胞质减少、由典型的成纤维细胞样转变为内皮细胞样呈现圆形或椭圆形,细胞体积变小、边缘呈锯齿状并相互嵌合。第四阶段细胞的形态与第三阶段对比无明显变化,细胞继续成簇增殖。第五阶段,簇状细胞团增多,呈现立体状,形态接近β细胞团。经DTZ染色后大部分MDSCs-IPCs细胞团被染成猩红色,部分单个细胞也被染成猩红色,证明胰岛素分泌细胞的存在(图4)。Insulin免疫组化染色阳性。对照组细胞形态无明显改变,DTZ染色阴性,Insulin免疫组化染色阴性。

图4 MDSCs诱导分化为IPCs(×100,NIKON A1)
Q-PCR结果显示成胰诱导后MDSCs-IPCs中C-peptide和Insulin mRNA表达量分别是β细胞的0.73 倍(P> 0.05)和 0.79 倍(P> 0.05),差异无统计学意义。Western Blot结果同样显示MDSCs-IPCs中有 C-peptide和 Insulin蛋白的表达(图 5)。表明成胰诱导后MDSCs-IPCs可表达C-peptide和Insulin蛋白,且表达量较β细胞差异无统计学意义。

图5 C-peptide和Insulin在成胰诱导后MDSCs-IPCs中的表达
胰岛素释放实验:β细胞和MDSCs-IPCs在基础培养液中培养24 h后,分别用5.6 mmol/ L葡萄糖条件培养和16.7 nmlol/L葡萄糖的条件培养基刺激培养2 h后β 细胞和MDSCs- IPCs胰岛素分泌量分别为 [(21.3±4.1)mU/L]和 [(16.1±3.7) mU/ L],差异具有统计学意义(t=1.63,P< 0.05),[(60.5±9.3) mU/ L]和 [(40.9±7.3)mU/L],差异具有统计学意义(t=1.77,P< 0.01)。
讨 论
研究表明,糖尿病是全世界人类死亡的第三大原因。胰岛素替代疗法是目前已经被认可的一种治疗糖尿病的方法。然而,这种治疗方法有许多缺点,前景并不乐观。因此,寻找β细胞替代物或不同来源的β细胞成为未来治疗糖尿病的必然趋势。干细胞是具有多向分化潜能的一类细胞,它们来源丰富、增殖能力强,易于从供体中获取,具有免疫赦免性,是胰岛β细胞的理想来源。近年来,越来越多的研究表明,MDSCs可以被诱导为形态和结构与胰岛形态非常相似的胰岛β型细胞[6,9],但未对其功能进行进一步说明。在研究中,对照组细胞也能形成细胞簇,但这些细胞形状不规则、发散,双硫腙染色阴性;诱导组细胞双硫腙染色阳性,说明细胞中存在胰岛素,与前人的研究结果相似。在生理条件下,胰腺中的胰岛素产量逐渐增加,这是因为胰腺中的胰腺干细胞补充了β细胞进一步增加了胰岛素的产量[10]。
Peck等[11]研究团队报道在成胰诱导培养基中加入12 mmoL尼克酰胺可以提高骨骼肌卫星细胞体外诱导形成胰岛素生成细胞的效率。同时,在诱导培养液中添加细胞活性素A、肝细胞生长因子以及β细胞素,他们能够不同程度促进胰岛β细胞的分化。在体外培养的胰岛β细胞中添加血管内皮生长因子和碱性成纤维细胞生长因子能够促进其增殖,添加β细胞素或胰岛素样生长因子而不添加血管内皮生长因子和碱性成纤维细胞生长因子,却促使单个胰岛细胞发生聚集成为胰岛样细胞团。Pdxl在这一变化过程中起到关键性的作用。研究结果表明,在体外培养液中添加胰岛素样生长因子1能够诱导MDSCs充分表达Pdxl,从而促进MDSCs分化为有功能的β细胞[12]。Chien等[13]的研究结果同样表明在体外一定条件下血管内皮生长因子能够促进骨骼肌卫星细胞分化为胰岛β细胞,同时高糖环境可以促进胰岛β细胞增殖。另外,无血清或低血清的基础培养液同样可以诱导骨骼肌卫星细胞分化成为类胰岛β细胞[14],但就其体外分泌胰岛素的能力有待深入探究。
刘富强等[15]研究结果证实在胰腺β细胞受损部位会聚集表达绿色荧光蛋白的肌源性内皮细胞,该研究组推测移植后的绿色荧光蛋白标记MDSCs很有可能通过分化为血管上皮细胞从而促进胰腺再生,这一研究结果表明移植MDSCs治疗糖尿病具有一定的可行性。Fujimaki等[16]在移植MDSCs治疗糖尿病大鼠的研究中发现,通过将正常大鼠胰腺的β细胞与MDSCs间接共培养能够促使MDSCs定向分化为胰岛样β细胞,结果证明体外间接共培养法可以使MDSCs定向诱导分化为胰岛样β细胞,将诱导后的MDSCs移植到糖尿病大鼠体内能够缓解糖尿病大鼠的症状。但是在这一共培养过程中,细胞微环境复杂,细胞变化难以监控,作用机制不清楚,难以应用于临床。本研究中,利用不同的诱导因子在体外直接将MDSCs诱导分化为IPCs,并对MDSCs-IPCs形态、蛋白表达及功能进行了全方位的评价。在离体培养的条件下,MDSCs-IPCs依然存在对葡萄糖刺激的反应,说明在无神经支配的条件下葡萄糖仍可调节胰岛素的分泌。本研究结果不但证实MDSCs可以在体外分化为有功能胰岛素生成细胞,而且也为糖尿病的临床治疗提供了新的研究思路和实验依据。

