酸枣仁皂苷A对小鼠前额叶皮层腺苷释放及核苷转运体的影响
魏 琳,李博林,姜晓娟,吴 琪 ,白金萍,杨晓峰,宋 伍*
(1.长春中医药大学,长春 130117;2.沈阳药科大学,沈阳 110016)
酸枣仁皂苷A(JuA)是酸枣仁中的主要活性成分。研究[1-3]表明,JuA具有广泛的药理作用,如镇静催眠、抗高血压、降脂、抗炎、抗缺氧、增强免疫力和心脏保护等作用,其镇静催眠作用引起了研究人员的关注。尽管现有研究发现JuA可能通过激活GABA受体[4]或抑制谷氨酸释放[5]发挥其中枢抑制作用,但其抑制机制至今尚未完全阐明。
腺苷是体内普遍存在的嘌呤核苷酸,它不仅是能量代谢的产物,而且还具有多种生物活性[6]。研究[7]表明,中枢神经系统(CNS)中的腺苷可诱导睡眠。因此,认为腺苷是促进大脑睡眠的物质,并且其浓度的改变将导致睡眠和觉醒的改变。人体内有2种主要类型的核苷转运蛋白:平衡核苷转运蛋白(ENT)和浓缩核苷转运蛋白(CNT),负责尿苷和腺苷的跨膜转运[8]。这2种转运体在维持中枢神经系统中的尿苷和腺苷水平方面起着非常重要的作用。本文应用在体脑微透析技术观察了JuA对小鼠自主活动和前额叶皮层(PFC)胞外腺苷释放的影响,并考察了对脑内CNT和ENT蛋白表达的影响。本研究有望为JuA的作用机制研究提供实验依据。
1 材料
1.1 动物 雄性昆明种小鼠,体质量18~22 g,购自中国医科大学实验动物中心。在室温(21±2)℃下饲养小鼠,光照时间为12 h(从早上8:00-晚上8:00),适应环境保存1~2 d。实验前将小鼠随机分组,所有实验均于8:00至17:00进行。
1.2 药物与试剂 酸枣仁皂苷A购自上海源叶生物技术有限公司;腺苷标准品购自Sigma公司(美国);乙腈(色谱纯,> 99.7%)购自天津科美尔化学试剂发展中心;磷酸二氢钠(分析纯,>99%)购自沈阳市第三试剂厂。
2 方法
2.1 实验分组与设计 将36只小鼠随机分成3组,每组12只:对照组(生理盐水,腹腔注射),JuA组(40、80 mg/kg,腹腔注射)。小鼠脑透析实验在自主活动箱中进行,即在进行微透析实验的同时也进行自主活动测试。透析结束后,小鼠断头处死,取前额叶皮层组织进行Western blot实验。
2.2 脑微透析手术及灌流 小鼠腹腔注射水合氯醛(350 mg/kg)麻醉后,固定于脑立体定位仪上。根据小鼠脑图谱,将透析导管置于小鼠前额叶皮层中,在小鼠醒来并恢复正常后18~24 h开始微透析灌注。自动灌注泵通过软塑料管与小鼠脑透析管一侧相连,另一端与集水管连接。制备林格氏液(147 mmol/L NaCl, 2.2 mmol/L CaCl2,4 mmol/L KCl),用 0.22 μm微孔滤膜过滤。丢弃前1 h内流出的透析液,此后每15 min收集1次样品。
2.3 腺苷的检测 将20 μL透析液注入HPLC-UV检测系统。色谱柱为反向碳18柱(4.6 mm×150 mm,5 μm);流动相为:0.02 mol/L乙腈,磷酸二氢钠(2:98,pH = 3~4,磷酸调节);检测波长为260 nm;流速为1 mL/min;柱温度范围为室温。
2.4 自主活动测试 小鼠运动活动盒大小为30 cm ×30 cm × 45 cm,盒内壁为黑色,盒子顶部装有照相机和红外光源。给药后立即将小鼠放入盒中,自由移动10 min后记录小鼠的运动活动,记录持续30 min。
2.5 Western blot考察 前额叶皮层组织在细胞裂解缓冲液中匀浆,用于蛋白质提取。将其在100 ℃下煮沸5 min,在150 V的8% SDS-PAGE凝胶上电泳80 min,然后通过使用Trans-Blot半干转移到聚偏二氟乙烯(PVDF)膜上。将PDVF膜用5%脱脂奶在室温下封闭2 h,然后与特异性一抗(CNT,ENT,稀释比例均为1:500),4 ℃孵育过夜。然后将样品在室温下用二抗孵育2 h,加入荧光显色剂。最终,用Image J软件分析和量化图像。
2.6 统计学方法 统计过程中使用SPSS 13.0统计软件。将前3个连续透析样品的腺苷含量作为基础值(100%),给药后每隔15 min的数据变化表示为基础值的百分比。数据采用单因素方差分析结合LSD-t检验。 P<0.05为差异有统计学意义。
3 结果
3.1 各组小鼠前额叶皮层细胞外腺苷含量变化比较 见表1。
3.2 各组小鼠自主活动数比较 见表2。
3.3 各组小鼠CNT1和ENT1蛋白表达灰度值变化比较 见表3,图1(插页一)。
4 讨论
本研究首次发现JuA可以促进小鼠前额皮质中腺苷的释放,并同时降低小鼠的自主活动数。另外,研究发现,JuA对CNT1和ENT1蛋白表达无显著性影响,提示JuA对核苷释放的促进作用与2种转运体的含量可能无直接关系。研究[9-13]表明,JuA具有镇静催眠作用,并对神经递质、受体和睡眠相关参数产生影响。CAO J X等[14]用EEG测量大鼠睡眠参数,结果显示,JuA可显著延长总睡眠时间和快动眼睡眠(REMS),而对非快速眼动睡眠(NREMS)无显著影响。
研究[15]表明,脑室内注射腺苷可以促进猫的睡眠,腺苷的全身给药也可以增加动物的睡眠和EEG慢波活动。此外,通过抑制腺苷代谢酶增加腺苷水平可促进大鼠的慢波睡眠。相反,阻断腺苷的合成可降低细胞外腺苷的浓度,有效减少睡眠[16]。腺苷受体A1和A2a在腺苷调节睡眠中起重要作用[17-19]。传统的GABA受体激动剂已显示出相对较多且严重的毒副作用。因此,基于腺苷机制的药物将为失眠的治疗提供新的选择。
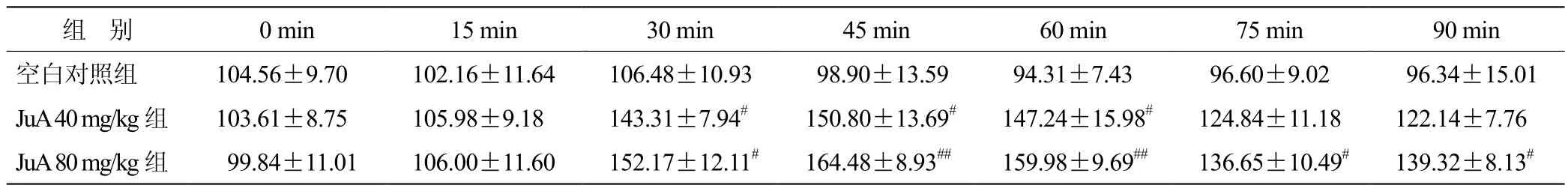
表1 各组小鼠前额叶皮层细胞外腺苷含量变化比较(x± s ,n = 12) %
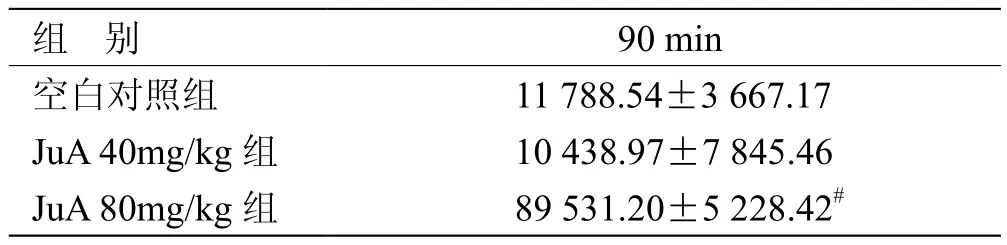
表2 各组小鼠自主活动数比较(x± s ,n = 12) 次
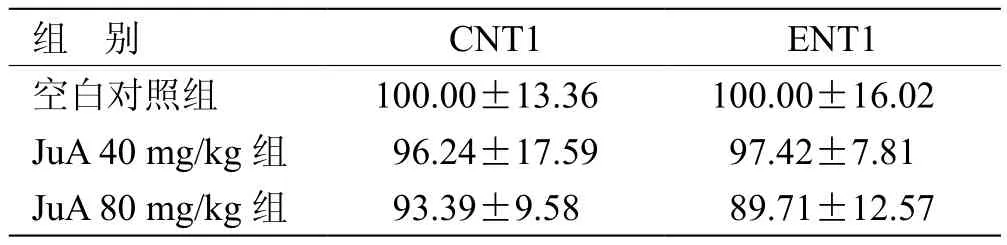
表3 各组小鼠CNT1和CNT2蛋白表达灰度值变化比较(x± s ,n = 5) %
中枢神经系统的腺苷的水平受转运蛋白ENT和CNT调控,其中ENT快速诱导核苷的跨膜转运,而CNT作为Na+依赖性转运体,转运速度较慢。本实验结果发现,JuA急性给药对2种转运体蛋白表达无显著性影响,可见增加细胞外腺苷含量的作用并非通过对转运体表达的影响,可能与JuA直接作用有关。

