复元醒脑汤对糖尿病脑梗死大鼠BMECs的影响及microRNA-503的调控机制研究*
沈俊逸 方邦江 赵智明 刘春丽 壮雨雯 徐文俊 蔡 辉#
1 中国人民解放军南京军区南京总医院 江苏 南京 210002
2 上海中医药大学附属龙华医院 上海 200032
糖尿病并发脑梗死是糖尿病最常见的血管并发症[1]。目前,糖尿病脑梗死的发病机制及有效防治成为国内外学者研究的重点与热点。糖尿病脑梗死患者长期处于高血糖的状态,微血管稀疏化、侧枝化能力降低,梗死区域长期血供不足,神经功能恢复差。我们以往研究结果提示,糖尿病脑梗死大鼠基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1)、CXC类趋化因子受体 4(C-X-C chemokine receptor type 4,CXCR4)表达下降,使得血管内皮祖细胞减少,其增殖、黏附、迁移能力降低,复元醒脑汤通过显著上调糖尿病脑梗死大鼠缺血脑组织血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白的表达,可以促进血运的重建[2-3]。但在研究中我们对SDF-1/CXCR4轴信号通路进行阻断后发现,缺血脑组织区域依然有部分血管新生和血运重建的发生,这提示糖尿病脑梗死后血管新生尚存在其他调控途径和机制。脑梗死的发生发展、预后转归与糖尿病患者的血糖水平密切相关[4]。microRNAs是一种可以与其靶mRNA分子结合,抑制相关靶基因和蛋白表达的小RNA。研究证实,microRNA-503可以动态调节血糖的平衡,microR-503能够通过与靶向的mRNA(CCNE1和CDC25A)互补配对,从而导致mRNA降解或翻译抑制,microR-503不仅能够直接调控胰岛素分泌量、胰岛发育、胰岛β细胞的分化情况等,而且还可以调节胰岛素在靶组织中的信号转导及影响其功能的发挥,从而参与了对血糖的调节过程[5-6]。研究证实,通过上调细胞CCNE1和CDC25A蛋白,在一定程度上能够抑制microR-503的表达,从而改善各种血管内皮细胞的功能,避免其损伤的反生,并且能够帮助微血管网络形成,保证血液的正常循环[7]。
本研究以糖尿病脑梗死脑皮质微血管内皮细胞(brain microvascalar endothelial cell,BMEC)为研究对象,观察复元醒脑汤[人参(单煎)、三七、水蛭各10g,石菖蒲12g,益母草30g,生南星15g,制大黄(后下)9g,浓度388g/L]以及microR-503抑制剂对其干预前后对靶基因的影响以及对BMEC细胞迁移和成管能力的影响。
1 材料与方法
1.1 材料:分述如下。
1.1.1 实验动物:20只健康雄性SD大鼠,体质量250g±25g,购自上海杰思捷实验动物有限公司[动物合格证:SCXK(沪)2011-009]。
1.1.2 主要试剂及仪器:双抗(P/S)、胎牛血清(Fetal bovine serum,FBS)和DMEM/F12培养基购买于美国Gibco公司;内皮细胞培养基(ECM,1001)购买于美国ScienCell公司;RNA抽提试剂(RNAiso Plus,9109)、反转录试剂盒(PrimeScript™ RT Master Mix,RR036A)和实时荧光定量PCR试剂盒(SYBR®Premix Ex Taq™,RR420A)购买于Takara公司(大连宝生生物);microRNA-503抑制剂、microRNA control抑制剂和Lipofectamine™RNAi MAX Transfection Reagent购买于Thermo Fisher scientific公司;结晶紫(C6158)、Ⅱ型胶原酶(C1764)、链脲佐菌素(STZ,S0130)和MTS试剂购买于美国sigma公司;Ⅷ因子子相关抗原(von willebrand factor,vwF)抗体购自美国Abcam公司(ab8822);BD基质胶Matrigel购买于美国BD公司。酶标分析仪(美国Thermo Fisher scientific公司,Multiscan go型),实时荧光定量PCR扩增仪(美国Bio-Rad公司,CFX 96型),细胞培养箱(美国Thermo公司,311型)。
1.2 实验方法:分述如下。
1.2.1 BMEC分离:取健康雄性SD大鼠20只,参照文献[8]制备糖尿病脑梗死大鼠模型。即用STZ制备糖尿病模型,线栓法制备脑梗死模型,根据Berderson评分(≥1)确定造模成功[9]。造模成功后,3%的戊巴比妥钠(0.1ml/100g)腹腔注射麻醉,颈椎脱臼法处死;75%乙醇浸泡5min消毒,打开颅腔取出完整脑组织,置于预冷的PBS液中,漂洗3次,加入1ml DMEM/F12培养液,将大脑皮质剪成体积约1mm3的小块;加入0.1%Ⅱ型胶原酶,充分混匀后置于37℃水浴消化40min,1000g离心8min;取上清后加入20%BSA悬浮,充分混匀后1000g离心20min,将中上层神经组织和大血管去除,仅保留沉淀;加入Ⅱ型胶原酶2ml,悬浮并充分混匀后置于37℃水浴消化40min,1000g离心8min,去掉上清液加入20%BSA悬浮,充分混匀,1000g离心20min,收集微红色的微血管段。
1.2.2 BMEC的培养和鉴定:以内皮细胞培养基(ECM+10%FBS+1%P/S)重悬,接种于25ml培养瓶中,置于37℃、5%C02的培养箱中培养,倒置显微镜下观察细胞形态并拍照。细胞以2×105/ml接种于24孔板中,3天后倒掉培养基,PBS洗涤,4%多聚甲醛室温固定30min,用BMEC特异性Ⅷ因子鉴定抗体vwF孵育细胞(1∶100稀释)4℃过夜,室温PBST洗3次,DAPI染核,倒置荧光显微镜下拍照。
1.2.3 空白血清和中药血清制备:连续灌药3天(根据临床经验,并依实验动物与人体表面积比计算,每日按10.4g/kg/d,2次/d给以复元醒脑汤灌胃),第3天灌药后1h,对灌药大鼠取血,制备中药血清;同时取未灌药大鼠取血制备空白血清。除菌混合,灭活补体-20℃冰箱冻存备用。
1.2.4 BMEC转染microRNA-503抑制剂:BMEC以3×105/孔铺于6孔板,分别给予5%空白血清和5%中药血清培养24h后,Lipofect RNAiMAX试剂盒转染microRNA抑制剂control和microRNA-503抑制剂60 pmol。总共4组,空白血清+抑制剂control对照组,空白血清+microRNA-503抑制剂,中药血清+抑制剂control组,中药血清+microRNA-503抑制剂组。
1.2.5 细胞迁移实验:转染24h后的BMECs消化计数后,以106个/ml的密度用无血清ECM培养基重悬,transwell小室加100μl细胞,下室加500μl含10%FBS及相应空白血清或中药血清的DMEM。迁移16h后,24孔transwell小室用0.1%结晶紫+10%甲醇显色20min后,显微镜下观察拍照后,用500μl每孔33%醋酸洗脱结晶紫,酶标仪测OD560。
1.2.6 小管形成实验:细胞转染24h后,用质量分数为0.25%的胰酶消化,然后制成细胞悬液。将100μlatrigel加到培养皿中涂匀。混匀后立即加到培养器皿中(24孔板)。将培养器皿在室温下放置25min,待胶凝固后,加入1×106BMEC细胞,转移到37℃,5%CO2的培养箱中进行培养。
1.2.7 BMECs中microRNA-503、CDC25A、CCNE1、基因表达水平检测:细胞转染24h后,继续培养48h,抽取RNA,反转录为cDNA,用于实时荧光定量PCR(Q-PCR)。引物序列如下:microRNA-503 F:CGCGGGATCGGGTCAGA,miR-503R:GGGAACATGTTGATCTCAG,U6 F:CTCGCTTCGGCAGCACA,U6 R:AACGCTTCACGAATTTGCGT,CDC25A F:GGGAATGAGCAGCCTCTTCTT,CDC25A R:ATCTCTACAAACCAGACCAGGG, CCNE1 F: ACAGCTAGCGCGGTGTAG, CCNE1R:GGACTTGGAACTCAGACCCG GAPDHF:ACTTTGGCATCGTGGAAGGG,GAPDH R:TGCAGGGATGATGTTCTGGG。PCR条件采用两步法:98℃ 10s,58℃ 20s,40次循环。
1.3 统计学方法:所有实验数据采用Graphpad prism 5统计软件进行统计学分析,计量资料以均数±标准差(-x±s)表示,组间均数比较采用方差分析,方差分析P值小于或等于0.05,用LSD-t检验进行组间两两比较。
2 结果
2.1 BMEC的分离培养和鉴定:BMEC的培养情况具体见图1A,BMEC(200×):细胞的形状呈短梭形,单层生长。高倍镜下(图1B)细胞形态更为清晰,细胞呈现梭形。通过Ⅷ因子相关抗原免疫荧光实验(图2),对照组阴性细胞没有被染色(图2A),阳性组(图2B)可以观察到实验中培养的BMEC的胞浆及细胞核周呈现绿色着色,说明内皮细胞纯度可达90%以上。根据BMEC的培养观察,BMEC阳性纯度效率、形态满足实验需要。
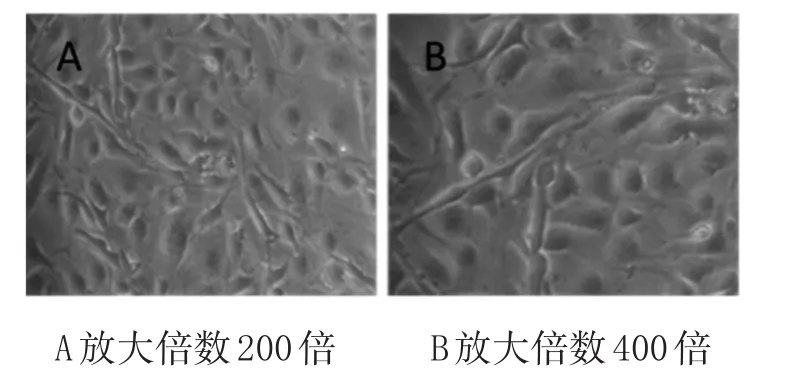
图1 白光下BMEC细胞形态
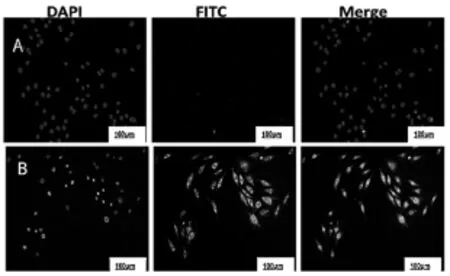
图2 BMECⅧ因子免疫荧光鉴定
2.2 复元醒脑汤治疗的大鼠血清对BMECs中microRNA-503的表达影响:我们在细胞水平中,以miR-503i作为阳性对照,抑制microRNA-503的表达,通过定量PCR的表达检测microRNA-503的表达量,观察复元醒脑汤治疗的大鼠血清是否可以有效抑制microRNA-503的表达,从而达到改善糖尿病脑梗死大鼠的治疗效果。如表1所示,与microRNA control相比,microRNA-503抑制剂能明显抑制microRNA-503的表达(P<0.05)。2.3 复元醒脑汤具有促进BMECs的迁移能力:将BMEC细胞转染microRNA抑制剂control、microRNA-503抑制剂24h后,重悬细胞,进行细胞迁移实验。如图3和表2显示相对于空白血清对照组,复元醒脑汤中药血清以及microRNA-503抑制剂组都可以明显增强BMECs的迁移
能力(P<0.05)。复元醒脑汤促进BMEC迁移能力,进一步说明了复元醒脑汤通过抑制microRNA-503的表达从而达到促进了BMEC的迁移能力。

表1 BMEC转染microRNA-503抑制剂对microRNA-503表达的抑制作用(-x±s)
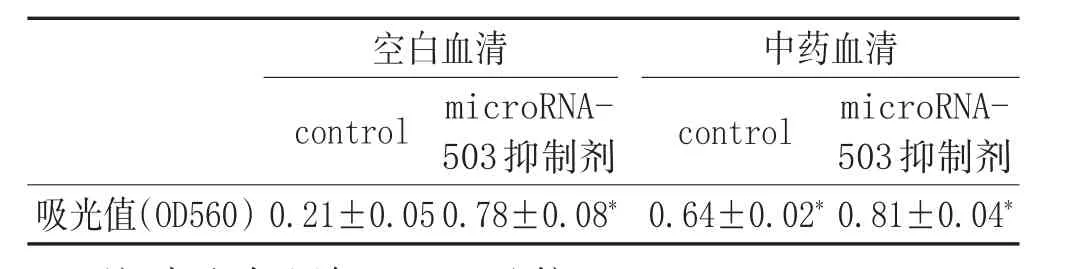
表2 酶标仪检测中药血清对BMEC迁移能力的影响(-x±s)
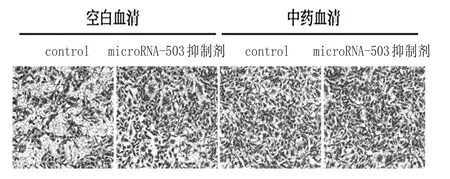
图3 中药血清对BMEC迁移能力的影响
2.4 复元醒脑汤中药血清对BMECs中microRNA-503以及CCNE1和CDC25A基因表达的影响:如表3所示microRNA-503抑制剂和复元醒脑汤中药血清都可以明显上调CCNE1和CDC25A的基因表达(P<0.05),从而抑制了microRNA-503的表达(P<0.05)。然而复元醒脑汤中药血清的抑制作用没有microRNA-503抑制剂明显。但是,microRNA-503抑制剂和复元醒脑汤中药血清联合刺激,可以更加明显地抑制microRNA-503的表达(P<0.05),复元醒脑汤对BMEC迁移和增殖的促进作用,是通过上调了CCNE1和CDC25A的表达,从而抑制了microRNA-503的表达,最终减轻了内皮细胞的损伤。
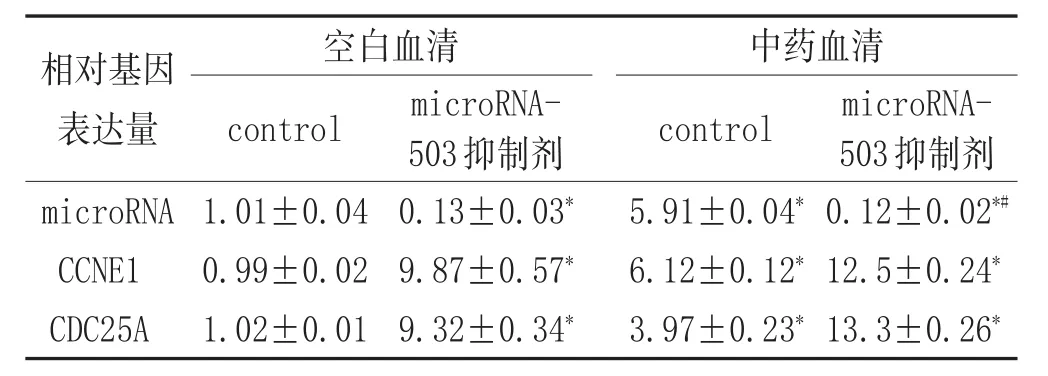
表3 复元醒脑汤中药血清对BMEC中microRNA-503以及CCNE1、CDC25A基因表达的影响(-x±s)
2.5 复元醒脑汤中药血清促进小管形成:我们利用BMEC进行小管形成实验,对复元醒脑汤中药血清在小管形成实验的修复作用进行探讨。如图4A所示空白血清对照组的小管形成能力最弱;单纯使用microRNA-503抑制剂(图4B)或复元醒脑汤中药血清(图4C)对小管形成都有一定的促进作用;联合使用miRNA-503抑制剂和复元醒脑汤中药血清(图4D)能明显促进小管的形成。实验说明,复元醒脑汤中药血清可以通过促进小管形成从而促进血管损伤的恢复。
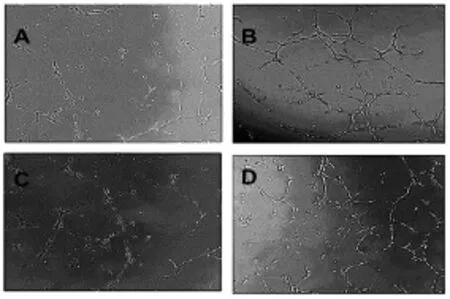
图4 不同处理组对血管内皮细胞成管能力的影响
3 讨论
在中医学中,糖尿病合并脑梗死属于消渴并发“中风”,消渴总结为燥热为标、阴虚为本,中风总结为虚、风、火、气、痰、血,主要表现为经络瘀血、肝肾阴虚以及气血阻滞。因此,此症乃是因为燥热、阴虚并存,炼液为痰,而使得经脉阻断,心窍被蒙蔽所致。治疗本病的原理在于以扶持元气为根本,辅以化痰祛瘀、熄风泄热、醒脑开窍。因此在脑梗死的治疗手段上痰瘀的消除起到关键决定性的作用,是中医治疗中风的关键。自拟复元醒脑汤(人参、生天南星、石菖蒲、三七、水蛭、益母草、大黄)治疗糖尿病脑梗死取得良好临床疗效。方中人参大补元气;生天南星、石菖蒲豁痰泻浊开窍,益母草、三七、水蛭活血逐瘀;大黄泻热凉血以熄风。前期我们对复元醒脑汤治疗糖尿病脑梗死的作用机制进行了一些相关的实验研究,结果表明复元醒脑汤改善糖尿病脑梗死患者神经缺损功能,具有保护血-脑屏障的作用,通过降低血-脑屏障的通透性,减轻脑水肿;通过降低糖尿病脑梗死的胰岛素抵抗程度而改善胰岛素敏感指数;复元醒脑汤能显著提升脑组织中SDF-1、CXCR4、VEGF基因及蛋白的表达,促进脑梗死缺血区域的神经再生和微血管新生,改善缺血脑组织的血供和神经功能的恢复[10]。复元醒脑汤的作用机制是多靶点的,对复元醒脑汤多种作用机制的研究有利于更加明确其作用机制。
糖尿病发脑梗死病患者,血管组织在高血糖的状态下受到很大的损伤,患者的梗死组织中微血管稀疏,侧枝化能力低,梗死组织长期血供不足,神经功能恢复差[11],而microRNA-503对血糖有很好的调节作用,同时对血管内皮细胞的功能恢复有重要作用。microRNA-503能够通过与靶向的mRNA(CCNE1和CDC25A)互补配对,对基因表达进行负性调控,从而导致mRNA(CCNE1和CDC25A)降解或翻译抑制。复元醒脑汤具有与microRNA-503抑制剂类似的治疗效果。本研究解释了复元醒脑汤在微血管内皮细胞中对microRNA-503相关信号通路的修复机制,丰富和发展了复元醒脑汤治疗脑梗死的作用机制,为探索相关治疗策略提出了一条新的路径。
4 参考文献
[1]KERNAN W N,VISCOLI C M,INZUCCHI S,et al.Pioglitazone improves insulin sensitivity among nondiabetic patients with a recent transient ischemic attack or ischemic stroke[J].Stroke,2003,34(6):1431-1436.
[2]陈淼,王宏,方邦江.复元醒脑汤治疗糖尿病合并脑梗死的机制研究[J].中国急救医学,2013,33(7):654-657.
[3]方邦江,周爽,沈俊逸,等.复元醒脑汤对糖尿病脑梗塞大鼠胰岛素抵抗干预作用的实验研究[J].成都医学院学报,2012,7(3):374-377.
[4]梁广雄.糖尿病合并脑梗塞的中医临床治疗探讨[J].中外健康文摘,2008,5(7):159.
[5]Okuno S,Saito A,Hayashi T,et al.The c-Jun N-terminal protein kinase signaling pathway mediates Bax activation and subsequent neuronal apoptosis through interaction with Bim after transient focal cerebral ischemia[J].J Neurosci,2004,24(36):7879-7887.[6]Wang ZQ,Wu DC,Huang FB,et al.Inhibition of MEK/ERK1/2 pathway reduces pro-inflammatory cytokine interleukin-1 expression in focal cerebral ischemia[J].Brain Res,2004,996(1):55-66.
[7]Gu Z,Qian J,Zhang G.Extracellular signal-regulated kinase 1/2 activation in hippocampus after cerebralischemiamaynotinterferewithpostischemic cell death[J].Brain Res,2001,901(1):79-84.
[8]杨翼萍,刘怀军.丝裂原活化蛋白激酶在脑缺血损伤中的作用及其调控机制[J].中国临床康复,2006,10(10):138-42.
[9]Choi J S,Park HJ,KimHY,et al.Phosphorylation of PTEN and Akt in astrocytes of the rat hippocampus following transient forebrain ischemia[J].Cell Tissue Res,2005,319(3):359-366.
[10]方邦江,周爽,沈俊逸,等.复元醒脑汤对糖尿病脑梗死大鼠脑组织血流量及含水量影响的实验研究[J].老年医学与保健,2012,18(6):381-385.
[11]夏燕军.自拟祛瘀汤为主治疗脑梗死84例临床观察[J].浙江中医杂志,2009,44(8):590.

