长程预防用量白葡奈氏菌片对中重度COPD患者机体免疫功能及生活质量的影响
刘贤兵,李芳,郑晓燕
(衢州市人民医院,浙江 衢州 324000,1.呼吸内科;2.检验科)
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)以持续的气道症状和不可逆性的气流受限为特点,同时也是全身性疾病,可引起代谢异常、心血管疾病、神经-肌肉萎缩、营养不良、贫血、抑郁、骨质疏松及肿瘤等[1],具有高患病率、致残率及病死率。目前,对于COPD治疗仍着重于改善症状,如何降低急性发病率、病死率,以及提高患者的生存质量仍是难题。COPD患者普遍存在机体免疫功能低下[2-3],且与患者病情及预后呈正相关,为此提高患者机体免疫功能仍是COPD治疗的关键措施之一。白葡奈氏菌片不仅能诱生干扰素,激活补体C3途径,提高机体免疫能力,而且能直接作用于延髓的咳嗽中枢,抑制咳嗽反射,起到明显的镇咳作用,同时也可调节植物神经功能,抑制呼吸道黏膜腺体的分泌,能使痰量明显减少[4],适合COPD患者使用。本研究观察预防用量长程白葡奈氏菌片对中重度COPD患者机体免疫功能及生活质量的影响,评估其有效性和安全性。
1 资料和方法
1.1 一般资料 选取2016年1月至2017年1月在衢州市人民医院就诊的COPD患者60例,所有患者需符合以下几点:①符合GOLD 2011 COPD诊断标准[5],肺功能符合G0LD 2-3级,用支气管舒张剂后第一秒用力呼气容积(forced expiratory volume in one second,FEV1)/用力肺活量(forced vital capacity,FVC)<70%,FEV1实测值/预计值(%)在30%~80%;②排除支气管哮喘、肺结核、支气管扩张等其他慢性肺部疾病;③既往体健,无高血压、糖尿病、心脏病及其他严重躯体疾病等病史;④未使用过免疫抑制剂及长期全身糖皮质激素等影响机体免疫功能的药物;⑤同意入组,并签署知情同意书,能配合进行5次随访(一般为期1年);⑥年龄≥40岁且≤80岁。本研究所有患者均来自衢州地区,无明显地域差异。考虑GOLD 1、4级医从性较差,未纳入研究。本研究经衢州市人民医院伦理委员会审核批准。
60例患者中男48例,女12例,平均年龄(68.5±6.45)岁,其中有吸烟史者55例(占92%)。同期随机选取我院体检中心健康体检者30例(健康对照组),其中男24例,女6例,平均年龄(66.87±6.95)岁。COPD患者与健康对照组的年龄、性别分布差异均无统计学意义(P<0.05)。
1.2 方法
1.2.1 分组:60例患者随机分成治疗组及基础组,每组30例。基础组给予基础治疗:布地奈德福莫特罗粉吸入剂(320 μg∶9 μg/吸,每次1吸,每天2次,英国阿斯利康有限公司)联合噻托溴铵吸入剂(18 μg/粒,每次1粒,每天1次,江苏正大天晴药业集团股份有限公司)。治疗组在基础治疗上加用口服白葡奈氏菌片(0.3 mg/片,每次2片,每天2次,山东齐鲁制药有限公司),疗程3个月。在随访期间如果患者出现急性加重情况,给予相应处理,除非有严重不良反应,治疗组在研究期间不得停用白葡奈氏菌片。
1.2.2 观察指标:所有患者入组后均需要随访12个月(第1、第3、第6、第9、第12个月,共5次随访),其中前3个月需要来院随访,之后电话随访。主要观察指标为:①治疗前后外周血T淋巴细胞亚群、B淋巴细胞、自然杀伤细胞(natural killer cell,NK细胞)及血清免疫球蛋白(IgG、IgA、lgM);②治疗前后肺功能检查、COPD评估测试(COPD assessment test,CAT)、改良英国医学研究学会呼吸困难指数(modified British Medical Research Council,mMRC)、医院焦虑抑郁量表(hospital anxiety and depression scale,HAD)评分;③患者治疗期间(3个月)上呼吸道感染发病情况及随访前后各1年内患者急性加重次数;④统计白葡奈氏菌片的不良反应。要求患者独立完成CAT问卷,如有疑问,可以做适当的解释,但不能做任何有暗示性的提醒,调查结束后立即统计出分值,并由患者签字。完成问卷后再进行肺功能检查。肺功能检测由我院肺功能室完成(德国耶格MasterScreen大型肺功能仪)。采用HAD进行焦虑/抑郁评估,对于HAD筛查的临界数值,目前仍不统一,本次研究采用叶维菲等[6]的研究结果,以9分作为焦虑或抑郁的临界值。mMRC:根据患者活动能力分为5级(0~4级)。mMRC的级别为2级或2级以上,提示患者的症状评分高。各类问卷调查由衢州市人民医院专科医师完成。
1.2.3 COPD急性加重的判断标准:胸部症状加重(胸闷、不适、胸部紧迫感),咳嗽、咳痰增加,呼吸急促增加(日常活动时),且至少持续2 d。
1.2.4 外周血T淋巴细胞亚群、B淋巴细胞、NK细胞检测:取EDTA-K2抗凝全血细胞悬液共50 μL,用2支已消毒试管分装,其中一支试管加入定量的复合抗体CD45-FITC、CD56-RD1、CD19-ECD和CD3-PC5 10 μL;另一支试管加入定量的复合抗体CD45-FITC、CD4-RD1、CD8-ECD和CD3-PC5 10 μL,以IgG1-FITC、IgG1-PE为阴性对照,混匀,室温避光30 min。溶血素固定处理后,上机分析。采用美国贝克曼库尔特原装试剂。流式仪型号:Beckman Coulter FC-500(美国贝克曼库尔特公司)。
1.2.5 血清IgG、IgA、IgM检测:通过自动化免疫化学分析系统(日本奥林巴斯公司,型号AV-5400O LYMPVS)自动进行稀释,加样,速率散射比浊,计算并打印结果。
1.3 统计学处理方法 应用SPSS17.0软件进行统计学分析。计量数据采用表示,多样本比较采用单因素方差分析,治疗前后比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 治疗前3组各指标比较 与健康对照组比较,治疗组和基础组患者CD3+、CD4+、CD4+/CD8+、NK细胞、B细胞、IgG、IgA、IgM降低,CD8+、HAD升高,差异具有统计学意义(P<0.05)。治疗组和基础组各免疫指标比较差异无统计学意义(P>0.05),见表1。
2.2 COPD患者治疗前后各免疫指标比较 与治疗前比较,治疗组治疗后CD3+、CD4+、CD4+/CD8+、B细胞、NK细胞、IgG、IgA升高(P<0.05),CD8+下降(P<0.05),IgM治疗前后比较差异无统计学意义(P>0.05)。基础组治疗前后各指标差异无统计学意义(P>0.05),见表2。
表1 患者各观察指标比较(每组30例
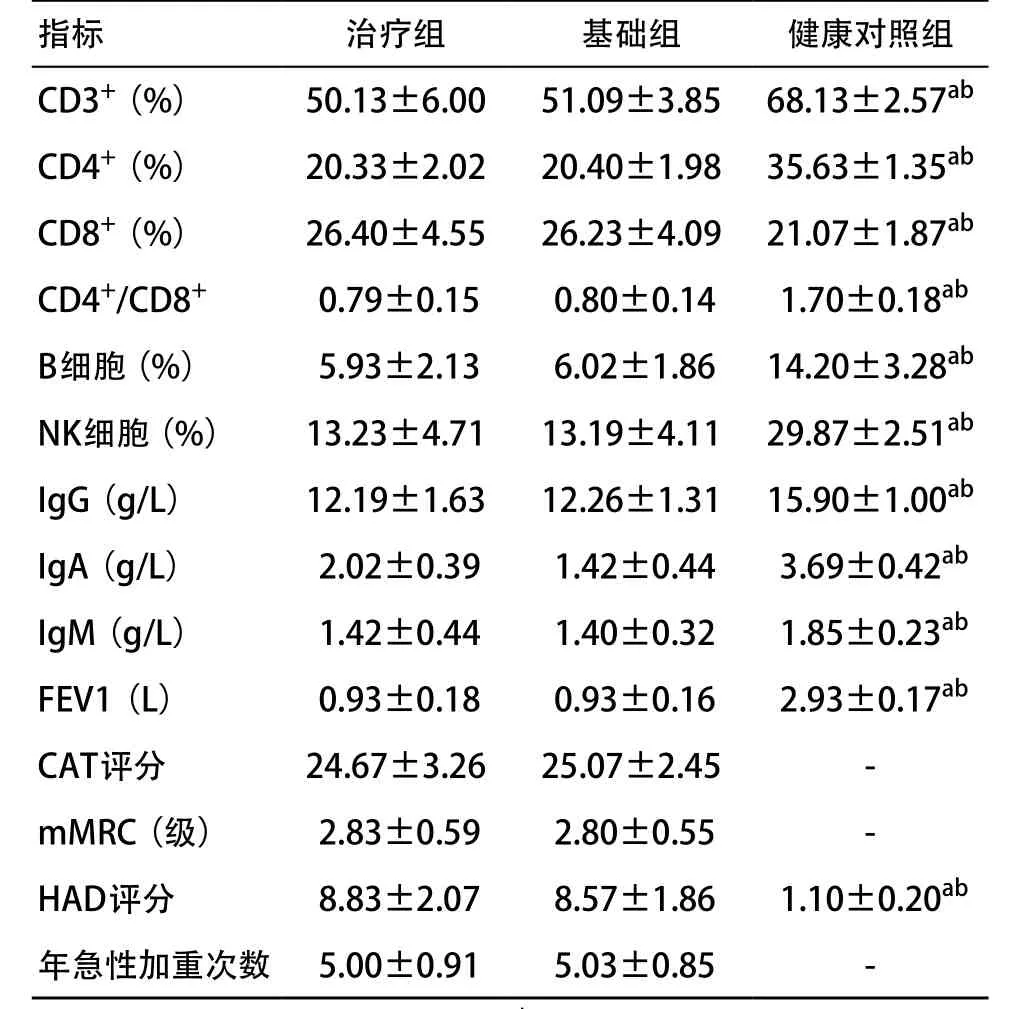
表1 患者各观察指标比较(每组30例
与治疗组比:aP<0.05;与基础组比:bP<0.05
指标 治疗组 基础组 健康对照组CD3+(%) 50.13±6.00 51.09±3.85 68.13±2.57ab CD4+(%) 20.33±2.02 20.40±1.98 35.63±1.35ab CD8+(%) 26.40±4.55 26.23±4.09 21.07±1.87ab CD4+/CD8+ 0.79±0.15 0.80±0.14 1.70±0.18ab B细胞(%) 5.93±2.13 6.02±1.86 14.20±3.28ab NK细胞(%) 13.23±4.71 13.19±4.11 29.87±2.51ab IgG(g/L) 12.19±1.63 12.26±1.31 15.90±1.00ab IgA(g/L) 2.02±0.39 1.42±0.44 3.69±0.42ab IgM(g/L) 1.42±0.44 1.40±0.32 1.85±0.23ab FEV1(L) 0.93±0.18 0.93±0.16 2.93±0.17ab CAT评分 24.67±3.26 25.07±2.45 -mMRC(级) 2.83±0.59 2.80±0.55 -HAD评分 8.83±2.07 8.57±1.86 1.10±0.20ab年急性加重次数 5.00±0.91 5.03±0.85 -
2.3 COPD患者治疗前后生活质量比较 与治疗前比较,治疗组治疗后FEV1升高,CAT、mMRC、HAD评分下降,年急性加重次数减少(P<0.05)。基础组治疗前后各指标差异无统计学意义(P>0.05)。在治疗期间治疗组、基础组上呼吸道感染例数分别为4例和15例(χ2=9.32,P=0.002),治疗组、基础组症状持续时间分别为(0.57±1.5)d和(3.5±3.4)d(t=4.30,P<0.05)。见表3。
2.4 不良反应情况 治疗组患者治疗期间均无明显不良反应发生。
3 讨论
研究发现COPD患者外周血T细胞、B细胞及NK细胞水平均异常,提示患者存在体液免疫和细胞免疫功能紊乱[7-9],且病情较重或急性加重期上述免疫指标变化更明显[10],免疫干预治疗仍是COPD防治的重要手段之一[11]。细菌溶解产物可增强人体对呼吸道感染的抵抗力,降低呼吸道感染发病率,缩短病程并减轻病情[12],但不良反应较多见。白葡奈氏菌片主要由白色葡萄球菌、奈瑟卡他球菌和枯草芽抱杆菌三种细菌的灭活菌体组成,三种成分作用机制不同,相互有协同作用,可以提高机体及气道局部的免疫力,改善呼吸道症状。
表2 COPD患者治疗前后免疫指标比较(每组30例,

表2 COPD患者治疗前后免疫指标比较(每组30例,
与治疗前比:aP<0.05
基础组治疗前 治疗后 治疗前 治疗后CD3+(%) 50.13± 6.00 53.87±2.29a 51.09±3.85 51.39±3.37 CD4+(%) 20.33± 2.30 26.40±4.55a 20.40±1.98 20.40±1.83 CD8+(%) 26.40± 4.55 20.40±1.98a 26.33±4.09 26.67±3.34 CD4+/CD8+ 0.79± 0.15 1.30±0.24a 0.80±0.14 0.78±0.12 B细胞(%) 5.93± 2.13 10.80±3.50a 6.02±1.86 6.23±1.73 NK细胞(%) 13.22± 4.72 19.07±3.42a 13.19±4.11 13.03±3.53 IgG(g/L) 12.19± 1.63 13.50±1.54a 12.56±1.31 12.23±1.17 IgA(g/L) 2.02± 0.39 2.24±0.30a 1.94±0.37 1.91±0.33 IgM(g/L) 1.42± 0.44 1.41±0.24 1.40±0.32 1.39±0.26指标 治疗组
表3 COPD患者治疗前后生活质量相关指标比较(每组30例,

表3 COPD患者治疗前后生活质量相关指标比较(每组30例,
与治疗前比:aP<0.05
基础组治疗前 治疗后 治疗前 治疗后FEV1(L) 0.93±0.18 1.33±0.21a 0.93±0.16 0.93±0.14 CAT评分 24.67±3.26 19.43±3.16a 25.07±2.45 25.03±2.37 mMRC(级) 2.83±0.59 1.73±0.52a 2.80±0.55 2.80±0.41 HAD评分 8.83±2.07 7.17±1.34a 8.57±1.87 8.60±1.71年急性加重次数 5.00±0.91 1.67±0.48a 5.03±0.85 4.93±0.87指标 治疗组
研究表明COPD患者无论是体液免疫还是细胞免疫功能均下降,故易发生呼吸道感染而使病情反复[13-14]。本研究发现,治疗组经过白葡奈氏菌片预防用量治疗3个月后患者B细胞、IgG、IgA升高(P<0.05),说明经过治疗后患者体液免疫功能改善。治疗组IgM变化差异无统计学意义,可能与IgM主要是急性时相免疫球蛋白,急性感染过后其浓度即改变有关,故无法很好地反映机体整体体液免疫情况。本研究还发现,患者经过白葡奈氏菌片预防用量治疗3个月后CD3+、CD4+、CD4+/CD8+升高,CD8+下降(P<0.05),说明给予白葡奈氏菌片预防剂量治疗对机体细胞免疫的改善也是有益的。NK细胞是机体重要的免疫细胞,是抗病毒防御的第一道防线,在体外也具有抗菌作用。COPD患者NK细胞与健康对照组比较明显下降,而治疗组治疗后患者NK细胞升高(P<0.05)。有文献[8]报道NK细胞在短时间内很难发生改变,即使经过一段时间的治疗,NK细胞的增加并不明显,但本研究发现经过白葡奈氏菌片治疗后NK细胞较前明显升高。
本研究发现,治疗组给予白葡奈氏菌片预防用量治疗3个月后患者FEV1升高,mMRC、CAT、HAD下降,年急性加重的次数减少,且在治疗期间上呼吸道感染例数明显减少,症状持续时间明显缩短。白葡奈氏菌片安全性较好,且长期服用药效不会降低,特别适用于老人、儿童和长期呼吸道感染。本研究发现治疗组患者在3个月用药过程中均无明显不良反应,患者耐受性较好,无脱落情况。
综上所述,COPD患者存在机体免疫功能的下降,提高机体免疫功能可改善患者生活质量。长程白葡奈氏菌片预防量治疗对于中重度COPD患者来说是安全有效的,不仅可提高机体的免疫功能,还可很好地控制呼吸道症状,减少上呼吸道感染的发生及症状持续的时间,可作为COPD长期防控的药物之一。但白葡奈氏菌片预防用量治疗的最佳疗程及最佳剂量,需要后续研究进一步论证。同时该制剂对COPD远期预防作用还有待进一步研究。

