干旱胁迫对不同基因型甜叶菊幼苗生理特性的影响
赵永平,姬苗苗,朱 亚,杨 攀
(商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
植物在生长发育过程中常常受到逆境胁迫,而干旱是最常见的胁迫因素[1]。我国干旱、半干旱地带占据了全国土地面积的48%,且无灌溉的旱地占到总耕地的51.9%[2],特别是在西北地区,干旱胁迫是限制农业生产的主要因素,因此,明确植物的抗旱特性,筛选适于半干旱地区农业生产的耐旱品种进行推广,是调整地方农业产业结构,实现旱地农业可持续发展的重要途径之一。
甜叶菊(SteviarebaudianaBertoni)又名甜菊,为菊科多年生草本植物,原产于南美巴拉圭和巴西交界的高山草地[3-4]。其全株含有甜菊糖苷,以叶片中含量最高,其甜度为蔗糖的250~450倍[5-6],并且其化学结构稳定,不参与人体代谢;其次,甜菊糖苷还具有控制血糖、血压,预防肥胖、抗氧化、抗癌和提高免疫力等作用[7-9],因此被广泛应用在食品、化妆品、医药和保健等行业。甜叶菊由于根系发达,抗旱、抗盐碱能力较强,近年来逐渐发展成为我国西北尤其是沙漠边缘地带防风固沙、种植业结构调整的主要经济作物[10]。目前国内外关于甜叶菊抗旱性品种筛选方面的研究较少,因此,我们探索了干旱胁迫下不同基因型甜叶菊抗性生理指标的变化,以期为干旱、半干旱地区甜叶菊耐旱品种的筛选与推广提供理论依据。
1 材料与方法
1.1 试验设计
本试验在商洛学院生物医药与食品工程学院实验教学中心进行。试验材料为引进的5个不同基因型的甜叶菊扦插种苗(表1),选取健康、整齐一致的扦插苗进行盆栽。试验设置常规灌溉(CK)、轻度干旱胁迫(MID)、中度干旱胁迫(MOD)和重度干旱胁迫(SED)4个处理,其土壤含水量分别为田间最大持水量的80%、60%、40%、20%,每个处理3次重复。在盆栽缓苗期进行常规管理;在移栽15 d后开始进行干旱胁迫处理;在处理30 d后测定甜叶菊的各项生理指标。

表1 不同基因型甜叶菊的来源及叶片特征
1.2 测定指标与测定方法
主要测定不同基因型甜叶菊幼苗的生理指标,包括保护酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶( CAT)]的活性、丙二醛( MDA)含量、可溶性蛋白含量和脯氨酸含量。超氧化物歧化酶活性用氮蓝四唑光还原法测定;过氧化物酶活性用愈创木酚比色法测定;过氧化氢酶活性用分光光度法测定;丙二醛含量采用硫代巴比妥酸法测定;可溶性蛋白含量采用考马斯亮蓝染色法测定;脯氨酸含量测定采用磺基水杨酸法[11]。
1.3 数据处理
用DPS 7.05数据统计软件对试验数据进行处理和分析,用Excel 2003进行图表绘制。
2 结果与分析
2.1 干旱胁迫对不同基因型甜叶菊幼苗保护酶活性的影响
2.1.1 干旱胁迫对不同基因型甜叶菊幼苗SOD活性的影响 在植物遭受逆境胁迫时,SOD活性变化是反映植物抗氧化系统强弱的重要指标之一。由图1可以看出,不同程度干旱胁迫对甜叶菊幼苗的SOD活性变化具有较大影响,不同基因型甜叶菊的SOD活性均随着干旱胁迫程度的加剧而呈先升高后降低的变化,其中J-LZ-09、N-ZS-3、HN-2和HX-2四个基因型甜叶菊在中度干旱胁迫下SOD活性达到最大。与其他基因型相比较,J-LZ-09的SOD活性最高,较CK提高了16.05%;而C-LN-A3在轻度干旱胁迫时SOD活性就已经达到峰值,较CK提高了15.51%。
2.1.2 干旱胁迫对不同基因型甜叶菊幼苗POD活性的影响 POD可以有效地消除植物体内积累的自由基,被公认为保护酶的重要组成之一。由图2可见,在干旱胁迫条件下,不同基因型甜叶菊POD活性变化存在显著差异,J-LZ-09、N-ZS-3和HN-2三个基因型甜叶菊随着干旱胁迫程度的增加,POD活性呈现先升高后降低的变化趋势,在轻度干旱胁迫时,POD活性均达到最高,以J-LZ-09的POD活性变化最大,较CK增加了32.69%。C-LN-A3的POD活性随着干旱胁迫程度的增加而持续升高,在重度干旱胁迫时,其POD活性达到最大,为232.16 U/g。HX-2在处于中度干旱胁迫时,POD活性最高,较CK增加了40.54%。

图1 干旱胁迫对不同基因型甜叶菊幼苗SOD活性的影响

图2 干旱胁迫对不同基因型甜叶菊幼苗POD活性的影响
2.1.3 干旱胁迫对不同基因型甜叶菊幼苗CAT活性的影响 一般在植物体遭受逆境胁迫后,CAT与POD协同消除植物体内所产生的自由基。由图3可以看出,随着干旱胁迫程度的增加,不同基因型甜叶菊的CAT活性均呈现先升高后降低的变化,其中J-LZ-09和N-ZS-3在中度干旱胁迫时,其CAT活性达到最高;而HN-2、C-LN-A3和HX-2在轻度干旱胁迫时,CAT活性就已经达到最大,其中C-LN-A3的CAT活性变幅最大,较CK提高了31.48%。
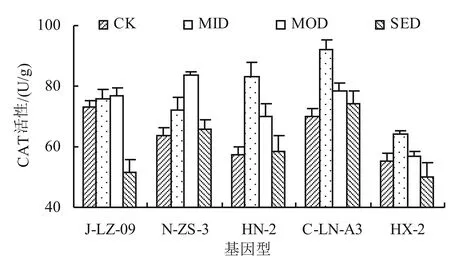
图3 干旱胁迫对不同基因型甜叶菊幼苗CAT活性的影响
2.2 干旱胁迫对不同基因型甜叶菊幼苗MDA含量的影响
在干旱胁迫条件下,由于膜脂过氧化引起膜结构破坏,质膜透性增大,丙二醛就是膜脂过氧化的分解产物,因此,其含量的变化与植物的抗性密切相关。由图4可知,不同基因型甜叶菊的MDA含量均随着干旱胁迫程度的加剧而呈现升高的趋势,在遭受重度干旱胁迫时,MDA含量均较其他胁迫处理高,其中J-LZ-09的MDA含量最高,为6.35 nmol/g,而HX-2的MDA含量变幅最大,为CK的2.82倍。
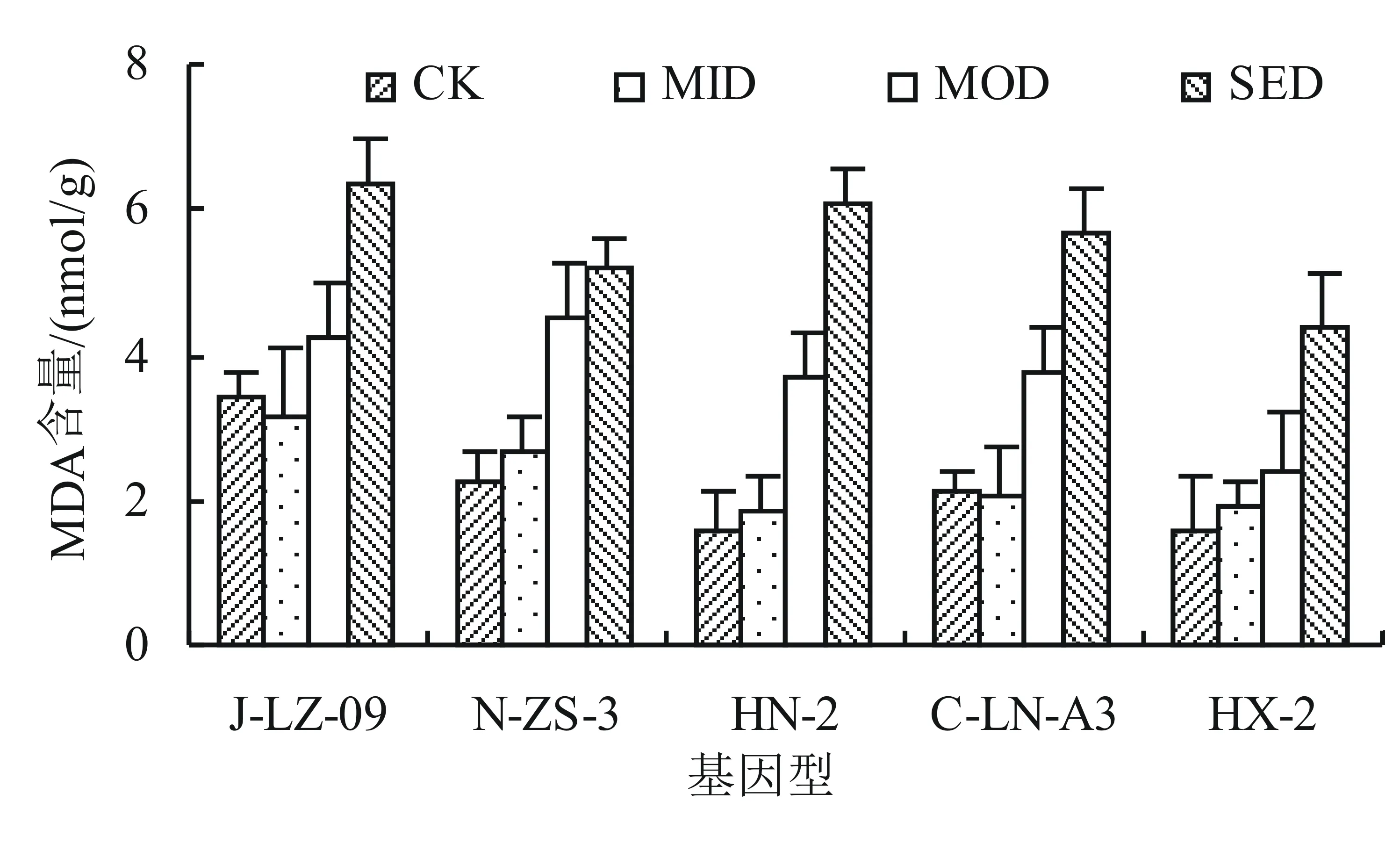
图4 干旱胁迫对不同基因型甜叶菊幼苗MDA含量的影响
2.3 干旱胁迫对不同基因型甜叶菊幼苗渗透调节物质的影响
2.3.1 干旱胁迫对不同基因型甜叶菊幼苗脯氨酸含量的影响 渗透调节是植物对逆境的一种适应性反应,脯氨酸是最重要的渗透调节物质之一,也是植物抗性评价的重要指标[12]。由图5可知,不同基因型甜叶菊的脯氨酸含量都随着土壤含水量的减少而呈现升高的趋势,在轻度干旱胁迫时,脯氨酸含量变化幅度不大,但是,随着胁迫程度进一步加剧,不同基因型甜叶菊的脯氨酸含量均急剧升高。在重度干旱胁迫时,J-LZ-09的脯氨酸含量最高,而HX-2的脯氨酸含量变幅最大,是CK的14.2倍。
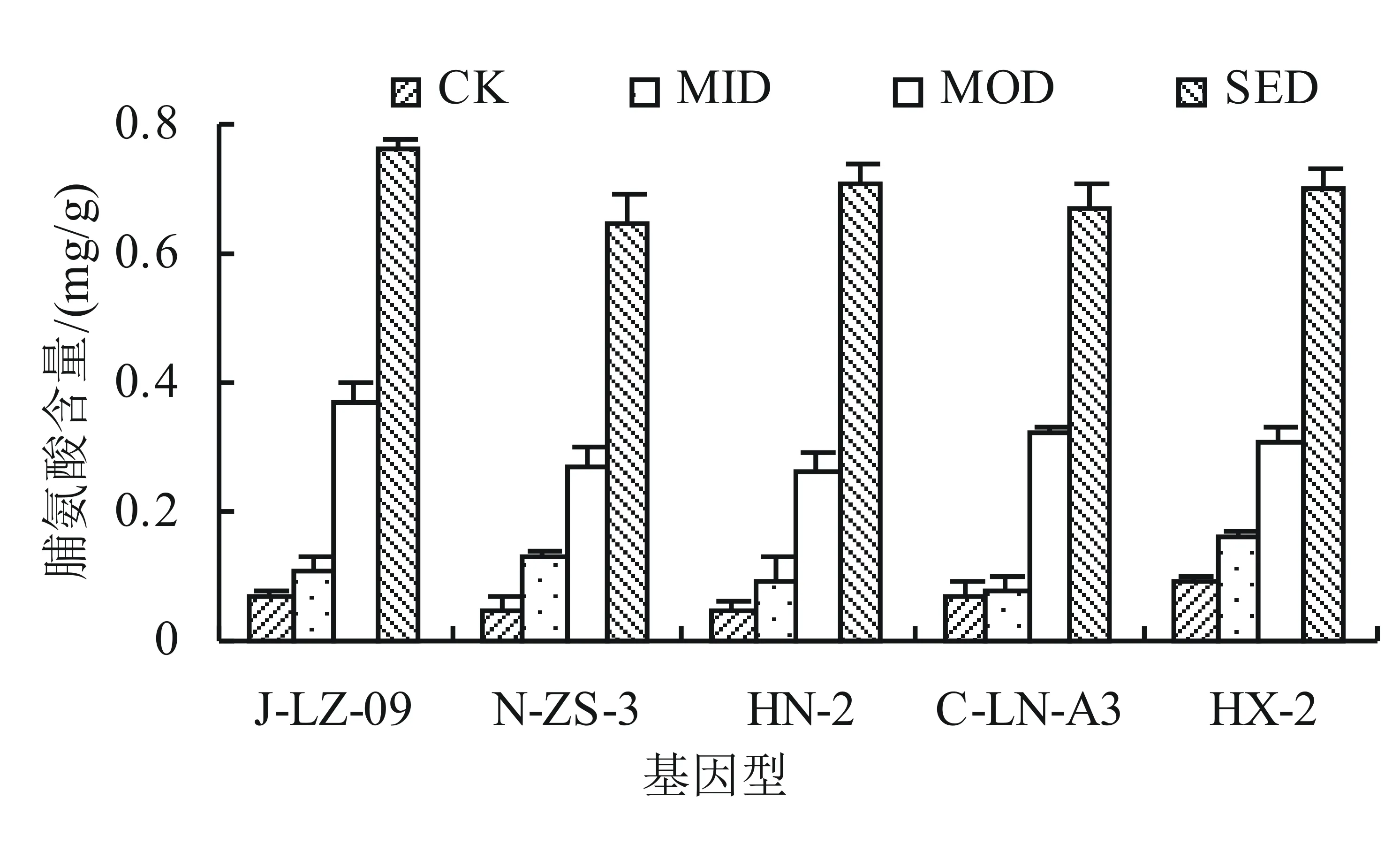
图5 干旱胁迫对不同基因型甜叶菊幼苗脯氨酸含量的影响
2.3.2 干旱胁迫对不同基因型甜叶菊幼苗可溶性蛋白含量的影响 在逆境胁迫条件下,脯氨酸可与蛋白质发生水合作用,提高蛋白质的可溶性,因此,通常也将可溶性蛋白含量作为植物抗性评价的重要指标之一[12]。如图6所示,不同基因型甜叶菊的可溶性蛋白含量均随着干旱胁迫程度的增加而逐渐升高,以HX-2的可溶性蛋白含量最大,为14.59 mg/g,且其变幅最大,较CK的可溶性蛋白含量升高了120.06%。
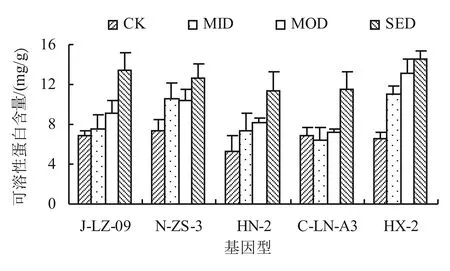
图6 干旱胁迫对不同基因型甜叶菊幼苗可溶性蛋白含量的影响
3 讨论与结论
在农业生产过程中,异常土壤、水分及气候等因素的变化都会对植物的生长和发育造成胁迫,从而引起作物减产或绝收,其中干旱所产生的损失是其他逆境胁迫产生损失的总和[13]。植物在受到干旱胁迫时,体内会产生大量的活性氧,而活性氧会破坏生物功能分子,引起膜的过氧化;在植物体内也有一个清除活性氧、维持自由基动态平衡的防御系统,细胞中的SOD、POD、CAT等保护酶就是这个防御系统的重要组成部分,因此,这些保护酶的活性常被用来反映植物体抗性的强弱[14-15]。本研究结果表明,随着干旱胁迫程度的增加,不同基因型甜叶菊的SOD、POD和CAT活性基本上均呈现先升高后降低的变化趋势(除C-LN-A3外),说明在轻、中度干旱胁迫时,各基因型甜叶菊植株体内的保护酶能够在很大程度上清除因为干旱胁迫所产生的大量自由基,使植株能够进行正常的新陈代谢;但是当干旱胁迫程度进一步加剧时,生物膜遭到严重破坏,活性氧累积量过大,保护酶活性下降,最终干旱胁迫对植物造成了较大的伤害。
干旱胁迫引发植物膜脂相变,膜透性增大,细胞代谢紊乱,活性氧大量积累,发生膜脂过氧化,使得其终产物MDA的含量快速升高,引起细胞毒害[2,14]。本试验结果表明,不同基因型甜叶菊的MDA含量均随着土壤含水量的减少而升高,说明随着干旱胁迫程度的增加,不同基因型甜叶菊细胞内活性氧的积累量迅速增加,发生膜质氧化反应,从而生成了大量的MDA。
渗透调节物质是维持细胞膨压和原有生理作用的重要物质,脯氨酸就被用来判断植物抗性的强弱。此外,脯氨酸与蛋白质结合,可以减少可溶性蛋白的沉淀,保护生命物质和生物膜,因此,可溶性蛋白也被用作植物抗性的衡量指标[2,12]。本研究发现,不同基因型甜叶菊的脯氨酸和可溶性蛋白含量都随着干旱胁迫程度的增加而呈现升高的趋势,在中度到重度干旱胁迫过程中,不同基因型甜叶菊的脯氨酸含量均急剧升高,说明在严重的水分亏缺下,细胞内脯氨酸合成酶活化、生物氧化降解过程受到抑制而积累了大量的脯氨酸,以维持细胞内外渗透压平衡。
综上所述,干旱胁迫对不同基因型甜叶菊的各生理指标变化具有显著的影响,在轻度和中度干旱胁迫下,不同基因型甜叶菊的抗氧化作用和渗透调节能力有升高的趋势,但是在重度干旱胁迫下,植株的生物膜结构遭到破坏,代谢紊乱,生理作用受到严重影响。在参试的5个基因型中,J-LZ-09的脯氨酸含量最高,在中度干旱胁迫下,其SOD和POD活性均最高,较CK分别提高了16.05%和32.69%。但是,HX-2的脯氨酸和可溶性蛋白含量变幅最大,较CK分别升高了13.2倍和1.2倍。

