Ni-MOF的合成、表征及其CO2吸附性能
, , , , ,
(1.福建工程学院 生态环境与城市建设学院, 福建 福州 350118;2.福州大学 环境与资源学院, 福建 福州 350116)
随着经济的快速发展,工业排放的CO2越来越多。根据国际二氧化碳信息分析中心(http://cdiac.esd.ornl.gov/GCP/)数据可知,截止到2015年7月,大气中CO2的浓度达到0.782 mg/L,比2014年7月的0.777 mg/L增加了0.005 mg/L, 未来还将加速上升, 造成全球气温每年以+0.68 ℃的速率上升,海平面以(2.99±0.4) mm的速度增加,对人类的生存和发展造成巨大的危害。在《京都议定书》中列出的温室气体中,CO2占温室气体排放总量的82%,温室效应占总效应的64%,成为最主要的温室气体。因此,CO2的消减和控制成为控制温室效应的重点内容之一[1]。人为排放的CO2主要由化石燃料燃烧产生,从燃煤烟气中捕集分离CO2是主要的控制技术。目前,常用的控制技术主要有吸收法、生物法、膜分离法、吸附法等,其中,通过吸附剂捕集和分离CO2是一种经济和相对成熟的方法[2]。金属-有机骨架材料(metal-organic frameworks, MOFs)是近年来兴起的一类多孔材料,它具有比表面积高、孔隙率可调,吸附容量大等特点,是一种极有前景的气体捕集分离和存储材料[3-7]。由于Ni具有开放的金属点位,以Ni为金属中心的MOF材料,与气体具有很好的结合效果,使Ni-MOF材料对气体的吸附效果比许多金属-有机骨架材料的吸附效果好[8-9]。 本研究以硝酸镍为金属离子源、1,4-对苯二甲酸为有机配体,N,N-二甲基甲酰胺为溶剂,采用溶剂热法合成Ni-MOF晶体,并对结构性能进行表征,测定Ni-MOF的CO2的吸附性能,探讨Ni-MOF作为CO2吸附材料的可行性。
1 实验部分
1.1 主要试剂
Ni(NO3)2·6H2O(AR,国药集团),N-N二甲基甲酰胺(≥99%,国药集团),对苯二甲酸(>99%,阿拉丁),四氟硼酸(>40%,国药集团),二氯甲烷(≥99.5%,国药集团),甲醇(≥99.5%,国药集团)
1.2 合成方法
将Ni(NO3)2·6H2O(1.14 g, 3.92 mmol),对苯二甲酸(0.44 g, 2.63 mmol),加入到40 mL N,N-二甲基甲酰胺中,超声30 min后,滴加少量氟硼酸,转入带四氟乙烯内衬的高压应釜中,在150 ℃下反应一定时间,自然冷却到室温,抽滤后得到绿色粉状样品。
1.3 活化方法
用N,N-二甲基甲酰胺淋洗样品数次,转入到二氯甲烷溶液中,每12 h 换溶液1次,3 d后离心,倾去上清液,然后加入一定量的甲醇,每12 h 换溶液1次,3 d后超声振荡后抽滤,将样品置于150 ℃真空干燥4 h得到活化后样品。
1.4 表征
采用X射线粉末衍射仪(BSA-124S-CW, Panalytical公司)分析晶体结构,扫描电镜(Tecnai G2F20 S-TWIN 200 kV, FEI公司)测试表面形貌,傅里叶红外光谱仪(SP2000, 美国)分析晶体表面官能团。比表面积与孔径分析仪(ASAP-2020, Micromeritics)测定样品的比表面积和结构参数,常压综合分析仪(STA409PG, NETZSCH)测定热稳定性。
1.5 CO2吸附性能
称取15 mg活化后样品于坩埚中,在氮气(50 cm3/min)保护下,以10 K/min的速度升温至423 K,恒温60 min,去除样品表面的水分、CO2等客体分子,然后冷却至目标温度后通入CO2(50 cm3/min)进行吸附试验,结束后重复脱附/吸附操作,测试循环吸附性能。采用比表面积与孔径分析仪(ASAP-2 020, Micromeritics)测定CO2吸附等温线,称取100 mg样品,在473 K脱气10 h,然后转到分析站进行吸附分析。
2 结果与讨论
2.1 表征结果
图1为样品的PXRD谱图,由图1可知,在8.2°、12.8°、17.0° 3个位置出现了明显的衍射峰,与文献[10]报道的结构相似。表明实验合成的样品的结晶度较好。
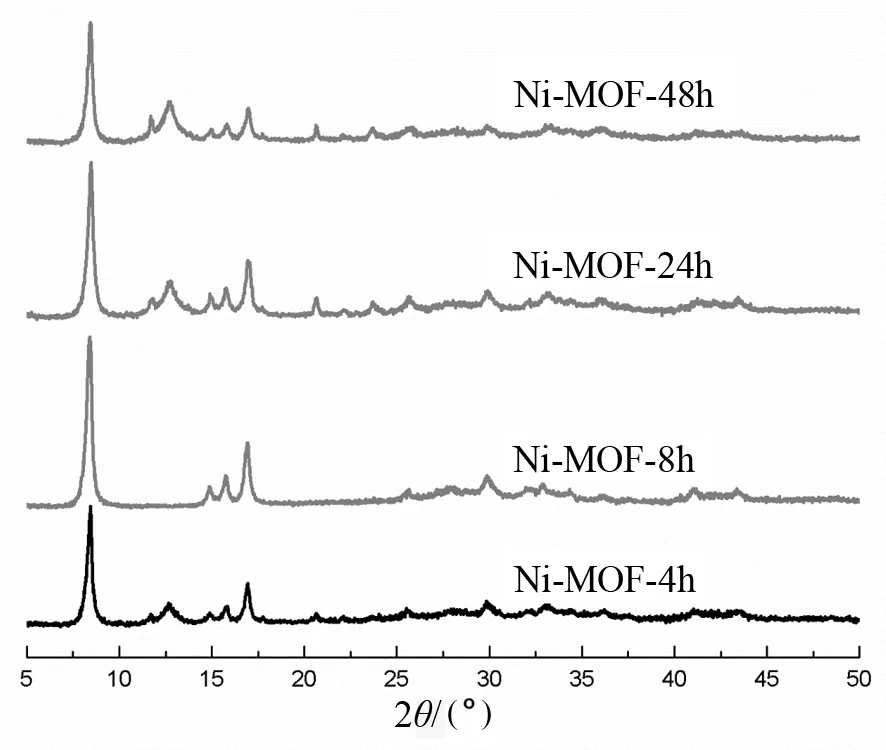
图1 样品的PXRD图Fig.1 PXRD patterns of samples
样品的红外谱图如图2所示。由图2可知,在753,852,1 387~1 600 cm-1范围内存在两个强烈的红外吸收峰。根据文献[11-12]报道,羧酸官能团中C—O振动主要位于这个区域。其中位于1 585 cm-1处的峰是COO不对称伸缩振动引起,而1 380 cm-1处峰属于COO对称伸缩振动。因此可以推断对苯二甲酸上的羧基上的CO键未发生断裂,羧基可能是采取了桥式单氧单齿型配位模式。在指纹区存在的吸收峰,主要由于对苯二甲酸盐面外振动引起。其中位于735 cm-1特征吸收峰可能是样品四面体Ni—O的伸缩振动引起的,823 cm-1特征吸收峰主要是由于C-H面外弯曲振动引起[13]。在3 500~3 582 cm-1波段处,有明显吸收峰产生,表明样品中可能含有大量配位水或结晶水。Ni-MOF-24h、Ni-MOF-48h峰的强度比Ni-MOF-4h、Ni-MOF-8h弱,这可能是样品吸附溶剂分子导致的。
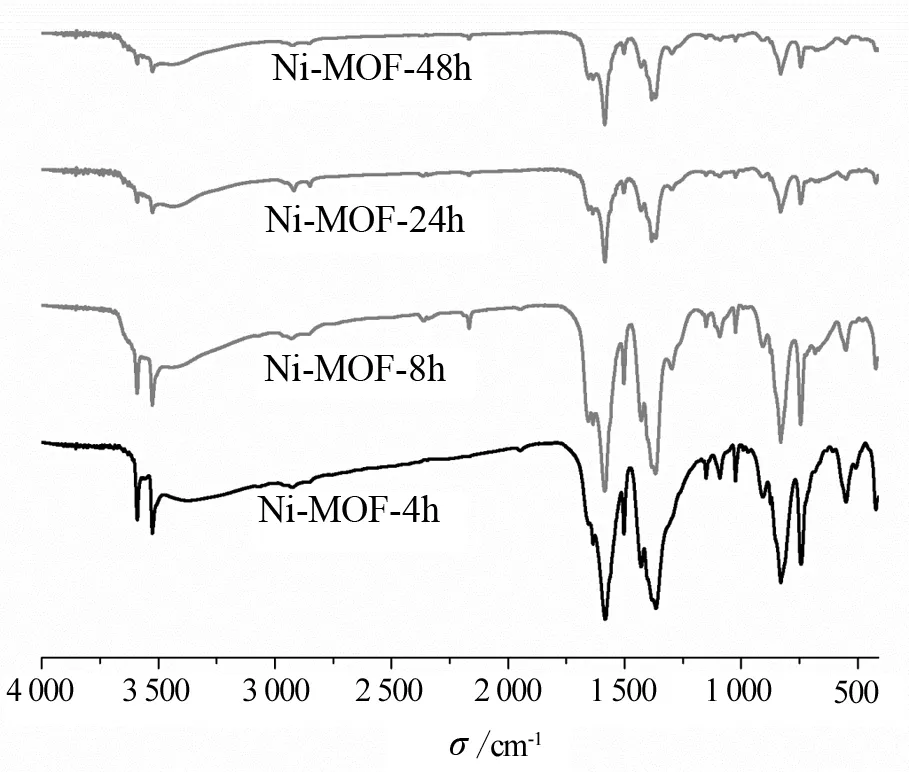
图2 样品的红外光谱图Fig.2 IR spectrum of samples
样品的扫描电镜如图3所示,由图3可知,不同时间合成的晶体形貌大致相同,均为球体结构,大小不等,表面粗糙,在放大1万倍下观察,表面为薄片积聚成球体结构,晶体颗粒相对完整,部分晶粒可能由于真空干燥出现裂缝。

图3 样品的扫描电镜图Fig.3 SEM images of samples
样品的热失重曲线如图4所示,由图4可知,30~280 ℃为第1个失重平台,主要失去样品中残存的溶剂及水、CO2等客体分子,失重率分别约10%( Ni-MOF-4h)、13%(Ni-MOF-8h)、19%(Ni-MOF-24h、Ni-MOF-48h);280~316 ℃为第2个失重平台,主要源于骨架中的配位水、—OH及骨架的氧化分解。Ni-MOF-4h、Ni-MOF-8h在此温度段平稳下降,失重率低于Ni-MOF-24h、Ni-MOF-48h,Ni-MOF-4h的热失重率最低,Ni-MOF-8h次之,Ni-MOF-24h、Ni-MOF-48h的相同。这可能由于样品吸附的溶剂分子在此温度段下脱附,反应时间越长,吸附越多,失重率越大,在24 h时达到吸附平衡,因而Ni-MOF-24h、Ni-MOF-48h失重率基本相同。这与红外图谱中Ni-MOF-24h、Ni-MOF-48h峰的强度较弱相对应。在316~430 ℃,出现第3个明显的失重平台,主要由于样品氧化分解为Ni的氧化物。

图4 TGA curves of samplesFig.4 样品的热失重曲线
样品的N2吸附/脱附等温线如图5所示,结构参数如表1。由图5可知,4个样品的N2的吸附/脱附曲线形状相似,均为Ⅰ型曲线,低压下(P/P0=0~0.30)N2吸附量增加迅速,吸附曲线与脱附曲线基本重合,表明样品中有大量微孔存在,P/P0= 0.9~1.0时,曲线出现小范围上升,表明样品有大孔的存在。表1为样品的结构参数。由表1可知,样品的BET面积在1 200~1 221 m2/g,平均孔径1.95 nm,表明反应时间对Ni-MOF的比表面积和结构参数影响不大,因而在150 ℃反应4 h是合适的。
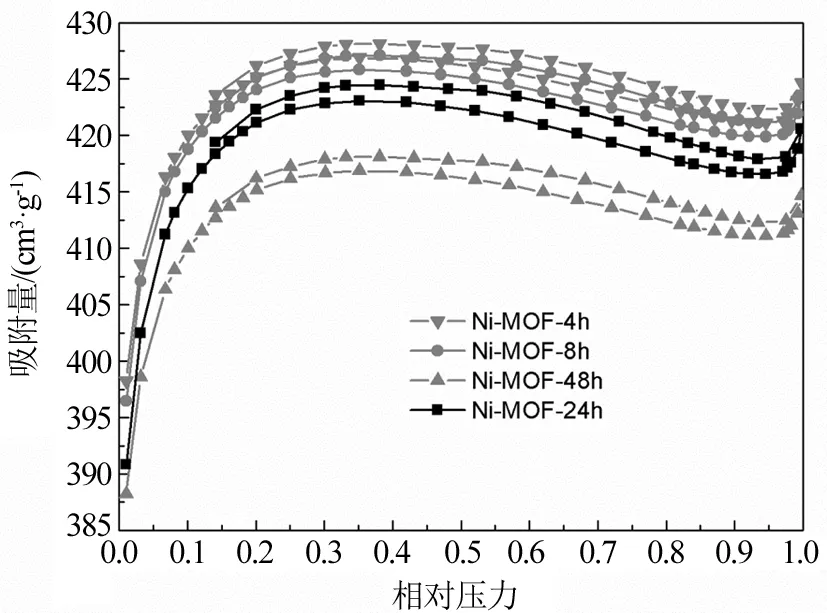
图5 Ni-MOFs的N2吸附/脱附等温线Fig.5 N2 absorption/desorption isotherm of Ni-MOFs
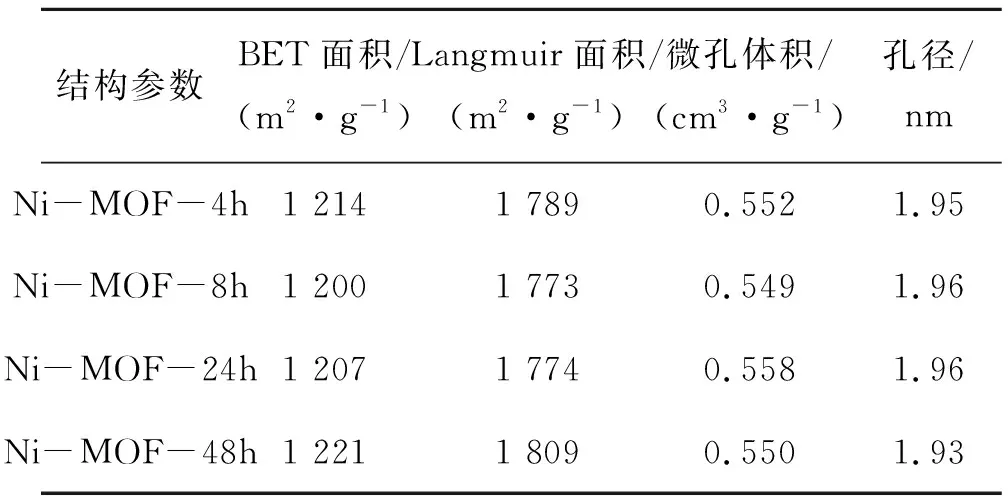
结构参数BET面积/(m2·g-1)Langmuir面积/(m2·g-1)微孔体积/(cm3·g-1)孔径/nmNi-MOF-4h1 2141 7890.5521.95Ni-MOF-8h1 2001 7730.5491.96Ni-MOF-24h1 2071 7740.5581.96Ni-MOF-48h1 2211 8090.5501.93
2.2 静态吸附性能
Ni-MOF-24h的CO2吸附曲线如图6所示。从图6可知,常压,300,303,306 K时,样品对CO2的吸附量分别为17.95%(4.08 mmol/g)、13.53%(3.08 mmol/g)、10.50%(2.87 mmol/g),比改性后活性炭的吸附量7.56%[9]、分子筛1.01 mmol/g的吸附量要高出许多。随着温度升高,样品对CO2的吸附量逐渐降低。从图6还可知,随时间延长,对CO2的吸附量逐渐增加,增加速率逐渐减慢。27 ℃时,第1个30 min的增加率为9.01%,在第2个30 min的增加率减小为3.86%,而后依次为2.85%、2.24%。这可能是温度的升高使CO2的物理吸附量降低,因此吸附量随温度升高而下降。
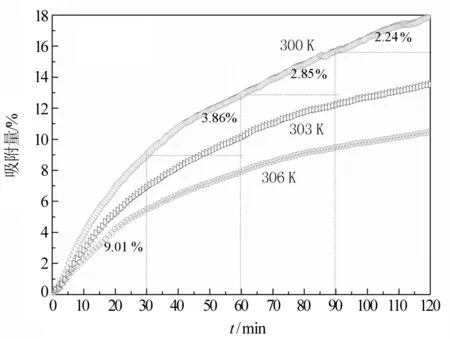
图6 CO2吸附曲线Fig.6 CO2 adsorption curves
2.3 循环吸附性能
实际应用中,良好的吸附剂不仅要有较高的吸附量,还要有良好的循环吸附稳定性。常压27 ℃时,对Ni-MOF-24h进行10次吸附/脱附循环试验,考察吸附稳定性,结果如图7所示。
由图7可知,经10次循环实验后,Ni-MOF-24 h对CO2的2 h吸附量稳定在16.5%~17.9%,具有良好的循环吸附稳定性。

图7 Ni-MOF-24h的循环吸附性能Fig.7 Cyclic CO2 adsorption of Ni-MOF-24h
3 结论
采用溶剂热法合成了Ni-MOF晶体,BET表面积为1 200~1 221 m2/g,孔径为1.93~1.96 nm。Ni-MOF在260 ℃以内可保持结构的热稳定性,在常压27 ℃时,对CO2吸附量达到17.9%,经10次循环吸附/脱附实验后,吸附量稳定在16.5%~17.9%之间,表现出良好的循环吸附稳定性,是一种良好的吸附剂。

